- 2021-05-14 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学知识点之碳的多样性和硅
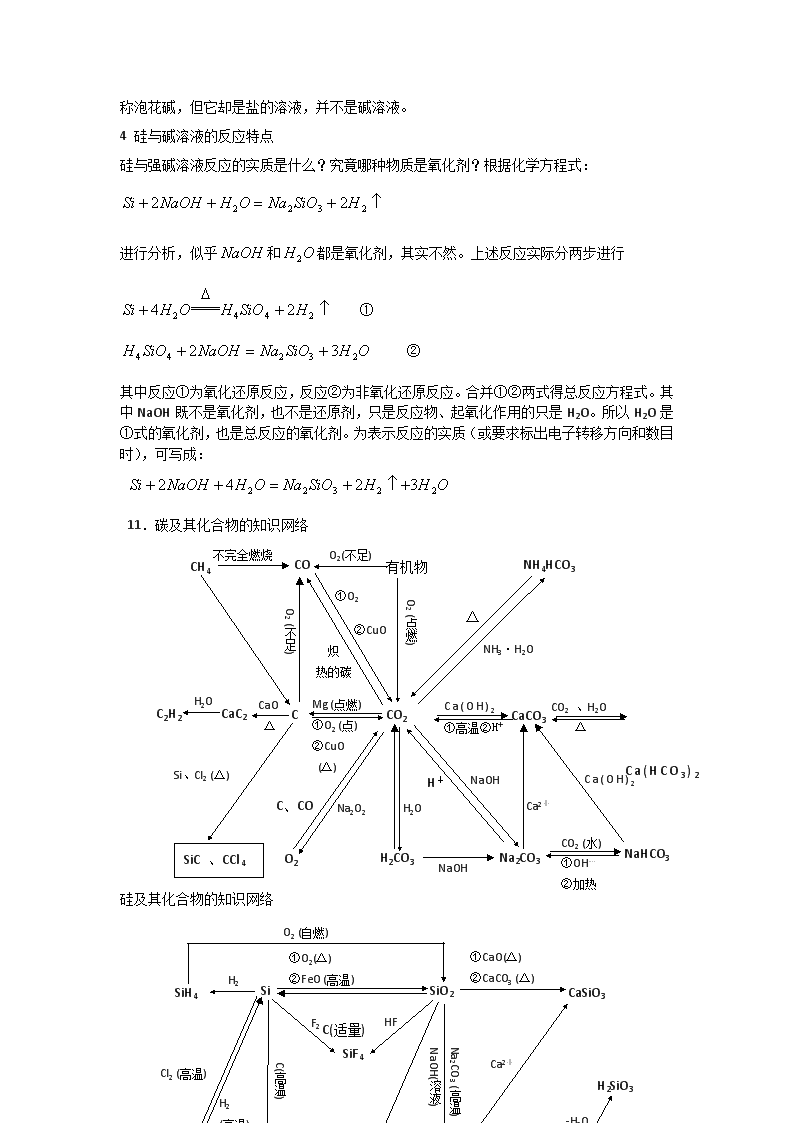
高考化学知识点之碳的多样性和硅 考试要点 1.碳族元素原子结构的特点、碳族元素化合价为正四价和正二价; 2.碳族元素的性质及其递变规律; 3.碳和硅的性质、用途。 难点聚焦 碳和硅的化学性质 化学性质 碳 硅 还原性 与单质反应 (不稳定) 与氧化物反应 与酸反应 不与、等反应,但有: 与水或碱溶液反应 与反应 二氧化碳和二氧化硅的结构、性质比较 项目 类别 酸性氧化物 酸性氧化物 晶体类型 分子晶体 原子晶体 熔点和沸点 低 高,硬度大 化学性质 不溶于水,与水也不反应 联系 3 硅及其化合物的特性 1. Si的还原性大于C,但C却能在高温下还原出Si: 2. 非金属单质跟碱液作用一般无放出,但Si却放出H2: 3. 非金属单质一般不跟非氧化性酸作用,但Si能与HF作用: 4. 非金属单质一般为非导体,但Si为半导体。 5. SiO2是的酸酐,但它不溶于水,不能直接将它与水作用制备H2SiO3。 6. 非金属氧化物的熔沸点一般较低,但SiO2的却很高。 7. 酸性氧化物一般不与酸作用,但SiO2能跟HF作用: 8. 无机酸一般易溶于水, 却难溶于水。 9. 因H2CO3的酸性大于H2SiO3,所以在Na2SiO3溶液中通入CO2能发生下列反应:,但在高温下 也能发生。 10. Na2SiO3 的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)俗称泡花碱,但它却是盐的溶液,并不是碱溶液。 4 硅与碱溶液的反应特点 硅与强碱溶液反应的实质是什么?究竟哪种物质是氧化剂?根据化学方程式: 进行分析,似乎和都是氧化剂,其实不然。上述反应实际分两步进行 ① ② 其中反应①为氧化还原反应,反应②为非氧化还原反应。合并①②两式得总反应方程式。其中NaOH既不是氧化剂,也不是还原剂,只是反应物、起氧化作用的只是H2O。所以H2O是①式的氧化剂,也是总反应的氧化剂。为表示反应的实质(或要求标出电子转移方向和数目时),可写成: 11.碳及其化合物的知识网络 C CO2 CaCO3 CaC2 C2H2 CO 有机物 NH4HCO3 CH4 H2CO3 Na2CO3 NaHCO3 O2 SiC 、CCl4 不完全燃烧 O2(不足) O2 (不足) ①O2 ②CuO 炽 热的碳 NH3·H2O O2 (点燃) △ H2O CaO △ Si、Cl2 (△) Mg (点燃) ①O2 (点) ②CuO (△) C、CO Na2O2 NaOH H2O NaOH H+ Ca(OH)2 ①高温②H+ Ca2+ CO2 、H2O △ Ca(OH)2 CO2 (水) ①OH― ②加热 Ca(HCO3)2 硅及其化合物的知识网络 Na2SiO3 CO2,H2O NaOH H2SiO3 SiH4 Si SiO2 CaSiO3 SiF4 H4SiO4 SiC SiCl4 O2 (自燃) H2 ①O2(△) ②FeO (高温) F2 HF Cl2 (高温) H2 (高温) C(高温) C(高温)足量 Na2CO3 (高温) NaOH(溶液) ①CaO(△) ②CaCO3 (△) Ca2+ -H2O C(适量)查看更多