- 2021-05-14 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考模拟
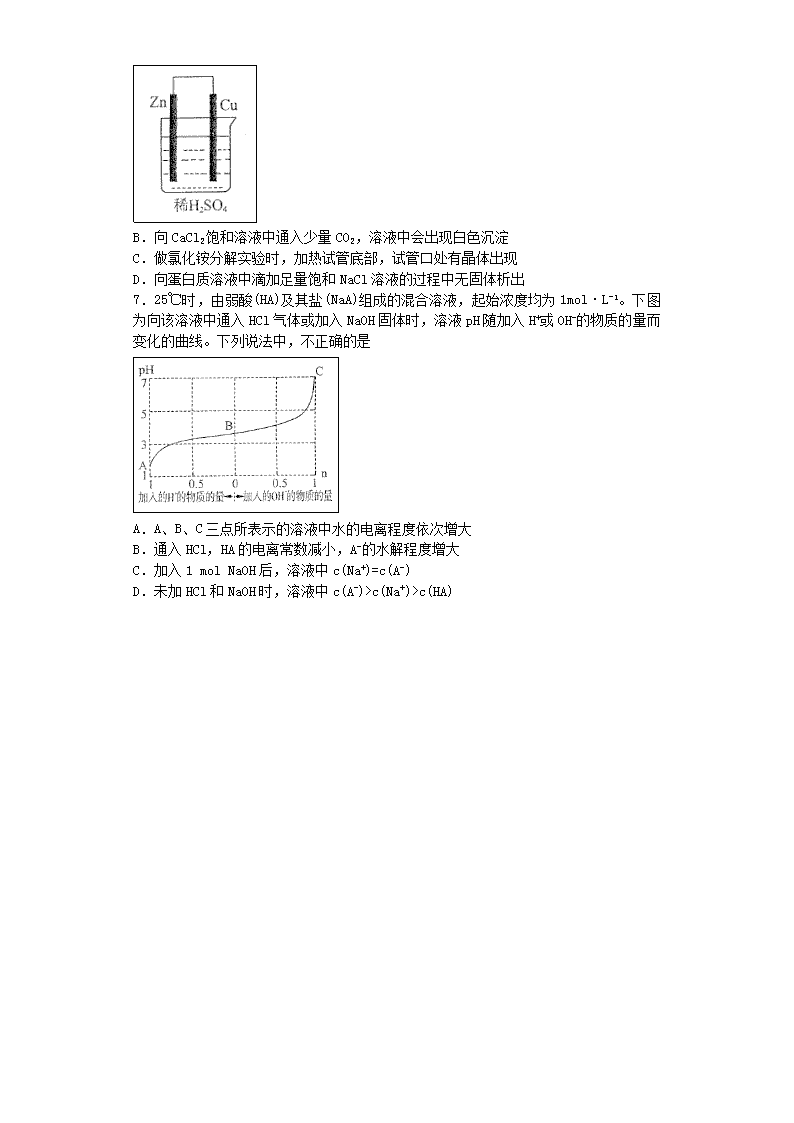
2013-2014学年度???学校5月月考卷 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 第I卷(选择题) 请点击修改第I卷的文字说明 评卷人 得分 一、选择题(题型注释) 1.化学与生产、生活密切相关。下列叙述中,正确的是 A、天然纤维和人造纤维的主要成分都是纤维素 B、用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 C、钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 D、黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 2.原子结构决定元素的性质,下列说法中,正确的是 A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 C.第2周期元素的最高正化合价都等于其原子的最外层电子数 D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 3.下列各项中,两种物质间反应均产生1 mol气体时,参加反应的酸的物质的量最少的是 A.碳与浓硝酸 B.铜与浓硫酸 C、锌与稀硫酸 D.二氧化锰与浓盐酸 4.桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下: 以下关于这三种有机物的说法中,不正确的是 A.都能与Na2CO3溶液反应产生CO2 B.一定条件下,均能与乙醇发生取代反应 C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应 D.1 rnol阿司匹林最多能与l mol NaOH反应 5.铅蓄电池的反应原理为:2PbSO4+2H2OPb+PbO2+2H2SO4,下列叙述中,正确的是 A.PbSO4的氧化性比PbO2的强、还原性比Pb的强 B.放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 C.放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 D.充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 6.下列有关实验现象的描述中,正确的是 A.如图所示装置中,锌电极上一定没有气泡生成 B.向CaCl2饱和溶液中通入少量CO2,溶液中会出现白色沉淀 C.做氯化铵分解实验时,加热试管底部,试管口处有晶体出现 D.向蛋白质溶液中滴加足量饱和NaCl溶液的过程中无固体析出 7.25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是 A.A、B、C三点所表示的溶液中水的电离程度依次增大 B.通入HCl,HA的电离常数减小,A-的水解程度增大 C.加入1 mol NaOH后,溶液中c(Na+)=c(A-) D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA) 第II卷(非选择题) 请点击修改第II卷的文字说明 评卷人 得分 二、填空题(题型注释) 8.(16分)碳、氮、硫、氯是四种重要的非金属元素。 (1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。 已知:a.2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1 b.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1 则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。 (2)工业上合成氨气的反应为:N2(g)+3H2(g)2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率()与体系总压强(P)、温度(T)的关系如图所示。回答下列问题: ①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。 ②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。 (3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表: HClO HSCN H2CO3 K=3.210-8 K=0.13 Kl=4.210-7 K2=5.610-11 ①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为 > > > 。 ②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 。 ③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是 (填下列各项中序号)。 a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸 b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸 c、用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸 9.铁及其化合物应用广泛。 (1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图: ①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。 a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d、铁粉 ②在吸收塔中,生成副产品FeCl。的离子方程式为 (2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。 (3)硫化亚铁常用于工业废水的处理。 ①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明): (已知:25℃时,溶度积常数Ksp(FeS)=6.310-18、Ksp(CdS)=3.610-29) ②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O=Cd2(OH)2CO3+A。则A的化学式为 。 10.氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题: (1)氯碱工业是利用电解食盐水生产 为基础的工业体系。 (2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。 a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠 c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠 (3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下: 成分 NaCl Mg(OH)2 CaCO3 BaSO4 其他不溶物 质量分数(%) 15~20 15~20 5~10 30~40 10~15 利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。 回答下列问题: ①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。 ②过滤所得滤渣的主要成分为 。 ③根据图分析,蒸发结晶过滤所得晶体A主要成分为 。 ④真空干燥MgSO4·7H2O晶体的原因是 。 11.合成一种有机化合物的途径往往有多种,下图所示为合成醇类物质乙的两种不同途径。 回答下列问题:(1)甲分子中含氧官能团的名称是 ,由甲催化加氢生成乙的过程中,可能有 和 (写结构简式)生成。 (2)戊的一种属于芳香烃的同分异构体的核磁共振氢谱有两组峰,且峰面积比为3:1,写出戊的这种同分异构体的结构简式 。 (3)由丁丙的反应类型为 ,检验丙中是否含有丁可选用的试剂是 (填下列各项中序号)。 a.Na b.NaHCO3溶液 c.银氨溶液 d.浓硫酸 (4)物质乙还可由C10H19Cl与NaOH水溶液共热生成。写出该反应过程中,发生反应的化学方程式并注明反应条件: 。(有机化合物均用结构简式表示) 评卷人 得分 三、实验题(题型注释) 12.某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: (1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有 、 。 (2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是 (填下列各项中序号)。 ②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-CuCl42-(黄色)+4H2O。 欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 (填下列各项中序号)。 a.FeCl3固体 b.CuCl2固体 c.蒸馏水 (3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。 ①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为: 第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 。 ②300~400oC范围内,固体质量明显增加的原因是 ,上图所示过程中,CuSO4固体能稳定存在的阶段是 (填下列各项中序号)。 a.一阶段 b、二阶段 c、三阶段 d、四阶段 ③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。 a.装置组装完成后,应立即进行的一项操作是 。 b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为 溶液。 c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为 。 评卷人 得分 四、计算题(题型注释) 评卷人 得分 五、简答题(题型注释) 评卷人 得分 六、推断题(题型注释) 参考答案 1.D 【解析】 试题分析:A、天然纤维中的棉、麻为纤维素,蚕丝为蛋白质,不是纤维素,错误;B、用活性炭为糖浆脱色的原理是活性炭的吸附性,用臭氧漂白纸浆的原理是臭氧的强氧化性,错误;C、铜的活泼性小于H,所以铜制品不能发生析氢腐蚀,错误;D、黄河水中泥沙小颗粒形成了胶体,海水含有较多的电解质,豆浆为胶体,所以黄河入海口沙洲的形成与用卤水点豆腐,都发生了胶体的聚沉,正确。 考点:本题考查物质的分类、漂白原理、金属的腐蚀、胶体。 2.B 【解析】 试题分析:A、Na+、Al3+为10e‾离子,Cl‾为18e‾离子,Cl‾半径大于Na+、Al3+半径,错误;B、因为F元素的非金属性最强,所以在第ⅥA族元素的氢化物(H2R)中,HF热稳定性最强,因为HF分子间能形成氢键,所以HF的沸点也最高,错误;C、第2周期元素非金属性强的O元素、F元素没有最高正化合价,错误;D、非金属元素的非金属性越强,其最高价氧化物对应水化物的酸性也一定越强,错误。 考点:本题考查元素周期律。 3.A 【解析】 试题分析:A、碳与浓硝酸的反应为:C+4HNO3=CO2↑+4NO2↑+2H2O,产生1mol气体需HNO3 0.8mol;B、铜与浓硫酸的反应为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,产生1mol气体需H2SO4 2mol;C、锌与稀硫酸的反应为:Zn+H2SO4=ZnSO4+H2↑,产生1mol气体需H2SO4 1mol;D、二氧化锰与浓盐酸的反应为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,产生1mol气体需HCl 4mol,所以参加反应的酸的物质的量最少的是A项。 考点:本题考查根据化学方程式的计算。 4.D 【解析】 试题分析:A、桂皮酸、布洛芬和阿司匹林都含有羧基,所以都能与Na2CO3溶液反应产生CO2,正确;B、桂皮酸、布洛芬和阿司匹林都含有羧基,均能与乙醇发生酯化反应,即取代反应,正确;C、只有桂皮酸含有碳碳双键,所以只有桂皮酸可与溴的四氯化碳溶液发生加成反应,正确;D、阿司匹林分子含有一个羧基,水解后可得到一个酚羟基和一个羧基,所以1 rnol阿司匹林最多能与3 mol NaOH反应,错误。 考点:本题考查有机化合物的结构与性质。 5.C 【解析】 试题分析:A、PbSO4的氧化性比PbO2的弱、还原性比Pb的弱,错误;B、放电时,PbO2为氧化剂、做正极,Pb为还原剂、做负极,错误;C、根据化合价变化得H2SO4与电子转移关系:H2SO4 ~ e‾,则放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出,正确;D、充电时,PbSO4中+2价Pb得电子转化为Pb, Pb为阴极产物,错误。 考点:本题考查原电池和电解池原理。 6.C 【解析】 试题分析:A、少量的锌直接与H2SO4发生置换反应生成H2,产生少量气泡,错误;B、CO2与CaCl2饱和溶液不反应,错误;C、加热NH4Cl分解生成HCl和NH3,在试管口NH3和HCl反应生成NH4Cl,所以试管口处有晶体出现,正确;D、向蛋白质溶液中滴加足量饱和NaCl溶液,发生盐析,有蛋白质析出,错误。 考点:本题考查物质的性质和实验现象的判断。 7.B 【解析】 试题分析:A、A点H+浓度最大,对水的电离程度抑制作用最强,C点pH=7,对水的电离程度无抑制作用,所以A、B、C三点所表示的溶液中水的电离程度依次增大,正确;B、温度不变,HA的电离常数不变,错误;C、根据图像,加入1 mol NaOH后,溶液的pH=7,则c(H+)=c(OH‾),根据电荷守恒可得c(H+)+c(Na+)=c(OH‾)+c(A-),所以c(Na+)=c(A-),正确;D、未加HCl和NaOH时,溶质为HA和NaA,有图像可知pH<7,溶液显酸性,HA的电离程度大于NaA的水解程度,所以c(A-)>c(Na+)>c(HA),正确。 考点:本题考查弱电解质的电离、盐类的水解、离子浓度比较。 8.(1)(5分)难以控制反应只生成CO(g)(2分,体现反应难以控制即可) 2CH4(g)+3O2(g)=2CO(g)+4H2O(g) ∆H=—1214.0kJ•mol‾1(3分) (2)(4分)①0.025(2分)② > (2分) (3)(7分)① c(K+)>C(SCN‾)>c(OH‾)>c(H+)(2分,不单独计分) ②Na2CO3 + HClO = NaHCO3 +NaClO(3分) ③ac(2分) 【解析】 试题分析:(1)CH4燃烧容易生成CO2,难以控制反应只生成CO(g);首先写出CH4与O2反应生成CO和H2O的化学方程式,并注明状态,然后根据盖斯定律求出焓变:∆H=—∆H1+2∆H2=—1214.0kJ•mol‾1,进而可写出热化学方程式。 (2)①反应达到平衡状态B时,N2的转化率为20%,根据三段式进行计算 N2(g)+3H2(g)2NH3(g) 起始物质的量(mol) 10 26 0 转化物质的量(mol) 2 6 4 平衡物质的量(mol) 8 20 4 则平衡常数为:K=(0.4mol•L‾1)2÷[0.8mol/L×(2mol•L‾1)3]=0.025 L2·mol-1。 ②B点N2转化率大于C点,说明B点平衡常数大于C点平衡常数,A点与B点温度相同,则平衡常数相同,所以K(A) > K(C) (3)①KSCN为弱酸强碱盐,SCN‾水解使溶液呈碱性,所以离子浓度由大到小的顺序为:c(K+)>C(SCN‾)>c(OH‾)>c(H+) ②因为K1(H2CO3)>K(HClO)>K2(H2CO3),所以HClO与Na2CO3反应生成NaClO和NaHCO3,化学方程式为:Na2CO3 + HClO = NaHCO3 +NaClO ③a、用pH计可以测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,说明NaClO水解显碱性,可证明HClO为弱酸,正确;b、因为HClO具有漂白性,无法用pH试纸测量0.01 mol·L-1HClO溶液的pH,错误;c、因为HClO和盐酸浓度相同,所以若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸,正确。 考点:本题考查热化学方程式的书写、平衡常数的判断和计算、弱电解质的电离、盐类的水解、离子浓度比较、实验方案的分析。 9.(17分) (1)(5分)①c(2分)②2Fe2++Cl2=2Fe3++2Cl‾(3分) (2)(5分)Fe—6e‾+8OH‾=FeO42‾+4H2O(3分)33.6(2分) (3)(7分)①能(1分)CdS比FeS更难溶,可发生沉淀转化Cd2+(aq)+FeS(s)=CdS(s)+Fe2+(aq)(3分) ②CO2(3分) 【解析】 试题分析:(1)①吸收剂X的作用是吸收未反应的Cl2,生成FeCl3,所以X为FeCl2,检验FeCl3溶液中含有FeCl2的试剂是酸性KMnO4溶液,故c项正确。 ②Fe作阳极失去电子生成FeO42‾,用KOH溶液做电解质溶液,OH‾参加反应,所以阳极电极方程式为:Fe—6e‾+8OH‾=FeO42‾+4H2O;阴极和阳极得失电子总数相等,所以对应关系为:Fe ~ 6e‾ ~ 3H2 ,则n(H2)=3n(Fe)=3×28g÷56g/mol=1.5mol,标准状况下的体积为33.6L。 (3)①因为Ksp(CdS)小于Ksp(FeS),所以CdS比FeS更难溶,可发生沉淀转化Cd2+(aq)+FeS(s)=CdS(s)+Fe2+(aq),因此能用硫化亚铁处理含Cd2+的工业废水。 ②根据元素守恒,可知A为CO2。 考点:本题考查化学工艺流程的分析、电解原理及计算、离子方程式的书写、沉淀溶解平衡。 10.(12分) (1)(2分)烧碱、氯气(氢气) (2)(2分)d (3)(8分)①(稀)硫酸(1分);硫酸能与碳酸钙反应,搅拌过程中产生的CO2不断逸出,碳酸钙转化为硫酸钙(1分) ②BaSO4、CaSO4等不溶于酸的物质(2分,答出BaSO4即可) ③NaCl(2分) ④防止失去结晶水(2分) 【解析】 试题分析:(1)电解食盐水生成NaOH、H2、Cl2,所以氯碱工业是利用电解食盐水生产烧碱、氯气(氢气)为基础的工业体系。 (2)Na2CO3的作用除了除去Ca2+外,还有除去过量的BaCl2的作用,所以Na2CO3的顺序在BaCl2的后面,只有d项符合。 (3)①因为最终产品为MgSO4·7H2O,为避免生成杂质,应加入稀硫酸;加入硫酸后,H2SO4和CaCO3发生反应:H2SO4+CaCO3=CaSO4+CO2↑+H2O,搅拌过程中产生的CO2不断逸出,碳酸钙转化为硫酸钙。 ②盐泥含有BaSO4,加入H2SO4后CaCO3转化为CaSO4,所以过滤所得滤渣的主要成分为BaSO4、CaSO4等不溶于酸的物质。 ③蒸发结晶时温度较高,MgSO4溶解度大,所以析出NaCl,过滤所得滤渣的主要成分为NaCl。 ④在空气中干燥即烘干MgSO4·7H2O,MgSO4·7H2O容易失去结晶水,所以真空干燥MgSO4·7H2O晶体的原因是防止失去结晶水。 考点:本题考查氯碱工业、物质的提纯、化学工艺流程的分析。 11.(1)(4分)醛基(2分)CH3CH2CH2——CH2OH(2分) (2)(2分) (3)(4分)加成(还原)反应(2分) c(2分) (4)(2分)CH3CH2CH2——CH2Cl+H2O CH3CH2CH2——CH2OH+HCl CH3CH2CH2——CH2Cl+NaOH CH3CH2CH2——CH2OH+NaCl 【解析】 试题分析:(1)根据甲分子的结构简式可知甲分子中含氧官能团的名称是醛基;甲催化加氢生成乙,也可能发生醛基的加成反应,生成CH3CH2CH2——CH2OH。 (2)戊的一种属于芳香烃的同分异构体的核磁共振氢谱有两组峰,且峰面积比为3:1,说明H原子的位置有2中,且个数比为3:1,所以该物质的结构简式为:。 (3)由丁丙为醛基转化为羟基,所以反应类型为:加成(还原)反应;检验是否含有丁,用银氨溶液检验是否含有醛基即可,故c项正确。 (4)物质乙还可由C10H19Cl与NaOH水溶液共热生成,发生卤代烃的水解反应,化学方程式为: CH3CH2CH2——CH2Cl+H2O CH3CH2CH2——CH2OH+HCl 或CH3CH2CH2——CH2Cl+NaOH CH3CH2CH2——CH2OH+NaCl 考点:本题考查有机合成的分析与推断、同分异构体的判断、反应类型及化学方程式的书写。 12.(1)(4分)胶头滴管(2分) 500mL容量瓶(2分) (2)(4分)①cd(2分)②c(2分) (3)(12分)①2CuS+O2=Cu2S+SO2(2分)②Cu2S转化为CuSO4(2分) c(2分) ③a.检验装置的气密性(2分) b.氯化钡(BaCl2)(2分) c.96%(2分) 【解析】 试题分析:(1)由浓盐酸配制稀盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还需要:胶头滴管、500mL容量瓶。 (2)①由CuCl2溶液制取CuCl2•2H2O,需要进行蒸发浓缩、降温结晶,然后过滤可得CuCl2•2H2O晶体,所以不需要c、d操作。 ②FeCl3溶液为黄色,CuCl2溶液为蓝色,对原平衡体系溶液的颜色产生干扰,而加入蒸馏水可使平衡向逆反应方向移动,溶液的颜色发生改变,可证明滤液A(绿色)中存在上述平衡,故c项正确。 (3)①根据流程图CuS与O2反应生成Cu2S,还应生成SO2,化学方程式为:2CuS+O2=Cu2S+SO2 ②第②步转化,由Cu2S转化为CuO•CuSO4,所以300~400oC范围内,固体质量明显增加的原因是Cu2S转化为CuSO4;第二阶段生成了CuSO4,第四阶段固体质量减小,CuSO4发生了分解反应,所以CuSO4固体能稳定存在的阶段是第三阶段。 ③a.实验装置组装完后应首先检验装置的气密性;b. SO2与BaCl2不反应,SO2、O2与BaCl2溶液反应可以生成BaSO4沉淀,所以装置D中原来盛有的溶液为BaCl2溶液;c. 矿样充分反应后,石英玻璃管内所得固体CuO,根据Cu元素质量守恒,可知CuS ~ CuO ,所以CuS的质量为8g÷80g/mol×96g/mol=9.6g,则原矿样中CuS的质量分数为:9.6g÷10.0g×100%=96% 考点:本题考查基本仪器、基本操作、化学平衡、化学方程式的书写、化学计算。 查看更多