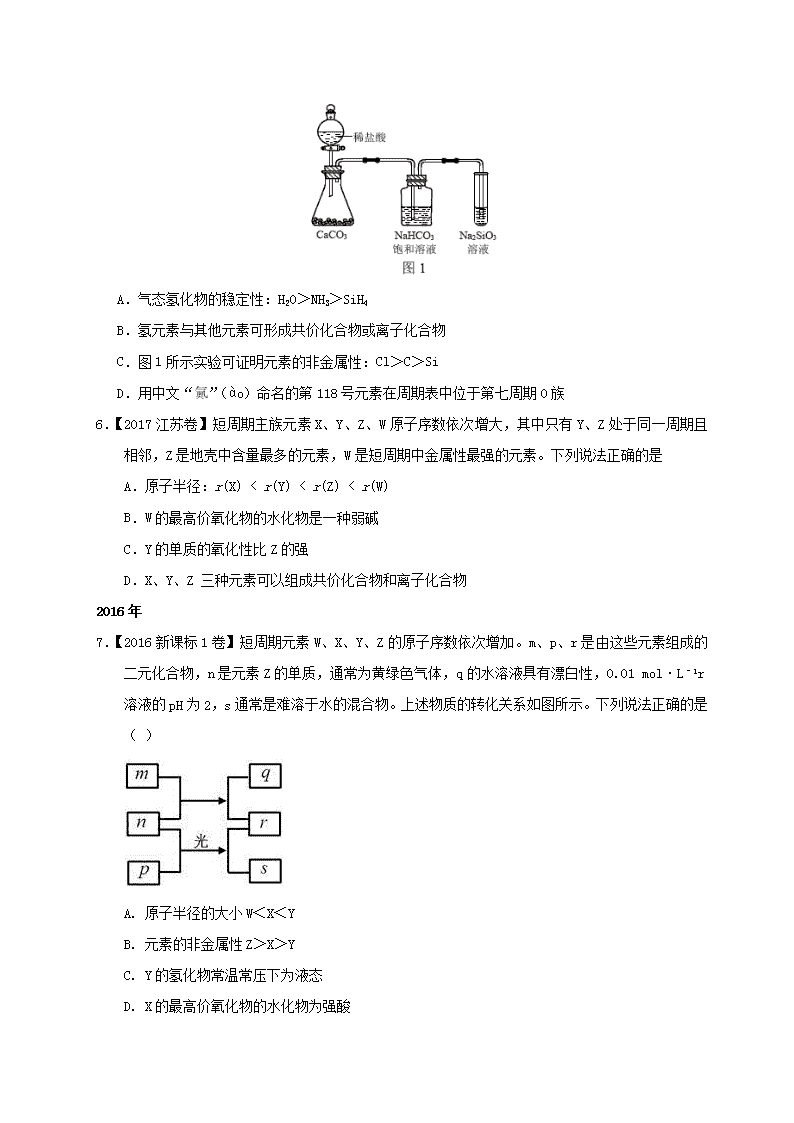
物质结构元素周期律高考选择真题
元素周期律
2018 年
(全国 1 )12.主族元素 W、X、Y、Z 的原子序数依次增加,且均不大于 20。W、X、Z 最外层电子
数之和为 10;W 与 Y 同族;W 与 Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列
说法正确的是 ( )
A.常温常压下 X 的单质为气态
B. z 的氢化物为离子化合物
C.Y 和 Z 形成的化合物的水溶液呈碱性
D.W 与 Y 具有相同的最高化合价
(全国Ⅱ)10.W、X、Y 和 Z 为原子序数依次增大的四种短周期元素。W 与 X 可生成一种红棕
色有刺激性气味的气体;Y 的周期数是族序数的 3 倍;Z 原子最外层的电子数与 W 的电子总数相
同。下列叙述正确的是
A.X 与其他三种元素均可形成两种或两种以上的二元化合物
B.Y 与其他三种元素分别形成的化合物中只含有离子健
C 四种元素的简单离子具有相同的电子层结构
D.W 的氧化物对应的水化物均为强酸
(全国Ⅲ)13.W、X、Y、Z 均为短周期元素且原子序数依次增大,元素 X 和 Z 同族。盐 YZW 与
浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含 YZW 的溶液。下列说法
正确的是( )
A.原子半径大小为 W<X<Y<Z
B.X 的氢化物水溶液酸性强于 Z 的
C.Y2W2 与 ZW2 均含有非极性共价键
D.标准状况下 W 的单质状态与 X 的相同
(天津)2.下列有关物质性质的比较,结论正确的是
A.溶解度:Na2CO2< NAHCO3
B.热稳定性:HCI<PH3
C.沸点:C2H5SH<C2HOH
D.碱性:LiOH<Be(OH)2
(江苏)8.短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原
子的最外层只有一个电子,Z 位于元素周期表ⅢA 族,W 与 X 属于同一主族。下列说法正确的是
( )
A.原子半径:r(W)>r(Z)>r(Y)
B.由 X、Y 组成的化合物中均不含共价键
C.Y 的最高价氧化物的水化物的碱性比 Z 的弱
D.X 的简单气态氢化物的热稳定性比 W 的强
2017 年
1.【2017 新课标 1 卷】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 的简单氢化物可用作制
冷剂,Y 的原子半径是所有短周期主族元素中最大的。由 X、Y 和 Z 三种元素形成的一种盐溶于
水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A.X 的简单氢化物的热稳定性比 W 强
B.Y 的简单离子与 X 的具有相同的电子层结构
C.Y 与 Z 形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z 与 X 属于同一主族,与 Y 属于同一周期
2.【2017 新课标 2 卷】a、b、c、d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数与 b
原子次外层的电子数相同;c 所在周期数与族数相同;d 与 a 同族。下列叙述正确的是
A.原子半径:d>c>b>a B.4 种元素中 b 的金属性最强
C.c 的氧化物的水化物是强碱 D.d 单质的氧化性比 a 单质的氧化性强
3.【2017 新课标 3 卷】短周期元素 W、X、Y 和 Z 在周期表中的相对位置如表所示,这四种元素原子
的最外层电子数之和为 21。下列关系正确的是
W X
Y Z
A.氢化物沸点:W
W
C.化合物熔点:Y2X3Z
10.【2016 浙江卷】短周期主族元素 X、Y、Z、W 的原子序数依次增大,X 原子核外最外层电子数是其
电子层数的 2 倍,X、Y 的核电荷数之比为 3:4。W−的最外层为 8 电子结构。金属单质 Z 在空气中
燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. X 与 Y 能形成多种化合物,一般条件下都能与 Z 的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
C. 化合物 Z2Y 和 ZWY3 都只存在离子键
D. Y、W 的某些单质或两元素之间形成的某些化合物可作水的消毒剂
11.【2016 海南卷】下列叙述正确的有
A. 第四周期元素中,锰原子价电子层中未成对电子数最多
B. 第二周期主族元素的原子半径随核电荷数增大依次减小
C. 卤素氢化物中,HCl 的沸点最低的原因是其分子间的范德华力最小
12.【2016 江苏卷】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 原子的最外层有 6 个电子,Y
是迄今发现的非金属性最强的元素,在周期表中 Z 位于ⅠA 族,W 与 X 属于同一主族。下列说法
正确的是
A. 元素 X、W 的简单阴离子具有相同的电子层结构
B. 由 Y、Z 两种元素组成的化合物是离子化合物
C. W 的简单气态氢化物的热稳定性比 Y 的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
13.【2016 上海卷】硼的最高价含氧酸的化学式不可能是
A. HBO2 B. H2BO3 C. H3BO3 D. H2B4O7
14.【2016 上海卷】下列各组物质的熔点均与所含化学键的键能有关的是
A.CaO 与 CO2 B.NaCl 与 HCl C.SiC 与 SiO2 D.Cl2 与 I2
15.【2016 上海卷】已知 W、X、Y、Z 为短周期元素,原子序数依次增大。W、Z 同主族,X、Y、Z 同
周期,其中只有 X 为金属元素。下列说法一定正确的是
A. 原子半径:X>Y>Z>W
B. W 的含氧酸的酸性比 Z 的含氧酸的酸性强
C. W 的气态氢化物的稳定性小于 Y 的气态氢化物的稳定性
D. 若 W 与 X 原子序数差为 5,则形成化合物的化学式为 X3W2
2015 年
16.【2015 福建卷】短周期元素 X、Y、Z、W 在元素周期表中的相对位置如下图所示,其中 W 原子的
质子数是其最外层电子数的三倍,下列说法不正确的是
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素 X、Z、W 的最高化合价分别与其主族序数相等
18.【2015 新课标 2 卷】原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1、6、
7、1。a-的电子层结构与氦相同,b 和 c 的次外层有 8 个电子,c-和 d+的电子层结构相同。下列叙述
错误的是
A. 元素的非金属性次序为 c>b>a
B. a 和其他 3 种元素均能形成共价化合物
C. d 和其他 3 种元素均能形成离子化合物
D. 元素 a 、b、c 各自最高和最低化合价的代数和分别为 0、4、6
19.【2015 浙江卷】右下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,W 元素的核电荷
数为 X 元素的 2 倍。下列说法正确的是( )
A.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递
增
C.YX2 晶体熔化、液态 WX3 气化均需克服分子间作用力
D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原性
20.【2015 重庆卷】下列说法正确的是
A.I 的原子半径大于 Br,HI 比 HBr 的热稳定性强
B.P 的非金属性强于 Si,H3PO4 比 H2SiO3 的酸性强
C.Al2O3 和 MgO 均可与 NaOH 溶液反应
D.SO2 和 SO3 混合气体通入 Ba(NO3)2 溶液可得到 BaSO3 和 BaSO4
21.【2015 上海卷】中国科学技术名词审定委员会已确定第 116 号元素 Lv 的名称为鉝。关于
的叙述错误的是
A. 原子序数 116 B. 中子数 177
C. 核外电子数 116 D. 相对原子质量 293
22.【2015 上海卷】某晶体中含有极性键,关于该晶体的说法错误的是
A.不可能有很高的熔沸点 B.不可能是单质
C.可能是有机物 D.可能是离子晶体
23.【2015 上海卷】不能作为判断硫、氯两种元素非金属性强弱的依据是
A. 单质氧化性的强弱
B. 单质沸点的高低
C. 单质与氢气化合的难易
D. 最高价氧化物对应的水化物酸性的强弱
24.【2015 上海卷】将 Na、Na2O、NaOH、Na2S、Na2SO4 分别加热熔化,需要克服相同类型作用力的物
质有
A.2 种 B.3 种 C.4 种 D.5 种
25.【2015 上海卷】一般情况下,前者无法决定后者的是
第 19 题表
X
Y Z W
T
A.原子核外电子排布——元素在周期表中的位置
B.弱电解质的相对强弱——电离常数的大小
C.分子间作用力的大小——分子稳定性的高低
D.物质内部储存的能量——化学反应的热效应
26.【2015 上海卷】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未
成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是
A. 元素丙的单质可用于冶炼金属
B. 甲与丁形成的分子中由非极性分子
C. 简单离子半径:丁 > 乙 > 丙
D. 甲与乙形成的化合物均有氧化性
27.【2015 山东卷】短周期元素 X、Y、Z、W 在元素周期表中的相对位置如图所示。已知 YW 的原子充
数之和是 Z 的 3 倍,下列说法正确的是
Y Z
X W
A.原子半径:XZ
C.Z、W 均可与 Mg 形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
28.【2015 江苏卷】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 原子最外层有 6 个电子,Y 是
至今发现的非金属性最强的元素,Z 在周期表中处于周期序数等于族序数的位置,W 的单质广泛
用作半导体材料。下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
29.【2015 江苏卷】在 CO2 中,Mg 燃烧生成 MgO 和 C。下列说法正确的是( )
A.元素 C 的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO 中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg 的还原性强于 C 的还原性
D.该反应中化学能全部转化为热能
30.【2015 海南卷】下列离子中半径最大的是( )
A.Na+ B.Mg2+ C.O2- D. F-
31.【2015 海南卷】a、b、c、d 为短周期元素,a 的 M 电子层有 1 个电子,b 的最外层电子数为内层
电子数的 2 倍,c 的最高化合价为最低化合价绝对值的 3 倍,c 与 d 同周期,d 的原子半径小于
c。下列叙述错误的是( )
A.d 元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有 a 与其他元素生成的化合物都是离子化合物
D.b、c、d 与氢形成的化合物中化学键均为极性共价键
2014 年
(江苏)9.短周期主族元素 X、Y、Z、W 的原子序数依次增大。X 原子的最外层电子数是其内层电子
数的 2 倍,Y 是地壳中含量最高的元素,Z2+与 Y2-具有相同的电子层结构,W 与 X 同主族。下列
说法正确的是
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y 分别与 Z、W 形成的化合物中化学键类型相同
C.X 的最高价氧化物对应水化物的酸性比 W 的弱
D.Y 的气态简单氢化物的热稳定性比 W 的强
(全国新课标 1)10.W、X、Y、Z 均是短周期元素,X、Y 处于同一周期,X、Z 的最低价离子分别为 X2-
和 Z- ,Y+和 Z-离子具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
(山东)8.根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D. 与 得电子能力相同
(上海)1.“玉兔”号月球车用 Pu 作为热源材料。下列关于 Pu 的说法正确的是
A. Pu 与 U 互为同位素 B. Pu 与 Pu 互为同素异形体
238
94
238
94
238
94
238
92
238
94
239
94
C. Pu 与 U 具有完全相同的化学性质 D. Pu 与 Pu 具有相同的最外层电子数
(上海)4.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.用范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
(上海)6.今年是门捷列夫诞辰 180 周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
(上海)7.下列各组中两种微粒所含电子数不相等的是
A.H3O+和 OH- B.CO 和 N2 C.HNO2 和 NO2
- D.CH3
+和 NH4
+
(上海)8.BeCl2 熔点较低,易升华,溶于醇和醚,其化学性质与 AlCl3 相似。由此可推测 BeCl2
A.熔融态不导电 B.水溶液呈中性
C.熔点比 BeBr2 高 D.不与氢氧化钠溶液反应
(浙江)9.如表所示的五种元素中,W、X、Y、Z 为短周期元素,这四种元素的原子最外层电子数之
和为 22。下列说法正确的是
A.X、Y、Z 三种元素最低价氢化物的沸点依升高
B.由 X、Y 和氢三种元素形成的化合物中只有共价键
C.物质 WY2、W3X4、WZ4 均有熔点高、硬度大的特性
D.T 元素的单质具有半导体的特性,T 与 Z 元素可形成化合物 TZ4
2013 年
1.(2013 海南卷 3)重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有 1 个电子 B.1H 与 D 互称同位素
C.H2O 与 D2O 互称同素异形体 D.1H18O 与 D216O 的相对分子质量相同
2.(2013 福建卷 9).四种短周期元素在周期表中的位置如右图,其中只有 M 为金属元素。下列说法
不正确的是( )
X Y
W Z
T
238
94
238
92
238
94
239
94
A.原子半径 ZY>W
B.W、X、Y、Z 的原子半径大小顺序可能是 W>X>Y>Z
C.Y、Z 形成的分子空间构型可能是正四面体
D.WY2 分子中δ键与π键的数目之比是 2:1
5.(2013 上海卷 3.)230Th 和 232Th 是钍的两种同位素,232Th 可以转化成 233U。下列有关 Th 的说法正
确的是
A. Th 元素的质量数是 232 B. Th 元素的相对原子质量是 231
C. 232Th 转换成 233U 是化学变化 D. 230Th 和 232Th 的化学性质相同
6.(2013 上海卷 4.)下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和 C60 的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
7.(2013 上海卷 13.)X、Y、Z、W 是短周期元素,X 元素原子的最外层未达到 8 电子稳定结构,工业
上通过分离液态空气获得其单质;Y 元素原子最外电子层上 s、p 电子数相等;Z 元素+2 价阳离子的核
外电子排布与氖原子相同;W 元素原子的 M 层有 1 个未成对的 p 电子。下列有关这些元素性质的说
法一定正确的是
A.X 元素的氢化物的水溶液显碱性
B.Z 元素的离子半径大于 W 元素的离子半径
C.Z 元素的单质在一定条件下能与 X 元素的单质反应
D.Y 元素最高价氧化物的晶体具有很高的熔点和沸点
8.(2013 山东卷)W、X、Y、Z 四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化
物可与其最高价含氧酸反应生成离子化合物,由此可知
A.X、Y、Z 中最简单氢化物稳定性最弱的是 Y
B.Z 元素氧化物对应水化物的酸性一定强于 Y
C.X 元素形成的单核阴离子还原性强于 Y
D.Z 元素单质在化学反应中只表现氧化性
9.(2013 广东卷 22.)元素 R、X、T、Z、Q 在元素周期表中的相对位置如下表所示, 其中 R 单质在
暗处与 H2 剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:ZQ
10.(2013 浙江卷 9、)短周期元素 X、Y、Z、W、Q 在元素周期表的位置如表所示,其中 X 元素的原
子内层电子数是最外层电子数的一半,则下列说法正确的是
A.钠与 W 可能形成 Na2W2 化合物
B.由 Z 与 Y 组成的物质在熔融时能导电
C.W 得电子能力比 Q 强
D.X 有多种同素异形体,而 Y 不存在同素异形体
11.(2013 天津卷 3、)下列有关元素的性质及其递变规律正确的是
A、IA 族与 VIIA 族元素间可形成共价化合物或离子化合物
B、第二周期元素从左到右,最高正价从+1 递增到+7
C、同主族元素的简单阴离子还原性越强,水解程度越大
D、同周期金属元素的化合价越高,其原子失电子能力越强
12.(2013 全国新课标卷 1)短周期元素 W、X、Y、Z 的原子序数依次增大,其简单离子都能破坏水的
电离平衡的是
A、W2- X+ B、X+ Y3+ C、Y3+ Z2- D、X+ Z2-
2012 年
(2012 福建)8、短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周
期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R > Q
W X
Y Z
B.最高价氧化物对应水化物的酸性:Q < W
C.原子半径:T > Q > R
D.含 T 的盐溶液一定显酸性
(2012 四川)8、已知 W、X、Y、Z 为短周期元素,W、Z 同主族,X、Y、Z 同周期,W 的气态氢
化物的稳定性大于 Z 的气态氢化物的稳定性,X、Y 为金属元素,X 的阳离子的氧化性小于 Y 的阳离
子的氧化性。下列说法正确的是
A.X、Y、Z、W 的原子半径依次减小
B.W 与 X 形成的化合物中只含离子键
C.W 的气态氢化物的沸点一定高于 Z 的气态氢化物的沸点
D.若 W 与 Y 的原子序数相差 5,则二者形成化合物的化学式一定为 Y2W3
(2012 大纲版)10、元素 X 形成的离子与钙离子的核外电子排布相同,且 X 的离子半径小于负二价硫
离子的半径。X 元素为
A.Al B. P C. Ar D. K
(2012 浙江)9、X、Y、Z 是原子序数依次增大的短周期元素,3 种元素的原子核外电子数之和与 Ca2+
的核外电子数相等, X、Z 分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确
的是
A. 原子半径: Z>Y>X
B. Z 与 X 形成化合物的沸点高于 Z 的同族元素与 X 形成化合物的沸点
C. CaY2 与水发生氧化还原反应时, CaY2 只作氧化剂
D. CaX2、CaY2 和 CaZ2 等 3 种化合物中,阳离子与阴离子个数比均为 1∶2
(2012 北京)9、已知 33As、35Br 位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4
(2012 全国新课标卷)13、短周期元素 W、X、Y、Z 的原子序数依次增大,其中 W 的阴离子的核
外电子数与 X、Y、Z 原子的核外内层电子数相同。X 的一种核素在考古时常用来鉴定一些文物的年
代,工业上采用液态空气分馏方法来生产 Y 的单质,而 Z 不能形成双原子分子。根据以上叙述,下
列说法中正确的是
A.上述四种元素的原子半径大小为 WrZ>rW>rX
(2012 上海)6、元素周期表中铋元素的数据见右图,下列说法正确的是
A. Bi 元素的质量数是 209
B. Bi 元素的相对原子质量是 209.0
C. Bi 原子 6p 亚层有一个未成对电子
D. Bi 原子最外层有 5 个能量相同的电子
(2012 山东)9、下列关于原子结构、元素性质的说法正确的是
A.非金属元素组成的化合物中只含共价键
B.IA 族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D. ⅦA 族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
2011 年
(2011 江苏∙5)短周期元素 X、Y、Z、W、Q 在元素周期表中的相对位置如图 1 所示。下列说法正确的是
X Y
Z W Q
图 1
A.元素 X 与元素 Z 的最高正化合价之和的数值等于 8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子 Y2-和 Z 3+的核外电子数和电子层数都不相同
D.元素 W 的最高价氧化物对应的水化物的酸性比 Q 的强
2.(2011 浙江∙9)X、Y、Z、M、W 为五种短周期元素。X、Y、Z 是原子序数依次递增的同周期元素,
且最外层电子数之和为 15,X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状况下的密度
为 0.76g/L;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2 均为直线型的共价化合物
C.由 X 元素形成的单质不一定是原子晶体
D.由 X、Y、Z、M 四种元素形成的化合物一定既有离子键,又有共价键
3.(2011 福建∙7)依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3 的酸性比 H2CO3 的强
B.Mg(OH)2 的碱性比 Be(OH)2 的强
C.HCl、HBr、HI 的热稳定性依次增强
D.若 M+和 R2-的核外电子层结构相同,则原子序数:R>M
4.(2011 广东∙22)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶
液呈碱性,乙位于第 VA 族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A。原子半径:丙>丁>乙
B。单质的还原性:丁>丙>甲
C。甲、乙、丙的氧化物均为共价化合物
D。乙、丙、丁的最高价氧化物对应的水化物能相互反应
5.(2011 山东∙13)元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
A。元素原子的最外层电子数等于元素的最高化合价
B。多电子原子中,在离核较近的区域内运动的电子能量较高
C。P、S、Cl 得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D。元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
6.(2011 天津)以下有关原子结构及元素周期律的叙述正确的是
A.第 IA 族元素铯的两种同位素 137Cs 比 133Cs 多 4 个质子
B.同周期元素(除 0 族元素外)从左到右,原子半径逐渐减小
C.第 ⅦA 元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
7.(2011 新课标全国)短周期元素 W、X、Y 和 Z 的原子序数依次增大。元素 W 是制备一种高效电池的
重要材料,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地壳中含量最丰富的金属元素,
Z 原子的最外层电子数是其电子层数的 2 倍。下列说法错误的是
A。 元素 W、X 的氯化物中,各原子均满足 8 电子的稳定结构
B。 元素 X 与氢形成的原子比为 1:1 的化合物有很多种
C。 元素 Y 的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D。 元素 Z 可与元素 X 形成共价化合物 XZ2
8.(2011 海南) 131 53I 是常规核裂变产物之一,可以通过测定大气或水中 131 53I 的含量变化来检
测核电站是否发生放射性物质泄漏。下列有关 131 53I 的叙述中错误的是
A。 131 53I 的化学性质与 127 53I 相同 B。 131 53I 的原子序数为 53
C。 131 53I 的原子核外电子数为 78 D。 131 53I 的原子核内中子数多于质子数
9.(2011 四川)下列推论正确的
A。SiH4 的沸点高于 CH4,可推测 PH3 的沸点高于 NH3
B。NH4
+为正四面体结构,可推测出 PH4+ 也为正四面体结构
C。CO2 晶体是分子晶体,可推测 SiO2 晶体也是分子晶体
D。C2H6 是碳链为直线型的非极性分子,可推测 C3H8 也是碳链为直线型的非极性分子
10.(2011 上海∙9)氯元素在自然界有35Cl 和 37Cl 两种同位素,在计算式 34.969×75.77%+36.966×24.23%
=35.453 中
A.75.77%表示 35Cl 的质量分数 B.24.23%表示 35Cl 的丰度
C.35. 453 表示氯元素的相对原子质量 D.36.966 表示 37Cl 的质量数