- 2021-05-14 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东高考化学真题
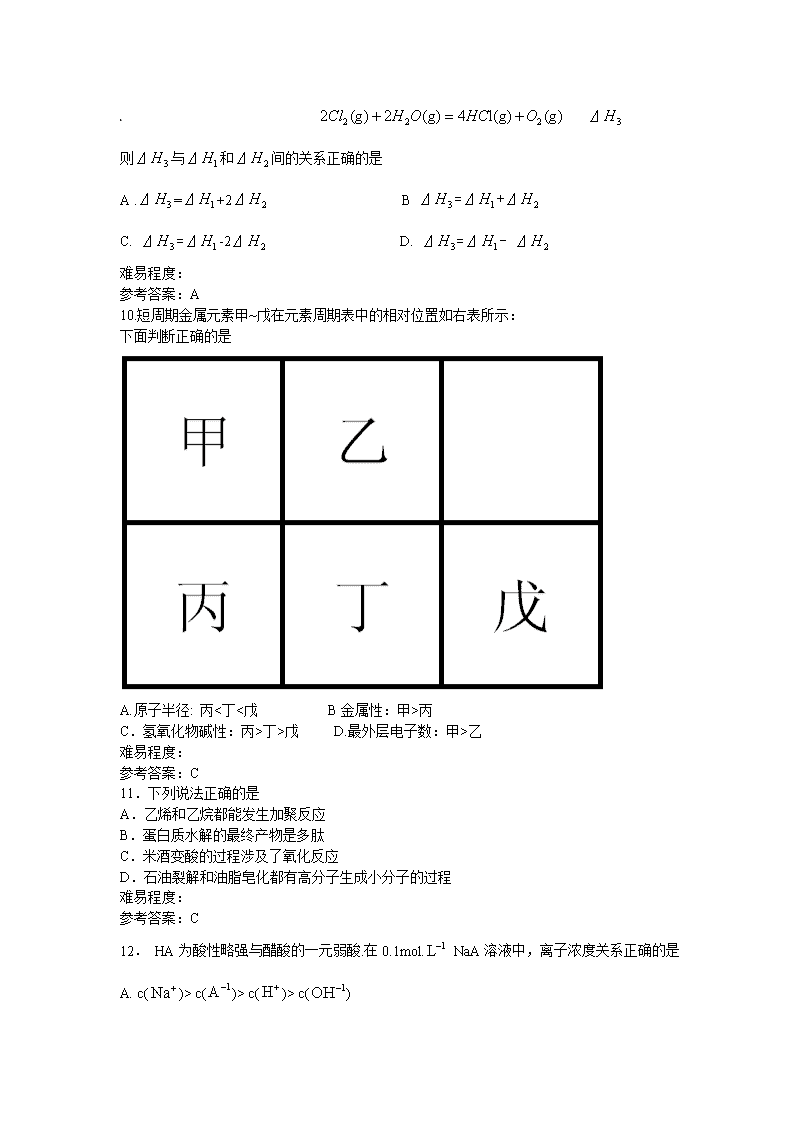
2010年普通高等学校招生全国统一考试(广东卷) 理科综合 本试卷共10页,36小题,满分300分。考试用时150分钟。 注意事项: 1. 答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填写在答题卡上。用2B铅笔将试卷类型(A)填涂在答题卡相应位置上。将条形码横贴在答题卡右上角“条形码粘贴处”。 2. 选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选择其他答案,答案不能答在试卷上。 3. 非选择题必须用黑色字钢笔或签字笔作答,答案必须卸载答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上心的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。 4. 考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。 可能用到的相对原子量:H 1 Li 7 B 11 C 12 N 14 O16 Na 23 一、单项选择题:本大题共16小题,每小题4分。共64分。在每小题给出的四个选项中,只有一个选项符合题目要求,选对的得4分,选错或不答的得0分。 7.能在溶液中大量共存的一组离子是 A . 、 、 、 B.、、、 C.、 、 、 D. 、 、 、 难易程度: 参考答案:C 8.设 为阿伏加德罗常数的数值,下列说法正确的是 A.16g 中含有4个C-H键 B.1mol.溶液含有个 C.1mol Cu和足量稀硝酸反应产生 个NO分子 D.常温常压下,22.4L中含有 个分子 难易程度: 参考答案:A 9.在298K、100kPa时,已知:2 ⊿ ⊿ ⊿ 则⊿与⊿和⊿间的关系正确的是 A .⊿=⊿+2⊿ B ⊿=⊿+⊿ C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿ 难易程度: 参考答案:A 10.短周期金属元素甲~戊在元素周期表中的相对位置如右表所示: 下面判断正确的是 A.原子半径: 丙<丁<戊 B金属性:甲>丙 C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙 难易程度: 参考答案:C 11.下列说法正确的是 A.乙烯和乙烷都能发生加聚反应 B.蛋白质水解的最终产物是多肽 C.米酒变酸的过程涉及了氧化反应 D.石油裂解和油脂皂化都有高分子生成小分子的过程 难易程度: 参考答案:C 12. HA为酸性略强与醋酸的一元弱酸.在0.1mol. NaA溶液中,离子浓度关系正确的是 A. c()> c()> c()> c() B. c()>c() > c()> c() C. c()+ c()= c( )+ c() D. c()+ c()= c()+ c() 难易程度: 参考答案:D 22. 对实验Ⅰ~Ⅳ的实验现象预测正确的是 A 实验Ⅰ:液体分层,下层呈无色 B 实验Ⅱ:烧杯中先出现白色沉淀,后溶解 C.实验Ⅲ:试管中溶液颜色变为红色 D 实验Ⅳ:放置一段时间后,饱和CUSO4溶液中出现蓝色晶体 难易程度: 参考答案:CD 23. 铜锌原电池(如图9)工作时,下列叙述正确的是 A 正极反应为:Zn—2e-=Zn2+ B。电池反应为:Zn+Cu2+=Zn2+ +CU C 在外电路中,电子从负极流向正极 D 盐桥中的K+移向ZnSO4溶液 难易程度: 参考答案:BC 30.(16分) 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略). (1)化合物Ⅰ的分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 . (2)由通过消去反应制备Ⅰ的化学方程式为________(注明反应条件).。 (3)Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为________. (4)在一定条件下,化合物V能与CO2发生类似反应②的反应,生成两种化合物(互为同分异构体),请写出其中任意一种化合物的结构简式:________. (5)与CO2类似,CO也能被固定和利用.在一定条件下,CO、和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母). A.都属于芳香烃衍生物 B.都能使溴的四氯化碳溶液褪色 C.都能与Na反应放出H2 D. 1 molⅥ或Ⅶ最多能与4 mol H2发生加成反应 难易程度: 参考答案: (1)C8H8 10 (2) (3) (4) (5)AB 31.(16分) 硼酸(H3BO3)在食品、医药领域应用广泛. (1) 请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________. (2) 在其他条件相同时,反应H3BO3 +3CH3OHB(OCH3)3 +3H2O中,H3BO 3的转化率()在不同温度下随反应时间(t)的变化见图12,由此图可得出:[来源:学科网] ① 温度对应该反应的反应速率和平衡移动的影响是_______. ② 该反应的_____0(填“<”、“=”或“>”). (3) H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l)[B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字). 难易程度: 参考答案: (1) B2H6 + 6H2O=2H3BO3 +6H2 (2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O (3) 或1.43 32(16分) 碳酸锂广泛应用于陶瓷和医药等领域。已-锂辉石(主要成分为Li2OAl2O34SiO2)为原材料制备Li2CO3的工艺流程如下: 已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的p H分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g. (1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是_____________. (2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钠”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。 (3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________. (4)步骤Ⅲ中,生成沉淀的离子方程式为________________. (5)从母液中可回收的主要物质是_____________. 难易程度: 参考答案: (1)加快反应速率 (2)石灰石 (3)Fe2+ Mg2+ Ca2+ (4)2Li++CO32-=Li2CO3 (5)NaOH 33.(16分) 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。 (1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________. (2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________. (3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl、OH和SO.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响). ① 提出合理假设 . 假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO;假设3:_____________. ② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moLL-1H2SO4、1moLL-1NaOH、0.01molL-1KMnO4、淀粉-KI溶液、紫色石蕊试液. 实验步骤 预期现象和结论 步骤1:取少量吸收液于试管中,滴加3 moLL-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. 步骤2: 步骤3: 难易程度: 参考答案: 答案: (1) Na2SO3+H2O (2) Na2SO3 (3) ①SO32-、ClO-都存在 ② 实验步骤 预期现象和结论 步骤1:取少量吸收液于试管中,滴加3 moLL-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 步骤2:在A试管中滴加紫色石蕊试液 若先变红后退色,证明有ClO-,否则无 步骤3:在B试管中滴加0.01molL-1KMnO4溶液 若紫红色退去,证明有SO32-,否则无 2010广东理综化学试题解析 一、单项选择题:本大题共16小题,每小题4分。共64分。在每小题给出的四个选项中, 只有一个选项符合题目要求,选对的得4分,选错或不答的得0分。 7.能在溶液中大量共存的一组离子是 A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3- C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32- 解析:A中Ag+和PO43-、Cl-因生成沉淀不共存;B中H+和HCO3-离子生成气体不共存,Fe3+和I-因发生氧化还原反应不共存;D中Al3+和CO32-因互促水解不共存。 答案:C 10.短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是 A.原子半径: 丙<丁<戊 B.金属性:甲>丙 C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙 解析:同周期元素原子半径是减小的,故A错;同主族元素金属性自上而下是增强的,故B错;同周期的元素的金属性越来越弱,故对应碱的碱性也是减弱的,C正确;同周期的最外层电子数越来越多,故D错。 答案:C 11.下列说法正确的是 A.乙烯和乙烷都能发生加聚反应[来源:学科网] B.蛋白质水解的最终产物是多肽 C.米酒变酸的过程涉及了氧化反应 D.石油裂解和油脂皂化都有高分子生成小分子的过程 解析:乙烷是饱和烃,不能发生加聚反应,A错;蛋白质水解的最终产物是氨基酸,故B错;酒精生成酸的过程发生了氧化反应,故C正确;油脂不是高分子化合物,故D错。 答案:C 12.HA为酸性略强与醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是[来源:Zxxk.Com] A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+) C.c(Na+)+ c(OH-)= c(A-)+ c(H+) D.c(Na+)+ c(H+) = c(A-)+ c(OH-) 解析:A明显错误,因为阳离子浓度都大于阴离子浓度,电荷不守恒;D是电荷守恒,明显正确。NaA的水解是微弱的,故c(A-)>c(OH-),B错;C的等式不符合任何一个守恒关系,是错误的; 答案:D 二. 双项选择题:本大题共9小题,每小题6分,共54分。在每小题给出的四个选项中, 有两个选项符合题目要求,全部选对得6分,只选1个且正确的得3分,有选错或不 答的得0分。 22. 对实验Ⅰ~Ⅳ的实验现象预测正确的是 三、非选择题:本大题共11小题,共182分。按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位。 30.(16分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。CO2与化合物 Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。 (1)化合物Ⅰ的分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 。 (2)由通过消去反应制备Ⅰ的化学方程式为________(注明反应条件)。 (3)Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为________。 (4)在一定条件下,化合物V能与CO2发生类似反应②的反应,生成两种化合物(互为同分 异构体),请写出其中任意一种化合物的结构简式:________。 (5)与CO2类似,CO也能被固定和利用。在一定条件下,CO、和H2三者发生反 应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下 列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母)。 A.都属于芳香烃衍生物 B.都能使溴的四氯化碳溶液褪色 C.都能与Na反应放出H2 D. 1 molⅥ或Ⅶ最多能与4 mol H2发生加成反应 解析:(1) Ⅰ的分子式为C8H8,耗氧为(8+8/4)mol=10mol。 (2)根据卤代烃在NaOH、醇溶液作用下可发生消去反应,可写出方程式为: (3)根据酯化反应原理,可知生成的酯的结构为。 (4)反应②可以理解为加成反应,O=C=O 断开一个碳氧键,有机物也断开碳氧键加成。由此可类比化合物V的两种产物为。 31.(16分)硼酸(H3BO3)在食品、医药领域应用广泛。 (1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。 (2)在其他条件相同时,反应H3BO3 +3CH3OHB(OCH3)3 +3H2O中,H3BO 3的转化率()在不同温度下随反应时间(t)的变化见图12,由此图可得出: ①温度对应该反应的反应速率和平衡移动的影响是____ ___ ②该反应的_____0(填“<”、“=”或“>”). (3)H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字) 解析:(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。 (2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。 (3) K=== 答案: (1) B2H6 + 6H2O=2H3BO3 +6H2 (2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O (3) 或1.43 32.(16分) 碳酸锂广泛应用于陶瓷和医药等领域。已-锂辉石(主要成分为Li2OAl2O34SiO2)为原材料制备Li2CO3的工艺流程如下: 已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。 (1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是_____________. (2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。 ①提出合理假设 假设1:只存在SO32- 假设2:既不存在SO32-也不存在ClO- 假设3:_____________ ②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moLL-1H2SO4、1moLL-1NaOH、0.01molL-1KMnO4、淀粉-KI溶液、紫色石蕊试液. 实验步骤 预期现象和结论 步骤1:取少量吸收液于试管中,滴加3 moLL-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 步骤2: 步骤3: 解析:(1) NaOH过量,故生成的是正盐:SO2+2NaOH =Na2SO3+H2O。 (2)S元素的价态从+4→+6,失去电子做表现还原性,故还原剂为Na2SO3。 (3)①很明显,假设3两种离子都存在。 ②加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;在A试管中滴加紫色石蕊试液,若先变红后退色,证明有ClO-,否则无;在B试管中滴加0.01molL-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。 答案: (1) Na2SO3+H2O (2) Na2SO3 (3) ①SO32-、ClO-都存在 ② 实验步骤 预期现象和结论 步骤1:取少量吸收液于试管中,滴加3 moLL-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 步骤2:在A试管中滴加紫色石蕊试液 若先变红后退色,证明有ClO-,否则无 步骤3:在B试管中滴加0.01mol 若紫红色退去,证明有SO32-,否则无 L-1KMnO4溶液查看更多