- 2021-05-14 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮增分策略 加试30题专练(三)化学平衡原理综合应用
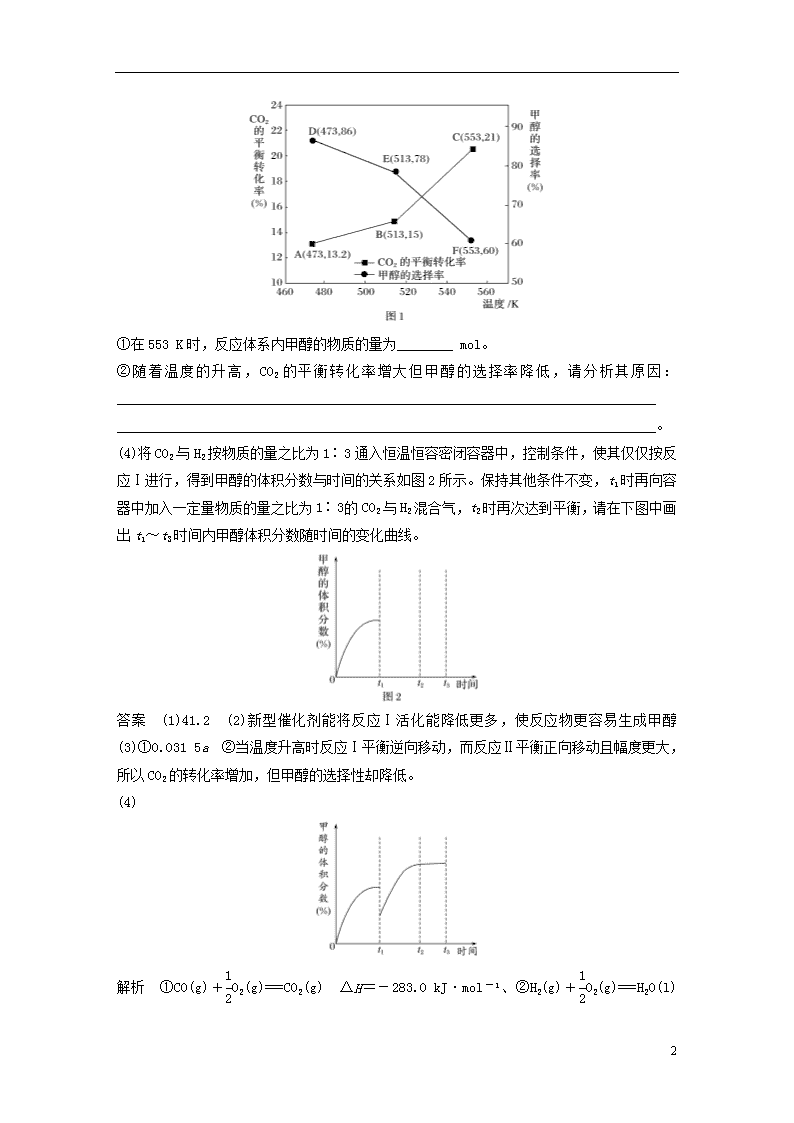
加试30题专练(三) 化学平衡原理综合应用 1.[2018·温州市高三选考适应性测试(二模)]甲醇是一种重要的有机化工原料,CO2与H2在催化剂CZZA(普通铜基催化剂)作用下合成甲醇,相关反应如下: 反应Ⅰ CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.2 kJ·mol-1 反应Ⅱ CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1 ②H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1 请回答: (1)反应Ⅱ的ΔH2=________ kJ·mol-1。 (2)研究表明:在其他条件相同的情况下,将催化剂CZZA换成新型催化剂(CZZA/rGO),可以显著提高甲醇的选择性,试用过渡态理论解释其原因:_____________________________ _______________________________________________________________________________。 (3)以CZZA/rGO为催化剂,在一定条件下,将物质的量之比为1∶3(总量为a mol)的CO2与H2通入恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图1所示: 6 ①在553 K时,反应体系内甲醇的物质的量为________ mol。 ②随着温度的升高,CO2的平衡转化率增大但甲醇的选择率降低,请分析其原因:_____________________________________________________________________________ _____________________________________________________________________________。 (4)将CO2与H2按物质的量之比为1∶3通入恒温恒容密闭容器中,控制条件,使其仅仅按反应Ⅰ进行,得到甲醇的体积分数与时间的关系如图2所示。保持其他条件不变,t1时再向容器中加入一定量物质的量之比为1∶3 的CO2与H2混合气,t2时再次达到平衡,请在下图中画出t1~t3时间内甲醇体积分数随时间的变化曲线。 答案 (1)41.2 (2)新型催化剂能将反应Ⅰ活化能降低更多,使反应物更容易生成甲醇 (3)①0.031 5a ②当温度升高时反应Ⅰ平衡逆向移动,而反应Ⅱ平衡正向移动且幅度更大,所以CO2的转化率增加,但甲醇的选择性却降低。 (4) 解析 ①CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1、②H2(g)+O2(g)===H2O(l) ΔH 6 =-285.8 kJ·mol-1,③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1,④反应ⅠCO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.2 kJ·mol-1,⑤反应Ⅱ CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 (1)由盖斯定律,②-①-③得反应Ⅱ的ΔH2=-285.8 kJ·mol-1-(-283.0 kJ·mol-1)-(-44.0 kJ·mol-1)=41.2 kJ·mol-1。(2)在其他条件相同的情况下,将催化剂CZZA换成新型催化剂(CZZA/rGO),可以显著提高甲醇的选择性,用过渡态理论解释其原因:新型催化剂能将反应Ⅰ活化能降低更多,使反应物更容易生成甲醇。 (3) CO2(g) + 3H2(g)CH3OH(g)+H2O(g) 始/mol 0.25a 0.75a 变/mol 0.25a×21%×60% 0.031 5a 平/mol 0.031 5a ①在553 K时,反应体系内甲醇的物质的量为 0.25a×21%×60%=0.031 5a;②随着温度的升高,CO2的平衡转化率增大但甲醇的选择率降低,其原因是当温度升高时反应Ⅰ平衡逆向移动,而反应Ⅱ平衡正向移动且幅度更大,所以CO2的转化率增加,但甲醇的选择性却降低。(4)保持其他条件不变,t1时再向容器中加入一定量物质的量之比为1∶3的CO2与H2混合气,t2时再次达到平衡,t1时相当于对原平衡进行加压,平衡正向移动,甲醇的体积分数增大。 2.(2017·浙江省金华十校高二第一学期期末调研)二氧化碳加氢合成乙烯的反应如下:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH。 已知:①C2H4(g)+3O2(g)===2CO2(g)+2H2O(l) ΔH1=a kJ·mol-1; ②2H2(g)+O2(g)===2H2O(l) ΔH2=b kJ·mol-1; ③H2O(l)===H2O(g) ΔH3=c kJ·mol-1; 请回答: (1)ΔH=________ kJ·mol-1。(用a、b、c表示) (2)在催化剂[Fe3(CO)12/ZSM-5]、空速1200 h-1 条件下,温度、压强、氢碳比[n(H2)/n(CO2)=x]对CO2平衡转化率及温度对催化效率影响如图1所示。 6 ①下列有关说法正确的是________(填字母)。 A.ΔH>0 B.增大氢碳比,可以提高CO2的平衡转化率 C.温度低于300 ℃时,随温度升高乙烯的产率增大 D.平衡常数:K(M)>K(N) E.为提高CO2的平衡转化率,工业生产中应在尽可能低的温度下合成乙烯 ②M点时,CO2的平衡转化率为,则此时平衡体系中乙烯的体积分数为__________。 ③工业生产中压强一般控制在2.1~2.6 MPa之间,理由是____________________________ ______________________________________________________________________________。 (3)恒温(300 ℃),在体积为1 L的恒容容器中以n(H2)/n(CO2)=3的投料比加入反应物,至t1时达到平衡。t2时将容器体积瞬间扩大至2 L并保持不变,t3时重新达平衡。在图2中绘制0~t4时间段内,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像。 答案 (1)3b+4c-a (2)①BD ②1/9(或11.1%) ③压强小于2.1 MPa,CO2的平衡转化率较小;压强大于2.6 MPa,CO2 6 的平衡转化率提高幅度较小,运行成本增加 (3)[起点12.5,t2低于20(实际为16.7),t3高于12.5] 解析 (1) 已知:①C2H4(g)+3O2(g)===2CO2(g)+2H2O(l) ΔH1=a kJ·mol-1;②2H2(g)+O2(g)===2H2O(l) ΔH2=b kJ·mol-1;③H2O(l)===H2O(g) ΔH3=c kJ·mol-1;根据盖斯定律,将②×3+③×4-①得:2CO2(g )+6H2(g)C2H4(g)+4H2O(g) ΔH=(3b+4c-a) kJ·mol-1。 (2)①根据图像,CO2平衡转化率随温度升高而降低,说明升高温度,平衡逆向移动,正反应为放热反应,ΔH<0,故A错误;根据方程式2CO2(g)+6H2(g)C2H4(g)+4H2O(g),增大氢碳比,可以提高CO2的平衡转化率,故B正确;根据A的分析,ΔH<0,温度升高,平衡逆向移动,乙烯的产率降低,故C错误;升高温度,平衡逆向移动,平衡常数减小,则平衡常数:K(M)>K(N),故D正确;根据图像,为提高CO2的平衡转化率,工业生产中应在300 ℃温度下合成乙烯,但温度太低,催化剂的活性较低,反应速率太慢,故E错误。 ②设参与反应的二氧化碳的物质的量为3n mol,则氢气为9n mol,根据反应2CO2(g)+6H2(g)C2H4(g)+4H2O(g)可知,CO2的平衡转化率为,平衡时n(CO2)=n mol,n(H2)=3n mol,n(C2H4)=n mol,n (H2O)=4n mol,平衡体系中乙烯的体积分数=物质的量分数==≈11.1%。 ③根据图像,工业生产中压强一般控制在2.1~2.6 MPa之间,是因为压强小于2.1 MPa,CO2的平衡转化率较小;压强大于2.6 MPa,CO2 的平衡转化率提高幅度较小,运行成本增加。 (3)设参与反应的二氧化碳的物质的量为3 mol,则氢气为9 mol,起始时混合气体的平均相对分子质量(M)==12.5;300 ℃时,CO2的平衡转化率为,根据反应2CO2(g)+6H2(g)C2H4(g)+4H2O(g)可知,平衡时n(CO2)=1 mol,n(H2)=3 mol,n(C2H4)=1 mol,n (H2O)=4 mol,混合气体的平均相对分子质量(M)=≈16.67;t2时将容器体积瞬间扩大至2 L并保持不变,平衡逆向移动,气体的物质的量增大,但小于12 mol,新平衡时混合气体的平均相对分子质量(M 6 )减小,但大于12.5,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像为 [起点12.5,t2低于20(实际为16.7),t3高于12.5]。 6查看更多