- 2021-05-14 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二卷
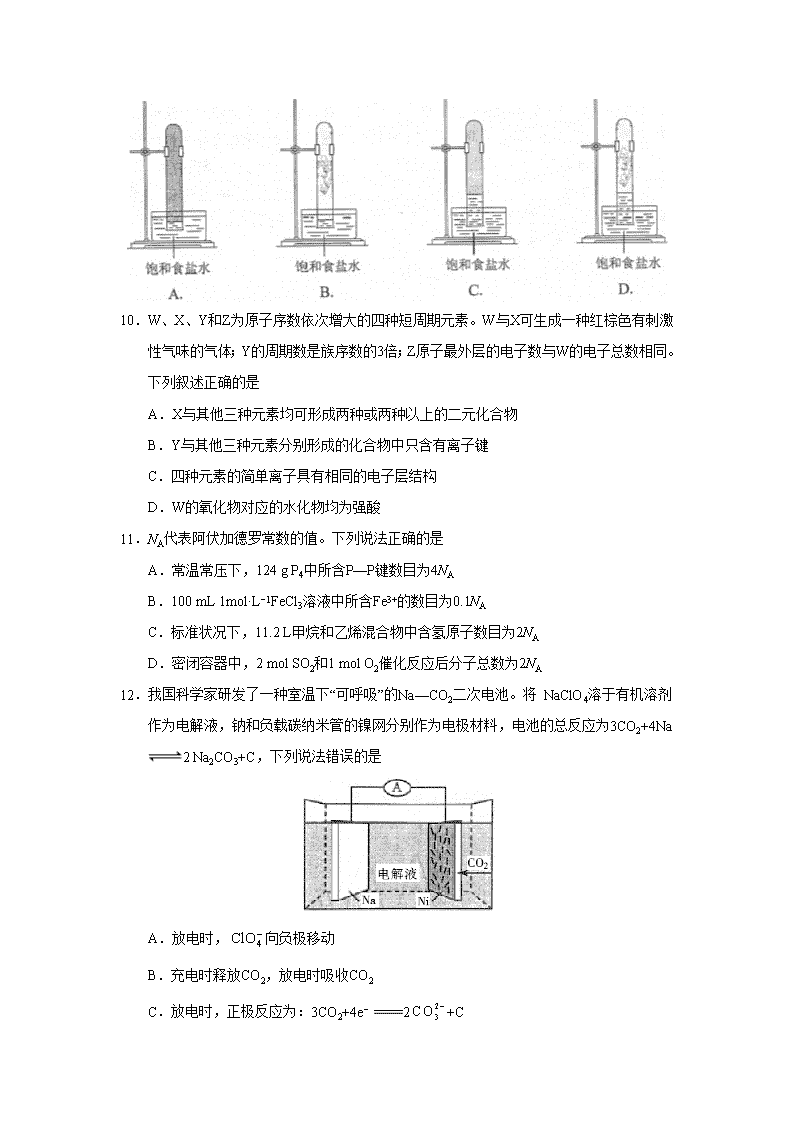
2018年普通高等学校招生全国统一考试 理科综合能力测试试题卷 7.化学与生活密切相关。下列说法错误的是 A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 8.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是 A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 9.实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。 光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是 10.W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是 A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸 11.NA代表阿伏加德罗常数的值。下列说法正确的是 A.常温常压下,124 g P4中所含P—P键数目为4NA B.100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA D.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA 12.我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将 NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2 Na2CO3+C,下列说法错误的是 A.放电时,向负极移动 B.充电时释放CO2,放电时吸收CO2 C.放电时,正极反应为:3CO2+4e− 2+C D.充电时,正极反应为:Na+ + e−Na 13.下列实验过程可以达到实验目的的是 编号 实验目的 实验过程 A 配制0.4000 mol·L−1的NaOH溶液 城区4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容 B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 C 制取并纯化氢气 向稀盐酸中加入锌粒,将生产的气体依次通过NaOH溶液、浓盐酸和KMnO4溶液 D 探究浓度对反应速率的影响 向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象 26.(14分) 我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: 相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下: 金属离子 Fe3+ Fe2+ Zn2+ Cd2+ 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 回答下列问题: (1)焙烧过程中主要反应的化学方程式为_______________________。 (2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。 (3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。 (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________; 沉积锌后的电解液可返回_______工序继续使用。学科%网 27.(14分) CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。 回答下列问题: (1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)。 已知:C(s)+2H2(g)=C(g) ΔH=-75 kJ·mol−1 C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1 C(s)+(g)=CO(g) ΔH=-111 kJ·mol−1 该催化重整反应的ΔH==______ kJ·mol−1,有利于提高CH4平衡转化率的条件是____(填标号)。 A.高温低压B.低温高压C.高温高压D.低温低压 某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。 (2)反应中催化剂话性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。 相关数据如下表: 积碳反应 CH4(g)= C(s)+2H2(g) 消碳反应 CO2(g)+ C(s)= 2CO(g) ΔH/(kJ·mol−1) 75 172 活化能/ (kJ·mol−1) 催化剂X 33 91 催化剂Y 43 72 ①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时同相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。 A.K积、K消均增加 B.v积减小,v消增加 C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)· (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。 28.(15分) K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题: (1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]2FeC2O4 +3K2C2O4 +2CO2↑;显色反应的化学方程式为______________。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。 ①通入氮气的目的是________________________________________。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。 ③为防止倒吸,停止实验时应进行的操作是_________________________________________。 ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V ml。该晶体中铁的质量分数的表达式为________________________________。 35.[化学——选修3:物质结构与性质](15分) 硫及其化合物有许多用途,相关物质的物理常数如下表所示: H2S S8 FeS2 SO2 SO3 H2SO4 熔点/℃ −85.5 115.2 >600(分解) −75.5 16.8 10.3 沸点/℃ −60.3 444.6 −10.0 45.0 337.0 回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。 (2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是_________。 (3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。 (4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。 (5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm−3;晶胞中Fe2+位于所形成的正八面体的体心,该正八面体的边长为______nm。 36.[化学——选修5:有机化学基础](15分) 以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下: 回答下列问题: (1)葡萄糖的分子式为__________。 (2)A中含有的官能团的名称为__________。 (3)由B到C的反应类型为__________。 (4)C的结构简式为__________。 (5)由D到E的反应方程式为______________。 (6)F是B的同分异构体,7.30 g的F足量饱和碳酸氢钠可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢 谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。 7.D 8.C 9.D 10.A 11.C 12.D 13.B 26.(14分) (1)ZnS+O2ZnO+SO2 (2)PbSO4 调节溶液的pH 无法除去杂质Fe2+ (3)Zn+Cd2+Zn2++Cd (4)Zn2++2e-Zn 溶浸 27.(14分) (1)247 A (2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD ②pc(CO2)、pb(CO2)、pa(CO2) 28.(15分) (1)3FeC2O4+2K3[Fe(CN)6]Fe3[Fe(CN)6]2+3K2C2O4 (2)①隔绝空气、使反应产生的气体全部进入后续装置 ②CO2 CO ③先熄灭装置A、E的酒精灯,冷却后停止通入氮气 ④取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3 (3)①粉红色出现 ②查看更多