- 2021-05-14 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习专题23氧化还原反应的基本概念讲含解析1
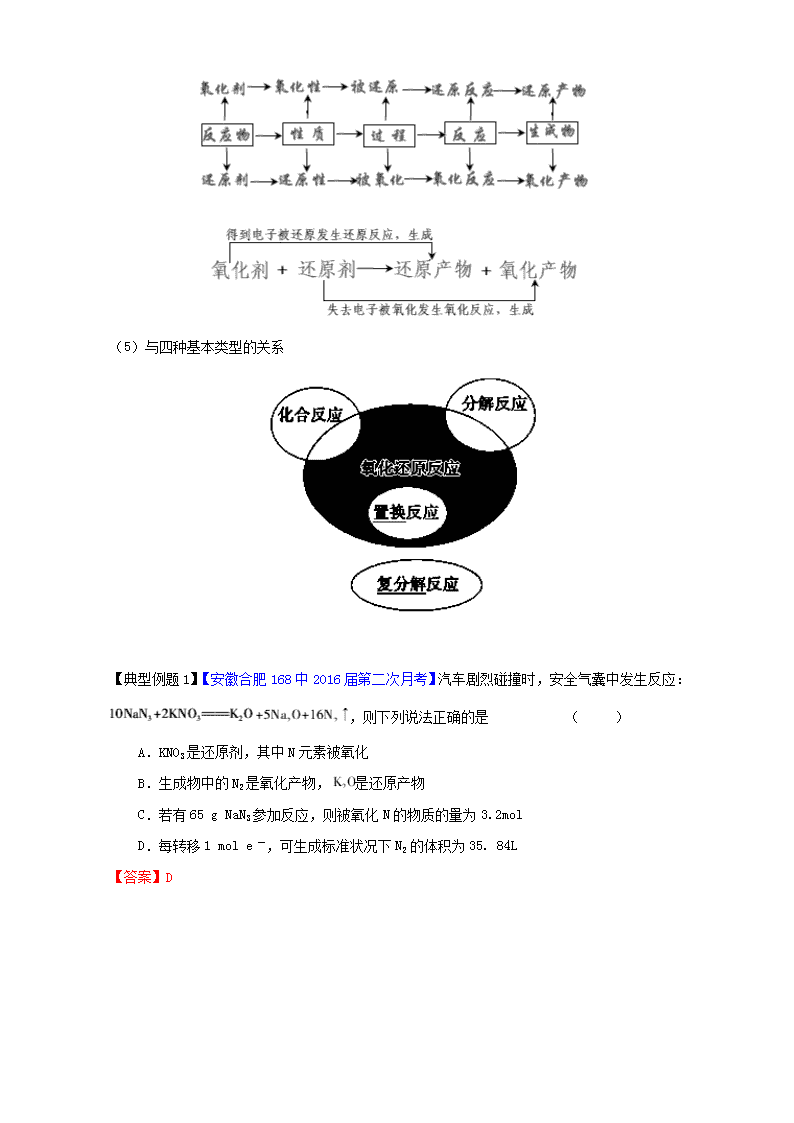
专题2.3 氧化还原反应的基本概念 1、了解氧化还原反应的基本概念,能对氧化剂、还原剂,氧化产物、还原产物,氧化性、还原性等概念作出准确地判断,了解氧化还原反应的本质是电子转移。 2、掌握氧化还原反应的表示方法,特别是电子转移的表示方法。 3、掌握几种氧化性、还原性判断的方法。 一、氧化还原反应的概念 (1)特征及判断依据:特征是反应前后元素化合价的升降;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。 (2)实质:在化学反应中有电子的转移(得失或偏移) (3)概念 概念 定义 注意点 氧化反应 物质失去电子的反应 物质失去电子的外部表现为化合价的升高 还原反应 物质得到电子的反应 物质得到电子的外部表现为化合价的降低 被氧化 元素失去电子的过程 元素失去电子的外部表现为化合价的升高 被还原 元素得到电子的过程 元素得到电子的外部表现为化合价的降低 氧化产物 通过发生氧化反应所得的生成物 氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。. 还原产物 通过发生还原反应所得的生成物 氧化剂 得到电子的反应物 常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等 还原剂 失去电子的反应物 常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4 氧化性 得到电子的能力 物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。 还原性 失去电子的能力 (4)过程 (5)与四种基本类型的关系 【典型例题1】【安徽合肥168中2016届第二次月考】汽车剧烈碰撞时,安全气囊中发生反应:,则下列说法正确的是 ( ) A.KNO3是还原剂,其中N元素被氧化 B.生成物中的N2是氧化产物,是还原产物 C.若有65 g NaN3参加反应,则被氧化N的物质的量为3.2mol D.每转移1 mol e一,可生成标准状况下N2的体积为35. 84L 【答案】D 【考点定位】本题考查氧化还原反应原理及应用。 【点评】氧化还原反应的考查包括氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等,正确标注元素化合价,分析元素反应前后化合价的变化,是解决氧化还原反应相关问题的关键,对氧化还原反应概念原理综合运用的考查, 要从氧化还原反应的实质及电子转移入手, 正确理解有关概念, 并理清知识线和对应规律,需要牢固掌握氧化还原反应知识中的重要概念和重要规律, 真正做到举一反三,灵活运用。 【迁移训练1】【江苏启动2016届第一次月考】下列说法正确的是 ( ) A.金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 B.氧化剂在反应中失去电子,还原剂在反应中得到电子 C.氧化剂具有氧化性,还原剂具有还原性 D.阳离子只有氧化性,阴离子只有还原性 【答案】C 【解析】 试题分析:A、非金属在反应中可以做氧化剂也可做还原剂,例如氢气和氧气反应,氢气做还原剂,氧气做氧化剂,错误,不选A;B、氧化剂得到电子,还原剂失去电子,错误,不选B;C、氧化剂具有氧化性,还原剂有还原性,正确,选C;D、阳离子可能有还原性,例如亚铁离子,错误,不选D。 考点:氧化还原反应 二、电子转移的数目及方向 1、有关电子转移数目的计算 关键是明确反应中元素的化合价变化,找出氧化剂或还原剂的物质的量,以及1 mol氧化剂得电子的物质的量或者1 mol还原剂失电子的物质的量。例如: 1molCl2 1molFe 2、氧化还原反应中电子转移的表示方法 (1)单线桥法 用单线箭头从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。 ne- 还原剂+氧化剂===氧化产物+还原产物 注意事项:①箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素 ②箭头方向表示电子转移的方向 ③在“桥”上标明转移的是电子总数。 (2)双线桥法 用双线箭头按被氧化和被还原的元素分别从反应物指向生成物(同种元素),并注明得失及电子数目。 注意事项:①箭头必须由反应物指向生成物,且两端对准同种元素。 ②箭头方向不代表电子转移方向,仅表示电子转移前后的变化。 ③在“桥”上标明电子的“得”与“失”,且得失电子总数应相等。 【典型例题2】工业上可用硫酸铝与硫黄焙烧制备氧化铝: 2Al2(SO4)3+3S 2Al2O3+9SO2↑,下列有关说法中正确的是 ( ) A.反应中Al2(SO4)3被氧化 B.Al2O3是氧化产物 C.该反应中,每转移0.3 mol电子生成5.04 L SO2 D.氧化产物与还原产物的质量之比为1︰2 【答案】D 的量不能确定,错误;D.在发生反应中SO2既是氧化产物,也是还原产物,在9mol的气体中有3mol的氧化产物和6mol的还原产物,所以它们的质量之比为1︰2,正确。 【点评】正确分析氧化还原反应中电子转移的数目,其前提是确定物质中各元素(特别是变价元素)的化合价。基本方法是先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。 【迁移训练2】 我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O (1)该反应的离子方程式为 。 (2)用“双线桥”表示出反应中电子转移的方向和数目: KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O (3)氧化产物与还原产物的质量之比为 。 (4)如果反应中转移0.2mol电子,则生成I2的物质的量为_________mol。 【答案】 (1)IO3-+5I -+6H+=3I2+3H2O (2) (3)5:1 (4)0.12 考点:考查氧化还原反应的应用 三、氧化性、还原性强弱的判断方法 1、根据金属活动性顺序来判断: 一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。 2、根据非金属活动性顺序来判断: 一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。 3、根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示: 规律:氧化性:氧化剂的氧化性>氧化产物的氧化性 还原性:还原剂的还原性>还原产物的还原性 4、根据氧化还原反应发生的条件来判断: 如:Mn02+4HCl(浓) MnCl2+C12↑+2H20 2KMn04+16HCl(浓)=2MnCl2+5C12↑+8H2O 后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn02 5、根据反应速率的大小来判断: 如:2Na2SO3+O2=2Na2SO4(快), 2H2SO3+O2=2H2SO4(慢),2SO2+O22SO3, 其还原性: Na2SO4>H2SO3>SO2 6、根据被氧化或被还原的程度来判断: 如:Cu+Cl2CuCl2,2Cu+SCu2S,即氧化性:Cl2>S。 7、根据原电池的正负极来判断: 在原电池中,作负极的金属的还原性一般比作正极金属的还原性强。 8、根据电解池中溶液里阴、阳离子在两极放电顺序来判断。 如:Cl-失去电子的能力强于OH-,还原性:Cl->OH-。 9、根据元素在周期表中位置判断: (1)对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。 (2)对同主族的金属而言,从上到下其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强。 (3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱。 10、根据(氧化剂、还原剂)元素的价态进行判断: 元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。 一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe, S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO3< HClO2< HClO。 【注意】①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。 ②原子的氧化性一般都强于分子的氧化性。如:氧化性F>F2、Cl>Cl2、O>O2等。 【典型例题3】根据下列方程式:①2Fe2++Cl2=2Fe3++2Cl- ;②HClO+HCl=Cl2+H2O ;③2Fe3++Cu=2Fe2++Cu2+;④Fe+Cu2+=Fe2++Cu,判断下列各组物质氧化性强弱顺序正确的是 ( ) A.Fe3+>HClO>Cl2>Fe2+>Cu2+ B.HClO>Cl2>Fe3+>Cu2+>Fe2+ C.Cl2>HClO>Fe3+>Cu2+>Fe2+ D.HClO>Fe3+>Cl2>Cu2+>Fe2+ 【答案】B 【点评】此类题型的关键还是判断氧化剂、还原剂;氧化产物、还原产物;根据氧化剂的氧化性大于氧化产物的氧化性精选判断。 【迁移训练3】【辽宁师大附中2016届10月月考】已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3 、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( ) A、2 Fe3+ +2 I— = 2 Fe2++I2 B、Cl2+FeI2=== FeCl2+I2 C、Co2O3+6 HCl===2 CoCl2+Cl2+3 H2O D、3 Cl2+6 FeI2===2 FeCl3+4 FeI3 【答案】D 【解析】 试题分析:根据氧化还原反应中氧化剂的氧化性大于氧化产物分析。A、氧化剂是铁离子,氧化产物是碘,性质强弱符合题意,能发生,不选A;B、氧化剂为氯气,氧化产物为铁离子,符合题意,能发生,不选B;C、氧化剂是三氧化二钴,氧化产物为氯气,符合题意,能发生,不选C;D、氧化剂是氯气,氧化产物为铁离子,但是铁离子能氧化碘离子,错误,选D。 考点:氧化还原反应的规律 考点一:氧化还原反应概念分析 氧化还原反应及相关概念,通过整体,关注发生过程的方法进行掌握。 在一个氧化还原反应中有: 解决此类问题的关键是对分析化合价,在化合价的分析过程中注意: ①先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。 ②个别非金属元素的化合物中元素的价态是正还是负,取决于非金属性的相对强弱。如:Si3N4中Si显+4价,N显-3价。 【典型例题4】【河北衡水2016届第二次月考】已知NH4 CuS03与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成, ②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是 ( ) A.反应中硫酸作氧化剂 B.NH4 CuS03中硫元素被氧化 C.刺激性气味的气体是氨气 D.1 mol NH4 CuS03完全反应转移0.5 mol电子 【答案】D 【解析】 【考点定位】考查氧化还原反应的有关概念和电子转移的数目的计算。 【点评】纵观近几年高考对氧化还原反应的考查,主要包括:①以生产、生活、社会中的实际问题为载体,考查氧化还原反应的基本概念;②比较物质氧化性、还原性的强弱及其规律应用;③以元素化合物为载体,考查氧化还原反应中电子转移的方向和数目。解答本题的主要思路:找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是同种反应物中同种元素出现化合价升降的氧化还原反应,必须弄清元素化合价的变化情况。 【迁移训练4】【黑龙江大庆铁人2016届第一次月考】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH-= Fe3O4+S4 O62-+2H2O。下列说法正确的是 ( ) A.O2和S2O32-是氧化剂,Fe2+是还原剂 B.每生成1 mol Fe3O4,转移电子的物质的量为2 mol C.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol D.参加反应的氧化剂与还原剂的物质的量之比为1∶1 【答案】C 【解析】 试题分析:A.根据元素的化合价的变化可知O2是氧化剂,Fe2+和S2O32-是还原剂,错误;B.每生成1 mol Fe3O4,转移电子的物质的量为4mol,错误;C.若有2 mol Fe2+被氧化,失去2mol电子,由于1molO2在反应中得到4mol电子,则被Fe2+还原的O2为0.5 mol,正确;D.参加反应的氧化剂是O2,还原剂是Fe2+和S2O32-,二者的物质的量之比为1∶4,错误。 考点:考查氧化还原反应的有关知识。 考点二:氧化还原反应中氧化性、还原性比较及应用 物质的氧化性、还原性的强弱只与得失电子的难易有关,与得失电子的多少无关。在判断时要注意与相关概念的联系。 ①元素金属性、非金属性与物质的还原性、氧化性之间既有区别又有联系,并不是元素的价态越高,其氧化能力就越强。物质的氧化性还与物质的稳定性有关,如在氯的含氧酸中,HClO的氧化性最强,稳定性最差。 ②氧化性、还原性强弱取决于元素的原子得失电子的难易,与得失电子数目无关,如Na原子只能失1个电子,Al原子可失3个电子,但还原性Na>Al。 ③不能依据氧化剂或还原剂自身化合价的变化值的大小说明氧化性或还原性的强弱。 如3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O和Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中氧化性:浓HNO3>稀HNO3。 【特别提示】 (1)根据已知反应的化学方程式比较物质的氧化性、还原性时,首先应依据化合价判断出氧化剂、氧化产物、还原剂、还原产物,然后依据规律进行判断。 (2)不能依据氧化剂或还原剂自身化合价变化值的大小判断氧化性或还原性的强弱。 (3)同一氧化剂同时与同浓度的若干种还原剂反应,往往是还原性强的先被氧化。如:向FeBr2溶液中滴入少量氯水,Fe2+先被氧化。而向FeI2溶液中滴入少量氯水,I-先被氧化。 【典型例题5】已知常温下在溶液中可发生如下两个离子反应: Ce4++Fe2+===Fe3++Ce3+ Sn2++2Fe3+===2Fe2++Sn4+ 由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是 ( ) A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+ C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+ 【答案】A 【点评】氧化性还原性强弱的比较是考试的一个难点,基本考查方式一是比较氧化性还原性的强弱,二是根据氧化性还原性强弱,判断反应能否进行。总的解题依据是一个氧化还原反应能进行,一般是氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。但要考虑到某些特殊情况如符合特定的平衡原理而进行的某些反应。 【迁移训练5】【内蒙古巴彦淖尔一中2016届9月月考】在常温下发生下列反应: ①16H++10Z-+2XO===2X2++5Z2+8H2O ②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z- 根据上述反应,判断下列结论错误的是 ( ) A.溶液中可发生:Z2+2A2+===2A3++2Z- B.Z2在①③反应中为还原剂 C.氧化性强弱的顺序为:XO>Z2>B2>A3+ D.X2+是XO的还原产物 【答案】B 考点:考查氧化还原反应的有关判断查看更多