- 2021-05-14 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
(浙江选考)2020版高考化学 考前提升训练30 化学实验综合(第31题)
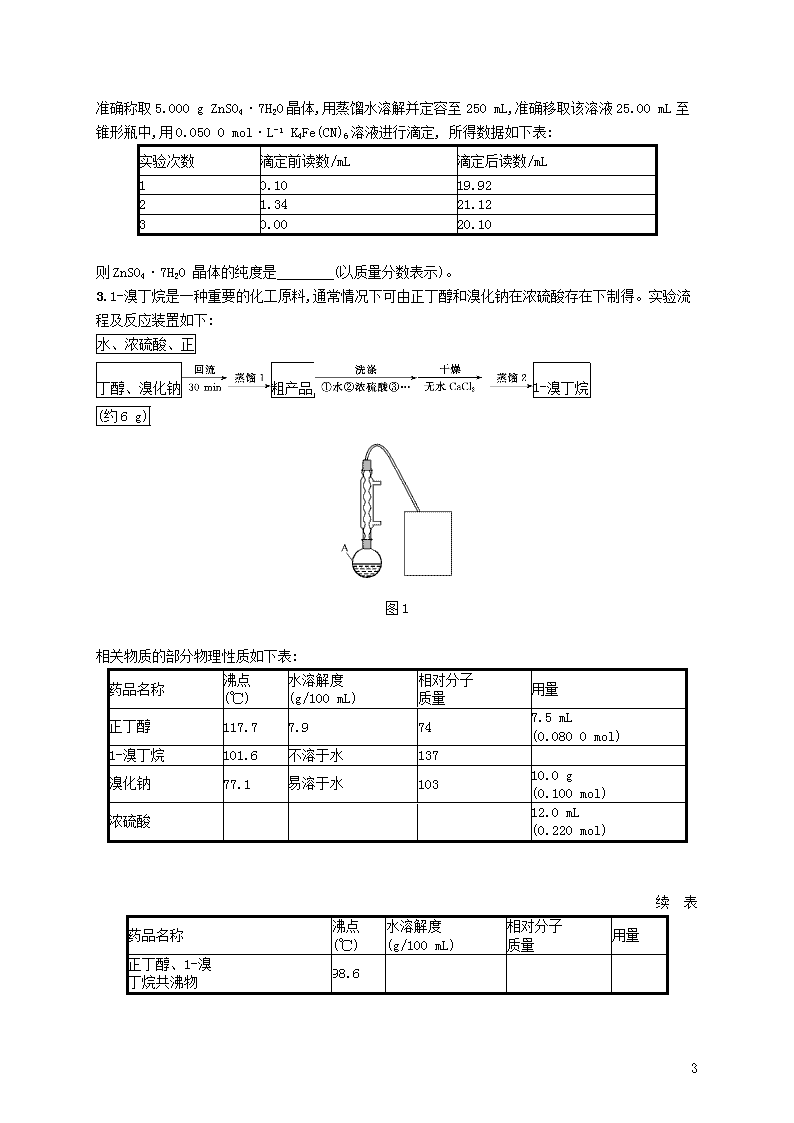
提升训练30 化学实验综合(第31题) 1.(2018·浙江名校新高考联考)二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对分子质量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下: (已知:H2C2O4CO↑+CO2↑+H2O) 请回答: (1)第①步操作要微热溶解,其原因是加快溶解速率和 。 (2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是 。 A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中 B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中 C.黑色固体连同滤纸一起加入到热的KHC2O4溶液中,待充分反应后趁热过滤 D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中 (3)50 ℃水浴加热至反应充分,写出该反应的化学方程式: 。 (4)步骤③所用的洗涤剂最合适的是 。 (5)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。 ①加入适量乙醇的优点有: a.缩短加热的时间,降低能耗;b. 。 ②在蒸发浓缩的初始阶段可通过 (填操作名称)回收乙醇。 (6)准确称取制取的晶体试样1.000 g溶于NH3·H2O中,并加水定容至250 mL,取试样溶液25.00 mL于锥形瓶中,再加入10 mL 3.000 mol·L-1的H2SO4溶液,用0.010 00 mol·L-1的KMnO4溶液滴定,消耗KMnO4标准液20.00 mL,则该产品的纯度是 。 2.(2018·绍兴模拟)锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、 氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。 已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下: 12 请回答: (1)分析步骤Ⅱ中的操作和原理, 回答下列问题: ①结合表1、2,分析选择的pH及温度分别是 , 其中,可以采用加入 来调节pH; 表1 pH对ZnSO4·7H2O回收量及纯度影响 pH ZnSO4·7H2O的回收量(g) 产品中Fe含量(%) 产品中其他重金属含量(%) 1 114.32 0.750 0.059 2 114.4 0.086 0.056 3 113.68 0.034 0.054 4 113.60 0.010 0.050 5 112.43 0.010 0.050 表2 温度对ZnSO4·7H2O回收量及纯度影响 温度 (℃) ZnSO4·7H2O的回收量(g) 产品中Fe含量(%) 产品中其他重金属含量(%) 20 111.45 0.011 0.052 40 112.89 0.010 0.051 60 113.30 0.010 0.050 80 113.80 0.010 0.050 90 114.40 0.091 0.048 ②过滤时采用减压过滤,操作过程中是否可以使用滤纸并说明理由: ; ③酸性KMnO4溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2沉淀。试写出在该环境下,KMnO4溶液氧化Fe2+的离子方程式: 。若用稀硝酸作氧化剂,除了产物中可能含有Zn(NO3)2外, 还可能的缺点是 ; (2)在整个实验过程中,下列说法正确的是 ; A.滤渣B的主要成分为Cu B.为了检验滤液 B 中是否含有铁元素,可选择 KSCN 溶液进行测定 C.步骤Ⅴ进行洗涤时,可以选择酒精作为洗涤剂,对晶体洗涤1~2次 D.步骤Ⅳ溶液冷却时,若未见晶体析出,可用玻璃棒轻轻地摩擦器壁 (3)为测定ZnSO4·7H2O晶体的纯度,可用K4Fe(CN)6标准液进行滴定。 主要原理如下:2K4Fe(CN)6+3ZnSO4K2Zn3[Fe(CN)6]2↓+3K2SO4 12 准确称取5.000 g ZnSO4·7H2O晶体,用蒸馏水溶解并定容至250 mL,准确移取该溶液25.00 mL至锥形瓶中,用0.050 0 mol·L-1 K4Fe(CN)6溶液进行滴定, 所得数据如下表: 实验次数 滴定前读数/mL 滴定后读数/mL 1 0.10 19.92 2 1.34 21.12 3 0.00 20.10 则ZnSO4·7H2O 晶体的纯度是 (以质量分数表示)。 3.1-溴丁烷是一种重要的化工原料,通常情况下可由正丁醇和溴化钠在浓硫酸存在下制得。实验流程及反应装置如下: 水、浓硫酸、正 丁醇、溴化钠粗产品 1-溴丁烷 (约6 g) 图1 相关物质的部分物理性质如下表: 药品名称 沸点 (℃) 水溶解度 (g/100 mL) 相对分子 质量 用量 正丁醇 117.7 7.9 74 7.5 mL (0.080 0 mol) 1-溴丁烷 101.6 不溶于水 137 溴化钠 77.1 易溶于水 103 10.0 g (0.100 mol) 浓硫酸 12.0 mL (0.220 mol) 续 表 药品名称 沸点 (℃) 水溶解度 (g/100 mL) 相对分子 质量 用量 正丁醇、1-溴 丁烷共沸物 98.6 12 已知:当两种或多种不同成分的均相溶液,以一个特定的比例混合时,在固定的压力下,仅具有一个沸点,此时这个混合物即称作共沸物。回答下列问题: (1)仪器A的名称为 。 (2)制备1-溴丁烷的主要反应为 。 (3)图1中缺少尾气吸收装置,下列装置中合适的是 (填字母)。 (4)进行蒸馏1操作获取粗产品时发现,当温度低于100 ℃时就已经有产品蒸出,其可能的原因为 。 (5)在分液漏斗中洗涤粗产品放气的操作方法是 。 (6)下列有关实验操作及问题的说法正确的是 (填字母)。 图2 A.获取粗产品时,蒸馏烧瓶中的油状液体消失即说明1-溴丁烷已蒸完 B.粗产品往往混有Br2杂质,可用饱和的亚硫酸氢钠或氢氧化钠溶液洗涤除去 C.洗涤在分液漏斗中进行,操作时应遵循把水相从下口放出,有机相从上口倒出的原则 D.蒸馏2操作可以在图2的简易蒸馏装置中进行 (7)该反应的产率为 。 4.某兴趣小组利用废旧聚乳酸材料制备乳酸铝,方案如下: 已知:①反应原理: 12 ②乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂。 请回答: (1)聚乳酸与NaOH加热回流合适的装置是 (填“甲”或“乙”),仪器a的名称 。 (2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的量之比,得出如下实验数据。根据实验1~3,最合适的w(乳酸)为 。根据实验4~6,n(乳酸)∶n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是 。 编 号 时间 /h n(乳酸)∶ n(铝) w(乳 酸) 产率 (%) 编 号 时间 /h n(乳酸)∶ n(铝) w(乳 酸) 产率 (%) 1 8 3.025 0.10 64.0 4 10 2.935 0.20 78.4 2 8 3.025 0.20 72.0 5 10 3.025 0.20 90.2 3 8 3.025 0.30 68.5 6 10 3.505 0.20 91.3 (3)抽滤Ⅰ需对反应容器进行洗涤,并将洗涤液也抽滤。抽滤Ⅱ需对粗产品进行洗涤。所用洗涤剂最合适的分别是 。 A.抽滤Ⅰ洗涤剂用热水,抽滤Ⅱ洗涤剂用冷水 B.抽滤Ⅰ洗涤剂用滤液,抽滤Ⅱ洗涤剂用滤液 C.抽滤Ⅰ洗涤剂先用滤液再用无水乙醇,抽滤Ⅱ洗涤剂用无水乙醇 D.抽滤Ⅰ洗涤剂先用无水乙醇再用滤液,抽滤Ⅱ洗涤剂先用无水乙醇再用滤液 (4)乳酸铝纯度测定方法如下:取a g乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH,加入b mL c mol·L-1的EDTA溶液。然后加入指示剂,用d mol·L-1的标准锌溶液滴定过量的EDTA溶液。Al3+和Zn2+与EDTA均1∶1反应。实验消耗标准锌溶液e mL,则乳酸铝纯度为 。 5.Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下: 12 已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。②3DDTC—NH4+Fe3+(DDTC)3—Fe↓+3N。 请回答下列问题: (1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是 。 A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中 B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液 C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图所示用力振摇 D.振摇几次后需打开分液漏斗上口的玻璃塞放气 E.经几次振摇并放气后,手持分液漏斗静置待液体分层 F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体 (2)下列试剂中,可作反萃取的萃取剂Y的最佳选择是 。 A.高纯水 B.盐酸 C.稀硫酸 D.酒精 (3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中最好选用的碱溶液为 (填“NaOH溶液”或“氨水”),反应的化学方程式为 。 12 不同浓度的两种碱对产品吸油量影响 (4)操作A为过滤、洗涤、煅烧,产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图所示,则煅烧时温度最好控制在 ℃。 (5)现准确称取4.000 g样品,经酸溶、还原为Fe2+,在容量瓶中配成100 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.100 0 mol·L-1的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80 mL。 ①用移液管从容量瓶中吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为 。 ②样品中铁的含量为 (假设杂质不与K2Cr2O7反应)。 6.一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O,合成路线为: 已知:[Cu(NH3)4]2+(aq)Cu2+(aq)+4NH3(aq);(NH4)2SO4在水中可溶,在乙醇中难溶; [Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下: (1)流程图中气体X的主要成分为 (填化学式),步骤1需要加什么酸? (填名称)。 (2)有同学提出:从溶液D到产品的步骤2,可以采用的操作方法依次是加热蒸发、冷却结晶、抽滤、洗涤、干燥。请评价其合理性,并说明理由 ;请另外再提出一种合理的实验方案: (不要求具体的实验步骤)。 12 (3)抽滤装置如下图所示,该装置中的错误之处是 ;抽滤完毕或中途需停止抽滤时,应先 ,然后 。 7.用Zn(主要含有Fe、Al、Pb杂质)和硫酸来制取H2,利用制氢废液制备硫酸锌晶体(ZnSO4·7H2O)、Al2O3和Fe2O3,流程如下: 已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题: (1)调节pH=2的目的是 ,调节pH=2,可加入 (填化学式)。 (2)写出生成沉淀3的化学方程式: 。 (3)加热浓缩ZnSO4溶液出现极薄晶膜时,要停止加热的主要原因是 。 (4)某同学用如图所示的装置抽滤。 ①有关抽滤的说法正确的是 。 A.抽滤的目的主要是得到较干燥的沉淀 B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔 C.图中有一处错误 D.抽滤结束,从吸滤瓶的支管口倒出滤液 ②抽滤,洗涤沉淀的具体操作是 。 (5)为得到干燥的ZnSO4·7H2O产品,选择的干燥方法是 。 A.加热烘干 B.用浓硫酸干燥 C.用酒精洗干 12 D.在空气中自然干燥 参考答案 提升训练30 化学实验综合(第31题) 1.答案: (1)可避免H2C2O4分解 (2)C (3)CuO+2KHC2O4K2[Cu(C2O4)2]+H2O (4)热水 (5)①降低硫酸铜的溶解度,有利于硫酸铜晶体析出 ②蒸馏 (6)88.50% 解析: (1)草酸受热易分解,第①步操作要微热溶解的原因是加快溶解速率和防止H2C2O4分解。(2)黑色固体为CuO,CuO不溶于水,故A错误;用硫酸溶液溶解滤纸上的氧化铜,这会引入S杂质,故B错误;灼烧滤纸,然后转入热的KHC2O4溶液,容易引入新的杂质,故D错误。(3)CuO和KHC2O4反应生成二草酸合铜(Ⅱ)酸钾晶体,因此反应的化学方程式为CuO+2KHC2O4K2[Cu(C2O4)2]+H2O。(4)根据题中所给信息,二草酸合铜(Ⅱ)酸钾微溶于冷水,可溶于热水,微溶于酒精,根据流程,③得到的是滤液,因此所用的洗涤剂为热水。(5)①b.硫酸铜不溶于乙醇,因此使用乙醇可以降低硫酸铜的溶解度,有利于硫酸铜晶体的析出;②乙醇易挥发,因此可通过蒸馏的方法回收乙醇。(6)根据得失电子数目守恒,因此有n(Mn)×5=n(C2)×2×(4-3),解得n(C2)=×20.00×10-3 L×0.010 00 mol·L-1×5=5×10-4mol,即二草酸合铜(Ⅱ)酸钾物质的量为×5×10-4 mol=2.5×10-4 mol,产品的纯度为×100%=88.50%。 2.答案: (1)①4,60 ℃ ZnO ②不可以,因为滤液B中含有KMnO4溶液,具有强氧化性,会腐蚀滤纸,此时可以用玻璃砂漏斗代替布氏漏斗 ③Mn +3Fe2+ +7H2OMnO2↓+3Fe(OH)3↓+5H+ 产生氮氧化合物,会污染环境 (2)BCD (3)85.6 解析: 结合表1、2, 分析可知pH=4时,ZnSO4·7H2O的回收量较大,Fe3+的含量较低,温度为60 ℃时,ZnSO4·7H2O的回收量较高,Fe3+的含量较低,温度为80 ℃时,ZnSO4·7H2O的回收量与60 ℃时相差不多,故选60 ℃时更好。用ZnO来调节溶液的pH不会增加新杂质,同时降低了酸性。 ②过滤时采用减压过滤, 操作过程因为滤液B中含有KMnO4溶液,具有强氧化性,会腐蚀滤纸,不能用滤纸,此时可以用玻璃砂漏斗代替布氏漏斗。 12 ③微酸性的条件下KMnO4能将Fe2+氧化,同时自身能自动分解生成MnO2沉淀。 KMnO4溶液氧化 Fe2+的离子方程式为Mn+3Fe2+ +7H2OMnO2↓+3Fe(OH)3↓+5H+。若用稀硝酸作氧化剂,除了产物中可能含有 Zn(NO3)2外,还会产生氮氧化合物,会污染环境。 (2)滤渣B的主要成分为Fe(OH)3,故A错;检验Fe3+的试剂是KSCN溶液,现象是溶液变成血红色,故B正确;步骤Ⅴ洗涤的是ZnSO4·7H2O晶体,因为它易溶于水,所以可以选择酒精作为洗涤剂,对晶体洗涤1~2次,故C正确;步骤Ⅳ溶液冷却时,若未见晶体析出,可用玻璃棒轻轻地摩擦器壁,目的是靠摩擦在烧杯内壁产生微小的玻璃微晶来充当晶核,细小的颗粒即具有较大曲率,容易诱导结晶。这与加入少量析出晶体(俗称加晶种)来加速晶体析出相似,故D正确。 由于三次消耗的K4[Fe(CN)6]溶液的体积相差不大,取三次的平均值。所以V=19.90 mL,根据滴定原理: 2K4[Fe(CN)6]+3ZnSO4K2Zn3[Fe(CN)6]2↓+3K2SO4 2 3 0.050 0 mol·L-1×19.90×10-3 L 25×10-3 L·c 解得:c=0.059 7 mol·L-1,m(ZnSO4·7H2O)=250×10-3 L×0.059 7 mol·L-1×287 g·mol-1≈4.28 g ZnSO4·7H2O 晶体的纯度=×100%≈85.6%。 3.答案: (1)圆底烧瓶 (2)NaBr+H2SO4HBr+NaHSO4 C4H9OH+HBrC4H9Br+H2O(或C4H9OH+NaBr+H2SO4C4H9Br+H2O+NaHSO4) (3)AC (4)粗产品中含有未反应的正丁醇,和1-溴丁烷形成低于沸点的共沸物一同蒸出 (5)将漏斗上口向下倾斜,下部支管斜向上方,左手握住旋塞,用拇指和食指旋开旋塞放气 (6)AD (7)54.7% 4.答案: (1)甲 冷凝管 (2)0.20 超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多 (3)C (4)% 解析: (1)装置甲烧瓶上长导管可作冷凝回流,通过反复回流,可以提高原料利用率,适合聚乳酸与NaOH加热回流装置,仪器a的名称为冷凝管。 (2)根据实验1~3,ɷ(乳酸)为0.20,产率最高;根据实验4~6,最可能的理由是n(乳酸)∶n(铝)超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多。(3)抽滤Ⅰ 12 需对反应容器进行洗涤,并将洗涤液也抽滤,洗涤剂可先用滤液洗涤,减小溶质的损失,且方便、经济,再用无水乙醇,减小产品的损失;抽滤Ⅱ需对粗产品进行洗涤,可直接选择无水乙醇,这样可避免水洗,减小产品的损失,故答案为C。 (4)总EDTA的物质的量为b×10-3 L×c mol·L-1=bc×10-3mol,消耗标准锌的物质的量为e×10-3 L×d mol·L-1=de×10-3 mol,乳酸铝的物质的量为bc×10-3 mol-de×10-3 mol=(bc-de)×10-3 mol,则乳酸铝纯度为×100%=%。 5.答案: (1)ABF (2)A (3)NaOH溶液 (DDTC)3—Fe+3NaOH3DDTC—Na+Fe(OH)3↓ (4)800 (5)①将移液管垂直伸入稍倾斜的锥形瓶中,使其尖端与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 ②69.89% 解析: (1)C项,振荡分液漏斗中液体时,一般将分液漏斗倒置振荡。D项,放气时左手握住活塞部分,右手压住分液漏斗玻璃塞,倒置旋转活塞进行放气。E项,将分液漏斗置于带铁圈的铁架台上静置分层;(2)当盐酸浓度降低时化合物解离,所以降低盐酸的浓度可以起到反萃取的作用。选用高纯水降低盐酸的浓度;(3)在相同浓度的前提下,NaOH溶液比氨水更能减少Fe2O3的吸油量,从而提高油漆的质量。反应的化学方程式:(DDTC)3—Fe+3NaOH3DDTC—Na+Fe(OH)3↓;(4)由图像知,800 ℃时纯度基本达到最大的水平,再提高温度纯度变化不明显,同时消耗热能,综合考虑,选择800 ℃为最佳煅烧温度;(5)用移液管取液时:锥形瓶倾斜放置,移液管垂直伸入并使其尖端与锥形瓶的内壁接触。滴定过程中发生的反应:6Fe2++Cr2+14H+6Fe3++2Cr3++7H2O,注意:配制溶液100 mL,移液管取出25 mL进行测定实验,故要注意对应。 6.答案: (1)SO2 硫酸 (2)不合理,加热蒸发,温度升高,NH3放出,会促进[Cu(NH3)4]2+(aq)Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,得到的产物晶体会含有杂质 向溶液D中加入适量乙醇,再过滤、洗涤、干燥 (3)布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口 断开连接安全瓶与抽气装置间的橡皮管 关闭抽气装置中的水龙头 解析: 根据流程图可知,在充足的氧气中煅烧含Fe3O4的辉铜矿生成SO2气体和固体B,固体B为CuO、Cu2O、Fe3O4的混合物,用含有H2O2的稀硫酸酸溶,得到硫酸铜和硫酸铁的混合溶液C和滤渣铜,向溶液中加入氨水生成氢氧化铁和溶液D,溶液D为[Cu(NH3)4]SO4溶液,然后通过操作2得到产品[Cu(NH3)4]SO4·H2O。 (1)含有硫的矿物燃烧,肯定生成二氧化硫气体,则流程图中气体X的主要成分为SO2;根据上述分析,步骤1中需要加入硫酸才能得到产品,否则会引入杂质。 (2)根据提示中提供的信息,加热蒸发,温度升高,NH3放出,会促进[Cu(NH3)4]2+(aq)Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体含有杂质Cu(OH)2或Cu2(OH)2SO4 12 ,根据[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图可知,随着乙醇体积分数的增大,[Cu(NH3)4]SO4·H2O的溶解度降低,所以合理的方案为向溶液D中加入适量乙醇,再过滤、洗涤、干燥。 (3)为了加快过滤速度得到较干燥的沉淀,可进行减压过滤,也称抽滤或吸滤,题图所示装置为抽滤装置,装置中存在的错误是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,这样不利于吸滤;抽滤完毕或中途停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头。 7.答案: (1)防止Zn2+水解,Zn2++2H2OZn(OH)2+2H+ H2SO4 (2)NaHCO3+NaAlO2+H2OAl(OH)3↓+Na2CO3 (3)防止失去结晶水 (4)①B ②先关小水龙头,加入洗涤剂浸没沉淀物,使洗涤剂缓慢通过沉淀物 (5)C 解析: (1)调节pH=5.2时,沉淀的主要成分是Al(OH)3、Fe(OH)3,滤液中含有ZnSO4,调节滤液pH=2可以抑制ZnSO4水解,防止生成Zn(OH)2,同时为了避免引入杂质,应当使用H2SO4。(2)沉淀Al(OH)3、Fe(OH)3在NaOH溶液作用下生成NaAlO2,Fe(OH)3不参加反应,过滤后滤液中含有NaAlO2、NaOH,加入NaHCO3后,反应生成的沉淀是Al(OH)3,NaHCO3+NaAlO2+H2OAl(OH)3↓+Na2CO3。(3)出现晶膜时继续加热会使ZnSO4·7H2O晶体失去结晶水。(4)抽滤主要是为了加快过滤速度,同时得到干燥的沉淀,A错误;为了防止滤纸边缘不能与抽滤漏斗侧壁完全贴合,所以抽滤的滤纸要略小于漏斗内径,但是必须盖住所有小孔,B正确;原装置图中安全瓶连接吸滤瓶的导管不能伸入安全瓶中太长,布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,C错误;实验结束后,滤液从吸滤瓶上口倒出,D错误。洗涤沉淀时,先调小吸滤气压差,再在抽滤漏斗中加入洗涤剂浸没沉淀物。(5)ZnSO4·7H2O晶体易风化,加热烘干会导致晶体失去结晶水,A错误;浓硫酸具有强烈的吸水性,用浓硫酸干燥也会使晶体失去结晶水,B错误;酒精能够溶解水,但不会导致晶体失去结晶水,洗涤后酒精低温下就很容易挥发,C正确;空气中自然干燥也会风化,D错误。 12查看更多