- 2021-05-14 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学总复习压轴套题增分练2
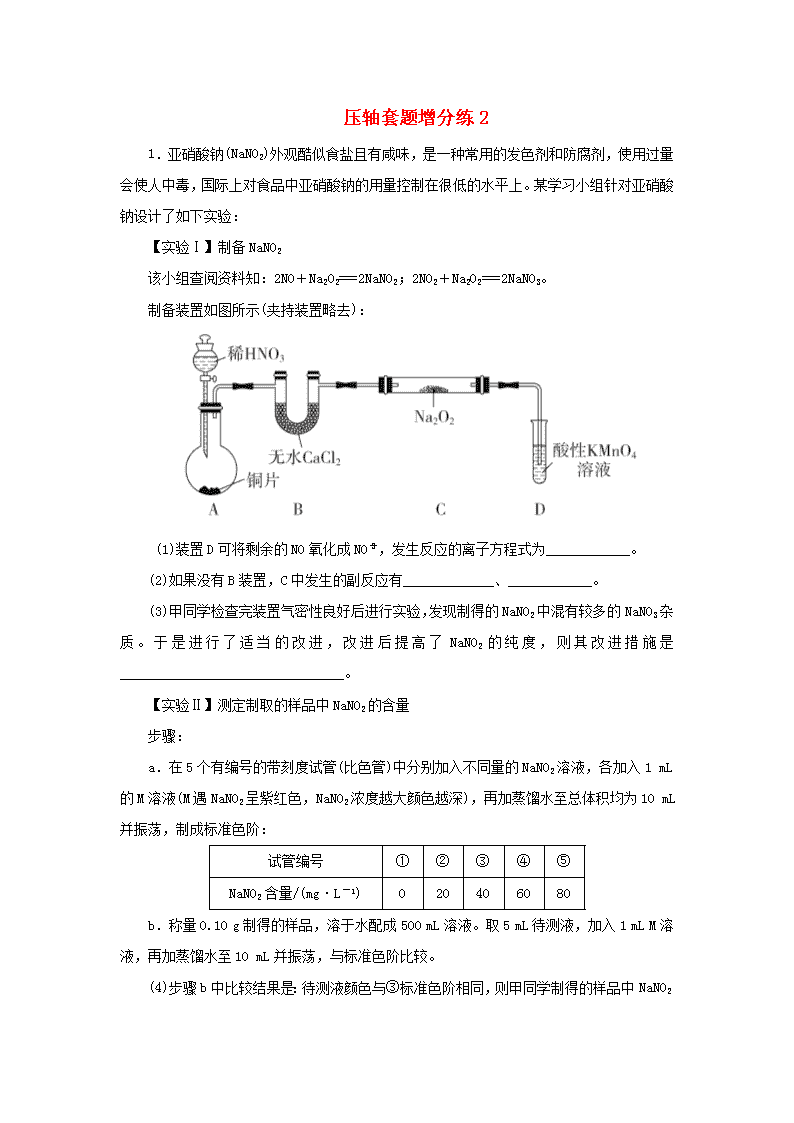
压轴套题增分练2 1.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验: 【实验Ⅰ】制备NaNO2 该小组查阅资料知:2NO+Na2O2===2NaNO2;2NO2+Na2O2===2NaNO3。 制备装置如图所示(夹持装置略去): (1)装置D可将剩余的NO氧化成NO,发生反应的离子方程式为____________。 (2)如果没有B装置,C中发生的副反应有_____________、____________。 (3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。 【实验Ⅱ】测定制取的样品中NaNO2的含量 步骤: a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶: 试管编号 ① ② ③ ④ ⑤ NaNO2含量/(mg·L-1) 0 20 40 60 80 b.称量0.10 g制得的样品,溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,再加蒸馏水至10 mL并振荡,与标准色阶比较。 (4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2 的质量分数是________。 (5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。 实验方案 实验现象 实验结论 取5 mL待测液,加入______________,振荡,再加入1 mL M溶液,_________ ___________________________,再振荡,与③标准色阶对比 ________________________________ 维生素C可以有效降低NaNO2的含量 答案 (1)5NO+3MnO+4H+===5NO+3Mn2++2H2O (2)2Na2O2+2H2O===4NaOH+O2↑ 2NO+O2===2NO2 2NO2+Na2O2===2NaNO3 (3)在A、B之间增加装有水的洗气瓶 (4)40% (5)维生素C 加入蒸馏水至总体积为10 mL 紫红色比③标准色阶浅 解析 (1)酸性KMnO4溶液具有强氧化性,能将NO氧化为NO,反应的离子方程式为5NO+3MnO+4H+===5NO+3Mn2++2H2O。 (2)铜和稀硝酸反应制得的NO中含有杂质水蒸气。 (3)制得的NaNO2中混有较多的NaNO3杂质,说明制得的NO中混有NO2,故应在装置A、B之间增加装有水的洗气瓶,以除去杂质NO2。 (4)待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量是40 mg·L-1 ×0.01 L×=40 mg=0.04 g,故样品中NaNO2的质量分数=×100%=40%。 (5)取5 mL待测液,然后加入维生素C,再加入1 mL M溶液,最后加入蒸馏水至总体积为10 mL,若紫红色比③标准色阶浅,说明NaNO2的含量低,则可以证明维生素C可以有效降低NaNO2的含量。 2.碲(Te)位于元素周期表第ⅥA族,由该元素组成的物质可用作石油裂化的催化剂,电镀液的光亮剂,玻璃的着色材料,合金材料的添加剂等。碲化铜渣是电解精炼铜时产生的一种矿渣,其主要含Cu2Te、Au、Ag等,利用下列工艺流程可回收碲: 已知:TeO2的熔点为733 ℃,微溶于水,可溶于强酸和强碱。 回答下列问题: (1)Te与S的最高价氧化物对应的水化物的酸性强弱顺序为________(用化学式表示)。 (2)“酸浸1”需加热,加热的目的是______________________,“酸浸1”发生反应的氧化产物是______________(写化学式)。 (3)“水浸”后“滤液1”的颜色是________。 (4)“滤渣1”进行“碱浸”的离子方程式是_____________________。 (5)“滤液2”加双氧水的目的是__________________________________,“操作1”的名称是____________________。 (6)“还原”制备碲粉的离子方程式为_______________________。 (7)从可持续发展意识和绿色化学观念来看,“滤渣2”进行酸浸的意义是________________________________。 答案 (1)H2SO4>H2TeO4 (2)加快浸出速率 CuSO4、TeO2 (3)蓝色(或浅蓝色) (4)TeO2+2OH-===TeO+H2O (5)将Na2TeO3氧化为Na2TeO4 加热浓缩(或浓缩) (6)TeO+3SO+2H+===3SO+Te↓+H2O (7)“滤渣2”经过酸浸可得到含CuSO4的滤液,并可达到回收Au、Ag的目的,符合可持续发展意识和绿色化学观念 解析 (1)S、Te同主族,同主族元素从上到下,非金属性逐渐减弱,故H2SO4的酸性比H2TeO4强。 (2)酸浸时加热的目的是提高浸出速率,结合流程图知,“酸浸1” 发生反应的化学方程式为Cu2Te+2H2SO4+2O22CuSO4+TeO2+2H2O,故其氧化产物为CuSO4、TeO2。 (3)“滤液1”的溶质中含CuSO4,故“滤液1”的颜色为蓝色。 (4)“滤渣1”中含有TeO2,TeO2溶解于NaOH溶液生成亚碲酸盐,故反应的离子方程式为TeO2+2OH-===TeO+H2O。 (5)“碱浸”后滤液2中的溶质的主要成分是Na2TeO3,该物质与Na2SO3类似,具有较强的还原性,加入双氧水可将其氧化为Na2TeO4。“操作1”的后续物质为“Na2TeO4浓溶液”,故该操作为加热浓缩。 (6)由流程图可知,“还原”的反应物为Na2TeO4、Na2SO3、H2SO4,生成物有单质Te,故发生的是酸性条件下Na2SO3还原Na2TeO4的反应,反应的离子方程式为TeO+3SO+2H+===3SO+Te↓+H2O (7)分析流程图并结合碲化铜渣中含Au、Ag等,知“滤渣2”经酸浸后可得到含CuSO4的滤液,并可回收Au、Ag,符合可持续发展意识和绿色化学观念。 3.为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题: (1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。 ①反应中加入铁粉可以提高反应速率,其原因是____________________。 ②已知某些化学键键能数据如下表: 化学键 H—H N≡N N—H E/(kJ/mol) 436 946 391 反应N2(g)+H2(g) NH3(g)的活化能Ea=254 kJ/mol,则反应NH3(g) N2(g)+ H2(g)的活化能Eb=________ kJ/mol。 (2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g)2NO(g),该反应在不同温度下的平衡常数K如下表: 温度 27 ℃ 2000 ℃ K 3.8×10-31 0.1 温度为2000 ℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2 mol/L,c(O2)=0.03 mol/L,c(NO)=0.03 mol/L,此时该反应的速率(v)应满足的关系为________(填字母序号)。 A.v正>v逆 B.v正=v逆 C.v正查看更多
相关文章
- 当前文档收益归属上传用户