- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮复习专题复习回扣基础排查考点十二考前必梳理的11组教材经典实验练习
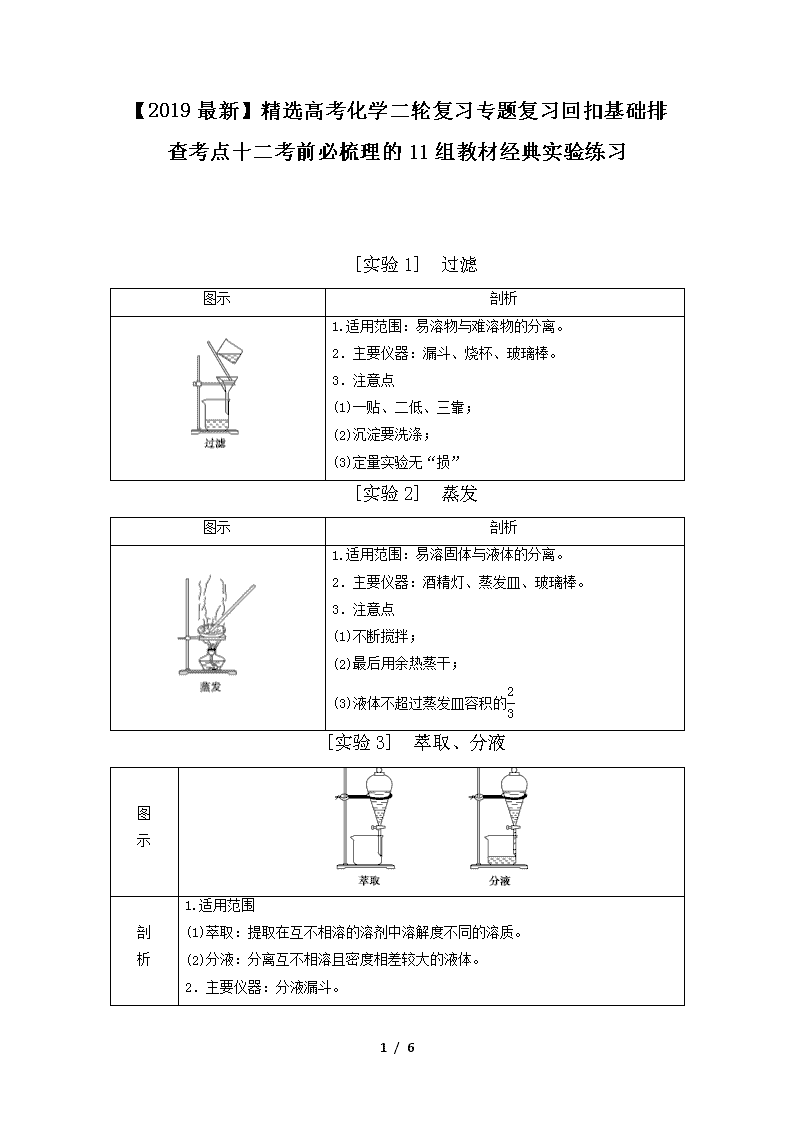
【2019最新】精选高考化学二轮复习专题复习回扣基础排查考点十二考前必梳理的11组教材经典实验练习 [实验1] 过滤 图示 剖析 1.适用范围:易溶物与难溶物的分离。 2.主要仪器:漏斗、烧杯、玻璃棒。 3.注意点 (1)一贴、二低、三靠; (2)沉淀要洗涤; (3)定量实验无“损” [实验2] 蒸发 图示 剖析 1.适用范围:易溶固体与液体的分离。 2.主要仪器:酒精灯、蒸发皿、玻璃棒。 3.注意点 (1)不断搅拌; (2)最后用余热蒸干; (3)液体不超过蒸发皿容积的 [实验3] 萃取、分液 图 示 剖 析 1.适用范围 (1)萃取:提取在互不相溶的溶剂中溶解度不同的溶质。 (2)分液:分离互不相溶且密度相差较大的液体。 2.主要仪器:分液漏斗。 6 / 6 3.注意点:(1)查漏;(2)选择萃取剂;(3)漏斗内外大气相通;(4)上层液体从上口倒出 [实验4] 蒸馏 图 示 剖 析 1.适用范围:分离沸点不同的液态混合物。 2.主要仪器:蒸馏烧瓶、冷凝管、牛角管、锥形瓶、酒精灯。 3.注意点:(1)冷凝水从下口进入;(2)加碎瓷片 [实验5] 一定物质的量浓度溶液的配制 图 示 剖 析 1.容量瓶 2.配制步骤 (1)用固体配制溶液 计算→称量→溶解→转移→洗涤→定容→摇匀→装瓶。 (2)用液体配制溶液 计算→量取→稀释→转移→洗涤→定容→摇匀→装瓶。 3.误差分析依据 c(B)= [实验6] Fe3+与Fe2+的鉴别 6 / 6 方法1 直接观察颜色 Fe2+溶液呈浅绿色,Fe3+溶液呈棕黄色 方法2 利用显色反应(形成配离子) 方法3 利用氢氧化物沉淀的颜色 方法4 利用 Fe3+的氧化性 方法5 利用Fe2+的还原性 [实验7] Na2CO3和NaHCO3的鉴别与除杂 加 热 法 原理:2NaHCO3Na2CO3+H2O+CO2↑ 试 剂 法 1.与盐酸反应 (1)向Na2CO3中逐滴加盐酸 Na2CO3+HCl===NaCl+NaHCO3 NaHCO3+HCl===NaCl+H2O+CO2↑ (2)向盐酸中加Na2CO3 Na2CO3+2HCl===2NaCl+H2O+CO2↑ 2.与Ca(OH)2反应 Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O 6 / 6 3.Na2CO3+H2O+CO2===2NaHCO3 [实验8] 氯水的性质 氯 水 的 漂 白 作 用 续 表 氯水的成分、Cl2的性质 1.氯水中存在可逆反应:Cl2+H2OHCl+HClO 新制氯水的成分 2. 3.漂白性对比 (1)干燥Cl2无漂白性,Cl2溶于水,溶于水的Cl2与水反应生成HClO,HClO具有漂白性。 (2)SO2具有漂白性,发生反应SO2+Cl2+2H2O===2HCl+H2SO4时,漂白性消失。 (3)活性炭具有漂白性,原理为吸附作用 [实验9] 氨气的实验室制法 图示 6 / 6 剖析 [实验10] 中和滴定 误差分析 中和滴定的三个关键步骤 1.滴定前的准备 (1)滴定管:查漏→洗涤→润洗→装液→(赶气泡)→调液面→记录读数。 (2)锥形瓶:洗涤→装液→记录读数→加指示剂。 2.滴定过程 (1)左手控制酸式滴定管活塞或碱式滴定管中的玻璃球。 (2)右手摇动锥形瓶。 (3)眼睛注视锥形瓶内溶液颜色变化。 3.终点判断 (1)溶液颜色发生变化且在半分钟内不恢复原来的颜色,视为滴定终点,并记录消耗标准液的体积。 (2)多次测定求各体积的平均值 误差分析的依据 c(待)= [实验11] 乙酸乙酯的制备 图示 剖析 1.反应原理 CH3COOH+CH3CH2OH 6 / 6 CH3COOCH2CH3+H2O 2.装置 (1)大试管(试管口向上倾斜); (2)长导管(冷凝回流、导气)。 3.浓硫酸的作用:催化剂、吸水剂。 4.饱和Na2CO3溶液的作用:降低乙酸乙酯的溶解度,消耗乙酸,溶解乙醇 6 / 6查看更多