- 2021-05-13 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
(浙江专版)备战2020高考化学一轮复习 难题强化练 强化练3 多重曲线的分析与应用
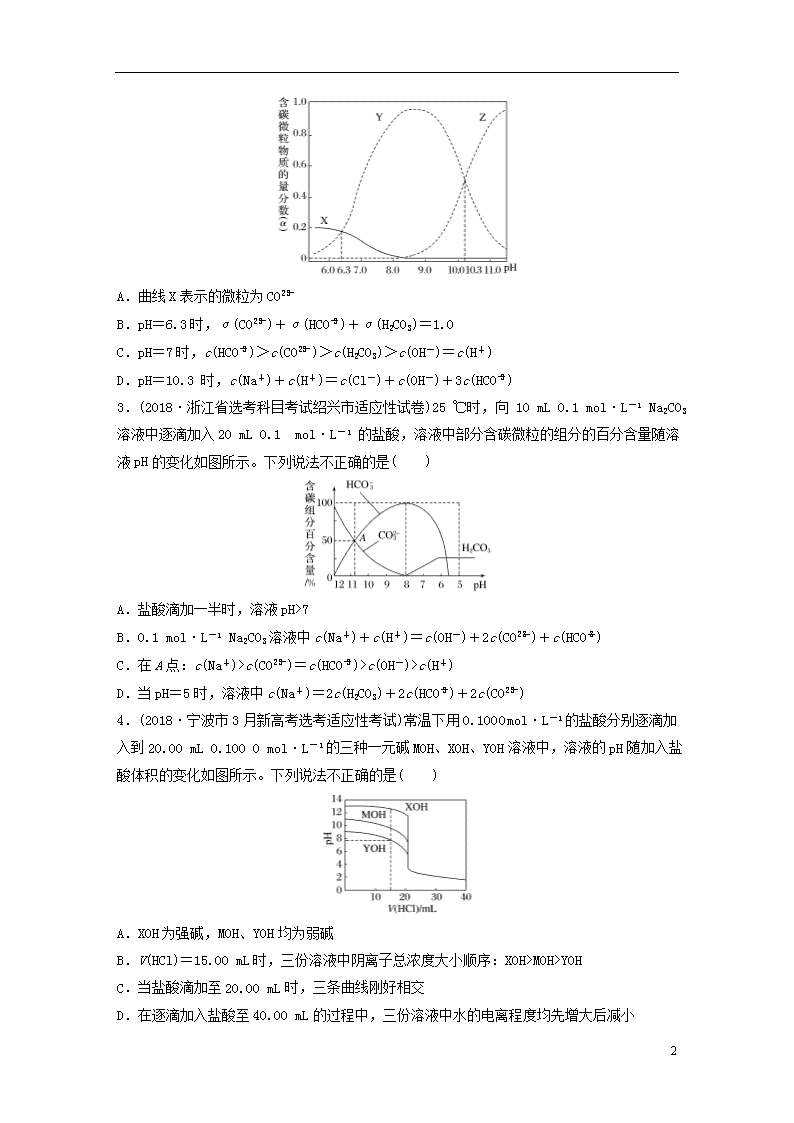
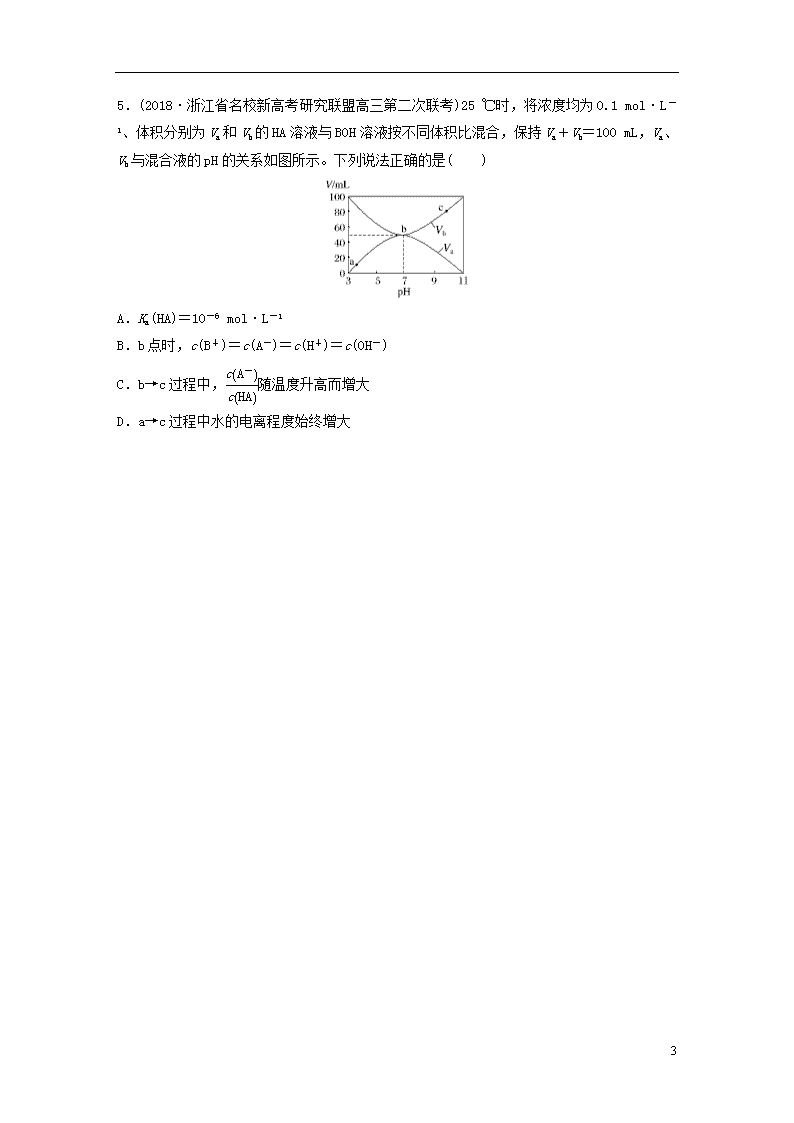
强化练3 多重曲线的分析与应用 1.(2018·杭州市学军中学高三选考前适应性练习)常温下,现有 0.1 mol·L-1的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是( ) A.当溶液的 pH=9 时,溶液中存在下列关系: c(NH)>c(HCO)>c(NH3 ·H2O)>c(CO) B.NH4HCO3 溶液中存在下列守恒关系: c(NH)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO)+c(H2CO3) C.往该溶液中逐滴滴加氢氧化钠时,NH和 HCO浓度均逐渐减小 D.通过分析可知常温下Kb(NH3·H2O)大于 Ka1(H2CO3) 2.(2018·温州市高三选考适应性测试)25 ℃时,一定量的Na2CO3与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(α)与pH的关系如图所示。下列说法正确的是( ) 7 A.曲线X表示的微粒为CO B.pH=6.3时,α(CO)+α(HCO)+α(H2CO3)=1.0 C.pH=7时,c(HCO)>c(CO)>c(H2CO3)>c(OH-)=c(H+) D.pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO) 3.(2018·浙江省选考科目考试绍兴市适应性试卷)25 ℃时,向 10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入20 mL 0.1 mol·L-1 的盐酸,溶液中部分含碳微粒的组分的百分含量随溶液pH的变化如图所示。下列说法不正确的是( ) A.盐酸滴加一半时,溶液pH>7 B.0.1 mol·L-1 Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO)+c(HCO) C.在A点:c(Na+)>c(CO)=c(HCO)>c(OH-)>c(H+) D.当pH=5时,溶液中c(Na+)=2c(H2CO3)+2c(HCO)+2c(CO) 4.(2018·宁波市3月新高考选考适应性考试)常温下用0.100 0 mol·L-1的盐酸分别逐滴加入到20.00 mL 0.100 0 mol·L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列说法不正确的是( ) A.XOH为强碱,MOH、YOH均为弱碱 B.V(HCl)=15.00 mL时,三份溶液中阴离子总浓度大小顺序:XOH>MOH>YOH C.当盐酸滴加至20.00 mL时,三条曲线刚好相交 D.在逐滴加入盐酸至40.00 mL的过程中,三份溶液中水的电离程度均先增大后减小 7 5.(2018·浙江省名校新高考研究联盟高三第二次联考)25 ℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( ) A.Ka(HA)=10-6 mol·L-1 B.b点时,c(B+)=c(A-)=c(H+)=c(OH-) C.b→c过程中,随温度升高而增大 D.a→c过程中水的电离程度始终增大 7 6.(2018·嘉兴市高三二模)25 ℃时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、HSO和SO,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是( ) A.a表示SO物质的量分数随溶液pH变化的曲线 B.pH=8的溶液中:c(HSO)>c(SO) C.pH=7的溶液中:c(Na+)=c(HSO)+2c(SO) D.1 mol·L-1的NaHSO3溶液中存在:c(H2SO3)=c(H+)+c(OH-)+c(SO) 7.(2018·浙江省十校联盟选考3月适应性考试)25 ℃时,体积均为20 mL、浓度均为0.1 mol·L-1的两种酸HX、HY分别与0.1 mol·L-1 的NaOH 溶液反应,所加NaOH溶液体积与反应后溶液的pH关系如图所示。下列叙述正确的是( ) A.加入10 mL NaOH溶液时,a 点c(X-)查看更多