- 2021-05-13 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学大一轮复习微观结构与物质多样性第三单元微粒之间的相互作用力及晶体结构学案
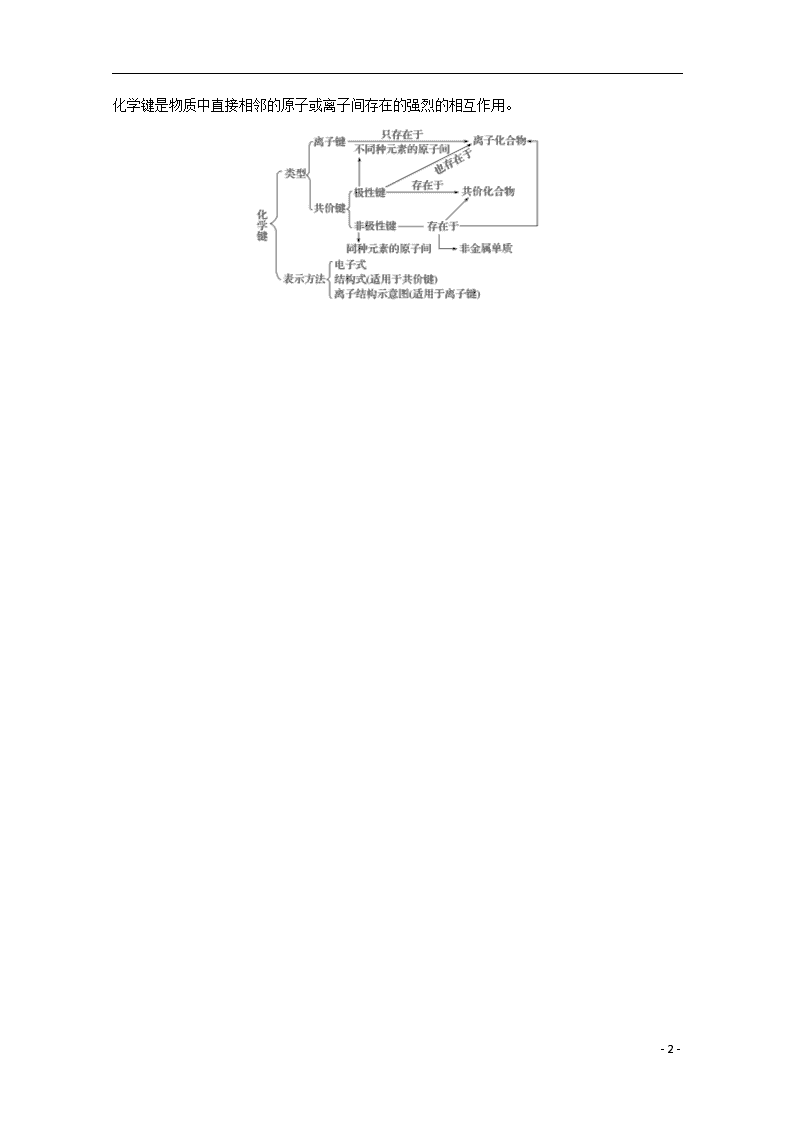
第三单元 微粒之间的相互作用力及晶体结构 [考试标准] 知识条目 必考要求 加试要求 1.化学键的含义 a a 2.离子键、共价键的概念和成因 b b 3.离子化合物、共价化合物的概念 a a 4.简单离子化合物、共价分子的电子式 b b 5.简单共价分子的结构模型、结构式 a a 6.分子间作用力的含义,分子间作用力对分子构成的物质的某些物理性质的影响 a b 7.简单共价分子的空间结构和键能 a 8.氢键的概念、形成条件和原因,氢键对物质性质的影响 b 9.NaCl、金刚石、足球烯、干冰、石英中微粒的空间排列方式及相互间作用力 a a 10.离子晶体、分子晶体、原子晶体、金属晶体的形成方式 a a 11.离子晶体、分子晶体、原子晶体、金属晶体的主要特性 a 考点一 微粒之间的相互作用力 (一)化学键及类型 - 20 - 化学键是物质中直接相邻的原子或离子间存在的强烈的相互作用。 - 20 - (二)离子键、共价键的比较 离子键 共价键 非极性键 极性键 概念 阴、阳离子通过静电作用所形成的化学键 原子间通过共用电子对而形成的化学键 成键粒子 阴、阳离子 原子 成键实质 阴、阳离子的静电作用 共用电子对不偏向任何一方 共用电子对偏向一方原子 形成条件 活泼金属元素与活泼非金属元素经电子得失,形成离子键 同种元素原子之间成键 不同种元素原子之间成键 形成的物质 离子化合物 非金属单质;某些共价化合物或离子化合物 共价化合物或离子化合物 (三)离子化合物和共价化合物的判断方法 1.根据构成化合物的微粒间的化学键来判断 一般来说,活泼的金属原子和活泼的非金属原子间形成的是离子键,同种或不同种非金属原子间形成的是共价键。含有离子键的化合物一定是离子化合物;共价化合物中只含有共价键,不含离子键;只含共价键的物质不一定是共价化合物,可能是非金属单质。 2.根据化合物的类型来判断 大多数碱性氧化物、强碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含氧酸都属于共价化合物。 3.根据化合物的性质来判断 熔点、沸点较低的化合物(SiO2、SiC等除外)是共价化合物。溶于水后不能发生电离的化合物是共价化合物,熔化状态下能导电的化合物是离子化合物,不导电的化合物是共价化合物。 (四)化学键的断裂与化学反应 1.化学反应过程 化学反应过程中反应物中的化学键被破坏。如H2+F2===2HF,H—H键、F—F键均被破坏。 化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。 2.物理变化过程 (1)离子化合物,溶于水便电离成自由的阴、阳离子,离子键被破坏;熔化后,也电离成自由的阴、阳离子,离子键被破坏。 (2)有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏。如:CO2、SO3 - 20 - 等;有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏。如:HCl、H2SO4等强酸。 (五)电子式 1.书写电子式的注意事项 (1)无论何种微粒,其电子式都是以原子为基本单位组成的,不能出现角码甚至系数。 (2)组成各种微粒的各个原子的电子式,必须力求均匀、对称。稳定的8电子结构通常表示为四对电子(一般为元素符号的上、下、左、右各一对电子)。 2.书写电子式的技巧 (1)原子:依据元素的原子最外层电子个数的多少,先用小黑点“·”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对。例如:Na、Mg、、、、、、。 (2)离子: ①阳离子:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离子符号本身。例如:Na+、K+、Mg2+、、Ca2+、Ba2+、Al3+;复杂的阳离子(例如NH、H3O+等)除应标出共用电子对、非共用电子对外,还应加中括号,并在括号的右上方标出离子所带的电荷。例如:、。 ②阴离子:无论是简单阴离子,还是复杂的阴离子,都应标出电子对,还应加中括号,并在括号的右上方标出离子所带的电荷。例如:、、、、。 (3)共价型单质分子:必须正确地表示出共用电子对数,并满足每个原子的稳定结构。例如:HH、、、N⋮⋮N。 (4)共价化合物:共价化合物电子式的书写,基本与共价型单质分子相同,一般为正价者在前。对于不同价态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边。例如:、、、、。 - 20 - (5)离子化合物:离子化合物电子式的书写,是将阴、阳离子(阳离子在前,阴离子在后)拼在一起。对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写。例如:、、、、。 (六)分子间作用力 1.概念 分子间存在着将分子聚集在一起的作用力叫分子间作用力,分子间作用力包括范德华力和氢键。 2.特点 (1)分子间作用力比化学键弱得多,它主要影响物质的熔、沸点和溶解度等物理性质,而化学键主要影响物质的化学性质。 (2)分子间作用力只存在于由共价键形成的多数化合物分子之间和绝大多数气态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在分子间作用力。 3.氢键(加试) (1)氢原子与电负性较大的原子以共价键结合,若与另一电负性较大的原子接近时所形成的一种特殊的分子间或分子内作用,是一种比范德华力稍强的相互作用。 (2)除H原子外,形成氢键的原子通常是N、O、F。 4.变化规律 (1)组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。 (2)与H原子形成氢键的原子的电负性越大,所形成的氢键越强,物质的熔、沸点越高。 (七)简单共价分子的空间结构及键能 1.指出下列分子的空间结构 Cl2:直线形;H2O: V形;NH3:三角锥型;CH4:正四面体型;CO2:直线形;C2H4:平面形;C2H2:直线形;:平面正六边形;CS2:直线形;CCl4:正四面体型。 2.键能(加试) (1)概念:气态基态原子形成1 mol化学键放出的最低能量。 (2)因素:成键原子半径越小,键长越短,键能越大,分子越稳定。 试比较下列分子的稳定性(填“>”或“<”): NH3 > PH3;H2S < H2O;HCl > HBr。 - 20 - 3.简单共价分子的两种模型——球棍模型和比例模型 球棍模型主要体现的是分子空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系;两种模型都显示了原子间的连接顺序,但球棍模型侧重价键结构,比例模型侧重原子大小。 考查两种模型的设错方式:(1)混淆两种模型,(2)比例模型中混淆原子大小。 几种典型物质的电子式、结构式和模型: 物质 HCl Cl2 H2O NH3 CH4 电子式 结构式 H—Cl Cl—Cl H—O—H 球棍模型 比例模型 1.正误判断,正确的打“√”,错误的打“×” (1)二氧化碳的结构式:O==C==O(√) (2017·浙江11月选考,8B) (2)甲烷的球棍模型:(√) (2017·浙江11月选考,8C) (3)CO2的电子式 (√) (2017·浙江4月选考,7A) (4)Cl2的结构式:Cl—Cl(√) - 20 - (2017·浙江4月选考,7B) (5)氯化钠的电子式:NaC(×) (2016·浙江10月选考,7A) (6)乙炔的结构式:CH≡CH(×) (2016·浙江4月选考,7B) (7)水分子的结构式: (√) (2015·浙江10月选考,7A) (8)氯气的比例模型:(×) (2015·浙江10月选考,7C) 2.正误判断,正确的打“√”,错误的打“×” (1)Mg2+和S2-的最外电子层都形成8个电子的稳定结构(√) (2017·浙江11月选考,20A) (2)浓H2SO4与H2O混合时放出热量与微粒之间的作用力有关(√) (2017·浙江11月选考,20C) (3)H2O2易分解是因为H2O2分子间作用力弱(×) (2017·浙江11月选考,20D) (4)化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键(√) (2017·浙江4月选考,20B) (5)CH4和CCl4中,每个原子的最外层都具有8电子稳定结构(×) (2017·浙江4月选考,20C) (6)NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响(×) (2017·浙江4月选考,20D) (7)Cl2、Br2、I2的分子间作用力依次减小(×) (2016·浙江10月选考,20A) (8)氢氧化钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性(√) (2016·浙江10月选考,20C) (9)水电解生成氢气和氧气,有化学键的断裂和形成(√) (2016·浙江10月选考,20D) (10)MgF2晶体中的化学键是共价键(×) (2016·浙江4月选考,20A) (11)N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构(√) (2016·浙江4月选考,20C) - 20 - (12)HCl属于共价化合物,溶于水能电离出H+和Cl-(√) (2015·浙江10月选考,15A) (13)NaOH是离子化合物,该物质中只含离子键(×) (2015·浙江10月选考,15B) 备考导向 学考中对本部分的考查,主要涉及电子式、结构式、球棍模型、比例模型的正误判断;物质变化与化学键的变化;8电子稳定结构的正误判断;分子间作用力的影响因素等。以选择题的形式考查本部分内容。 题组一 离子键、共价键的比较 1.下列说法正确的是( ) A.化学键是相邻离子或原子间的一种作用力,既包括静电吸引力,又包括静电排斥力 B.所有物质中都存在化学键 C.由活泼金属元素与活泼非金属元素形成的化学键都是离子键 D.原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键 答案 A 2.下列说法不正确的是( ) A.非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键 B.非金属元素原子间形成的共价键一定是极性键 C.不同种非金属双原子间形成的共价键一定是极性键 D.多种非金属原子间既可以形成离子键,也可以形成极性键和非极性键 答案 B 题组二 电子式和结构式的书写 3.写出下列物质的电子式。 MgCl2:; Na2O2:; NaOH:; - 20 - NH4Cl:; Cl2:; N2:; H2O2:; HClO:; CCl4:。 4.写出下列物质的结构式。 N2:N≡N;H2O:H—O—H;CO2:O==C==O;H2O2:H—O—O—H。 题组三 两种模型的判断 5.正误判断,正确的打“√”,错误的打“×” (1)CH4的球棍模型:(√) (2)四氯化碳的球棍模型:(×) (3)CCl4的比例模型:(×) (4)水分子的比例模型:(×) (5)乙炔分子的球棍模型:(√) (6)比例模型可以表示CO2分子或SiO2分子(×) (7)NH3的比例模型:(×) (8)比例模型(其中表示氢原子,●表示碳原子,表示氧原子)表示乙酸(√) - 20 - 题组四 微粒间作用力与物质变化 6.正误判断,正确的打“√”,错误的打“×” (1)加热硅、硫晶体使之熔化,克服的作用力不同(√) (2)二氧化硅熔化和干冰气化所破坏的作用力不相同(√) (3)HBr比HCl的热稳定性差说明HBr的分子间作用力比HCl弱(×) (4)碘单质升华,克服的是其分子间作用力(√) (5)HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl-(√) (6)碘晶体是分子晶体,加热升华过程中只需克服分子间作用力(√) (7)氯化钠的电离是一个破坏离子键的过程(√) (8)HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强(×) (9)碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力(×) (10)硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电(×) (11)H2和Cl2在光照条件反应生成HCl,一定有共价键的断裂和形成(√) (12)HF比H2O稳定性更强,是由于HF分子间作用力较大(×) (13)Na投入到水中,有共价键的断裂与形成(√) (14)干冰受热易升华,但不易分解,说明其化学键比分子间作用力强(√) (15)石墨转化为金刚石的过程中,既有化学键的断裂,又有化学键的形成(√) (16)NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键(√) (17)H2O、H2S、H2Se的分子间作用力依次增大,沸点依次升高(×) (18)HF比HCl稳定是因为HF间存在氢键(×) 题组五 8电子结构的判断 7.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( ) A.CH4 B.CH2==CH2 C.CO2 D.N2 答案 C 解析 CH4、CH2==CH2中氢不满足8电子稳定结构,A、B项错;N2中只含有非极性键且为单质,D项错。 8.下列物质中所有原子均满足最外层8电子稳定结构的化合物是( ) A.PCl5 B.P4 C.CCl4 D.NH3 答案 C 解析 判断原子满足最外层8电子结构的方法为最外层电子数+所成价键数=8,故A、D项错;P4为单质,而非化合物,故B项错;C项中的5个原子的最外层均为8电子稳定结构,故C项正确。 - 20 - 判断分子中各原子是否达到8电子稳定结构的主要方法 (1)经验规律法 凡符合最外层电子数+|化合价|=8的皆为8电子结构。 (2)试写结构法 判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如:①H2O,O原子最外层有6个电子,H2O中每个O原子又与两个H原子形成两个共价键,所以H2O中的O原子最外层有6+2=8个电子,但H2O中的H原子最外层有2个电子;②N2,N原子最外层有 5个电子,N与N之间形成三个共价键,所以N2中的N原子最外层达到8电子稳定结构。 考点二 晶体结构与性质 (一)金刚石、石英、干冰、足球烯、NaCl的晶体结构 1.金刚石和石英 (1)金刚石晶体中,每个C原子与另外4个C原子形成共价键,C—C 键之间的夹角是109.5°,最小的环是六元环。含有1 mol C原子的金刚石中,形成的共价键有 2 mol。 (2)SiO2晶体中,每个Si原子与4个O原子成键,每个O原子与 2个硅原子成键,最小的环是十二元环,在“硅氧”四面体中,处于中心的是Si原子,1 mol SiO2中含有4 mol Si—O键。 (3)在金刚石、SiO2中微粒间的相互作用是共价键。 2.干冰和足球烯 (1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有12个。 (2)在C60中有12个正五边形,20个正六边形,共有60个碳碳单键,30个碳碳双键。 (3)在干冰和足球烯微粒间的相互作用是分子间作用力,在微粒内部存在共价键。 - 20 - 3.NaCl (1)NaCl型:在晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,配位数为6。每个晶胞含4个Na+和4个Cl-。 (2)在NaCl中,Na+、Cl-之间的相互作用是离子键。 (二)晶体类型及性质比较(加试) 晶体类型 离子晶体 分子晶体 原子晶体 金属晶体 构成晶体的粒子 阳离子、阴离子 分子 原子 金属离子、自由电子 组成晶体粒子间的相互作用 离子键 范德华力 (有的存在氢键) 共价键 金属键 典型实例 NaCl 冰(H2O)、干冰(CO2) 金刚石、晶体硅、SiO2、SiC及Si3N4等大多数新型高温结构陶瓷 除汞外的金属及合金 晶体的物理性质 熔、沸点 熔点较高,沸点高 熔、沸点低 熔、沸点高 易导电、易导热,大多数具有较好的延展性,密度、硬度、熔点、沸点等差别较大 导热性 不良 不良 不良 导电性 固态不导电,熔融或溶于水能导电 固体、熔融状态均不导电,部分化合物溶于水能导电 不导电 机械加 工性能 不良 不良 不良 硬度 略硬而脆 硬度低 高硬度 正误判断,正确的打“√”,错误的打“×” - 20 - (1)石英和金刚石都是原子间通过共价键结合形成的原子晶体(√) (2017·浙江11月选考,20B) (2)干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同(×) (2017·浙江4月选考,20A) (3)石英是由硅原子和氧原子构成的原子晶体,加热熔化时需破坏共价键(√) (2016·浙江10月选考,20B) (4)某物质在熔融态能导电,则该物质中一定含有离子键(×) (2016·浙江4月选考,20B) (5)干冰是分子晶体,其溶于水生成碳酸的过程中只需克服分子间作用力(×) (2016·浙江4月选考,20D) 备考导向 学考中对本部分的考查主要涉及晶体类型的判断,化学键类型与晶体类型的关系及晶体的简单特性等。题目比较简单,以选择题的形式考查。 题组一 化学键与晶体类型 1.有以下9种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨AlCl3。 请用上述物质的序号填空: (1)分子晶体__________________________________________________________________。 (2)离子晶体__________________________________________________________________。 (3)不存在化学键的是__________________________________________________________。 (4)只存在极性共价键的是______________________________________________________。 (5)只存在非极性共价键的是____________________________________________________。 (6)既存在非极性共价键又存在极性共价键的是____________________________________。 (7)只存在离子键的是__________________________________________________________。 (8)既存在离子键又存在共价键的是______________________________________________。 答案 (1)①②③④⑨ (2)⑤⑥⑦⑧ (3)① (4)②⑨ (5)③ (6)④ (7)⑤ (8)⑥⑦⑧ 化学键与物质的类别 除稀有气体内部无化学键外,其他物质内部都存在化学键。化学键与物质的类别之间的关系可概括如下: (1)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4 - 20 - 等。 (2)只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。 (3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。 (4)只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。 (5)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。 (6)仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。 (7)金属元素和非金属元素间可能存在共价键,如AlCl3等。 题组二 晶体类型的判断 2.有下列八种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.铝 G.氯化铵 H.金刚石。用字母回答下列问题: (1)直接由原子构成的晶体是________,属于原子晶体的化合物是__________。 (2)由极性分子构成的晶体是________,含有共价键的离子晶体是________,属于分子晶体的单质是________。 (3)在一定条件下能导电而不发生化学变化的是__________________________________。 答案 (1)AEH A (2)B G DE (3)F 3.有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对这三种晶体进行实验,结果如下表: 序号 熔点/℃ 硬度 水溶性 导电性 水溶液与Ag+反应 A 811 较大 易溶 水溶液或熔融导电 白色沉淀 B 3 500 很大 不溶 不导电 不反应 C -114.2 很小 易溶 液态不导电 白色沉淀 (1)晶体的化学式分别为A__________、B_____________________、C____________。 (2)晶体的类型分别是A______________、B___________________、C____________。 (3)晶体中微粒间作用力分别是A_____________________________________________、 B_________________________、C______________________。 答案 (1)NaCl C HCl (2)离子晶体 原子晶体 分子晶体 (3)离子键 共价键 范德华力 解析 根据A、B、C晶体的性质可知,A为离子晶体,只能为NaCl,微粒间的作用力为离子键;B应为原子晶体,只能为金刚石,微粒间的作用力为共价键;C应为分子晶体,且易溶于水,只能为HCl,微粒间的作用力为范德华力。 - 20 - 4.正误判断,正确的打“√”,错误的打“×” (1)NaOH、NH4Cl晶体中既有离子键又有共价键(√) (2)CO2、SiO2的晶体结构类型不同(√) (3)在O2、CO2和SiO2中,都存在共价键,它们均由分子构成(×) (4)KOH和MgCl2都是离子晶体,均存在共价键和离子键(×) (5)金刚石、NaCl、H2O、HCl晶体的熔点依次降低(√) (6)金刚石和足球烯都是通过共用电子对形成空间网状结构,所以都是原子晶体(×) (7)某晶体固态时不导电,水溶液能导电,说明该晶体一定是离子晶体(×) (8)He、CO2和CH4都是由分子构成,它们中都存在共价键(×) 1.依据物质的分类记忆晶体类型 (1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。 (2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。 (3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合物类原子晶体有碳化硅、二氧化硅等。 (4)金属单质是金属晶体。 2.依据晶体性质推断晶体类型 (1)依据晶体的熔点判断 ①离子晶体的熔点较高。 ②原子晶体的熔点很高。 ③分子晶体的熔点低。 ④金属晶体多数熔点高,但也有少数熔点相当低。 (2)依据导电性判断 ①离子晶体溶于水及熔融状态时能导电。 ②原子晶体一般为非导体。 ③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。 ④金属晶体是电的良导体。 (3)依据硬度和机械性能判断 ①离子晶体硬度较大、硬而脆。 ②原子晶体硬度大。 ③分子晶体硬度小且较脆。 ④金属晶体多数硬度较大,但也有较低的,且具有延展性。 - 20 - 注意 (1)常温下为气态或液态的物质,其晶体应属于分子晶体(Hg除外)。 (2)AlCl3晶体中虽含有金属元素,但属于分子晶体,熔、沸点低(熔点190 ℃)。 (3)合金的硬度比其成分金属大,熔、沸点比其成分金属低。 课时训练 1.(2017·湖州市安吉县上墅私立高级中学高三第一次月考)下列关于化学键的叙述正确的是( ) A.化学键既存在于相邻原子之间,也存在于相邻分子之间 B.两个原子之间的相互作用叫化学键 C.化学键通常指的是直接相邻的原子或离子之间的强烈的相互作用 D.离子键是阴、阳离子通过静电引力而形成的化学键 答案 C 2.下列叙述正确的是( ) A.离子晶体中,只存在离子键,不可能存在其他化学键 B.原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 C.NaHSO4、Na2O晶体中的阴、阳离子个数比均为1∶2 D.晶体的熔点:金刚石>食盐>干冰>冰 答案 B 3.(2017·浙江省三门亭旁高级中学高三月考)下列说法中错误的是( ) A.在共价化合物中可能含有离子键 B.非金属元素之间形成的化合物不一定是共价化合物 C.含有共价键的化合物不一定是共价化合物 D.含有离子键的化合物一定是离子化合物 答案 A 4.(2017·杭州市学军中学高三选考模拟)下列有关物质结构的说法正确的是( ) A.有强共价键存在的物质熔、沸点一定很高 B.液氯与水反应破坏了分子间作用力和共价键 C.离子化合物中一定含有离子键,一定不含共价键 D.晶体NH4Cl和Na2O中的化学键类型完全相同 答案 B 5.(2017·湖州市安吉县上墅私立高级中学高三月考)下列各项中表达正确的是( ) A.NH3分子的电子式: - 20 - B.CH4分子的比例模型: C.Cl2的球棍模型: D.N2的结构式:N≡N 答案 D 6.[2017·浙江省高三“超级全能生”3月联考(选考科目)]下列表示不正确的是( ) A.重水的结构式:D—O—D B.二氧化碳的电子式: C.乙烯的结构简式:CH2CH2 D.甲烷比例模型: 答案 C 7.[2017·浙江省高三“超级全能生”3月联考(选考科目)]下列说法正确的是( ) A.二氧化硅与二氧化碳都是共价化合物,且晶体类型相同 B.氧气生成臭氧的过程中有化学键的断裂和生成 C.因为氮气的键能比氧气的键能大,所以氮气的沸点比氧气的高 D.硫与氖晶体均是由单原子构成的分子晶体 答案 B 解析 SiO2中Si与O形成共价键,CO2中C与O形成共价键,所以二者都是共价化合物,但是SiO2形成的是原子晶体,CO2形成分子晶体,A错误;所有化学反应过程都是反应物中化学键断裂后,重新组合生成产物,B正确;N2与O2的晶体都是分子晶体,二者沸点的高低取决于分子间作用力的相对大小,与分子中共价键的键能无关,C错误;硫原子最外层没有达到稳定结构,所以晶体中必然是通过某种形式构成稳定的分子,再通过分子间作用力形成晶体,D错误。 8.(2017·浙江省台州中学高三上学期第四次统练)在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( ) A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键 C.范德华力、共价键、共价键 D.共价键、共价键、共价键 答案 B 解析 石蜡→液体石蜡→石蜡蒸气属于物质的三态变化,是物理变化,破坏的是范德华力。石蜡蒸气→裂化气需要经过裂化,裂化是化学变化,破坏的是共价键,答案选B。 - 20 - 9.(2017·台州市书生中学高一下学期第一次月考)氮化硅是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的微粒间的作用力与氮化硅熔化所克服的作用力都相同的是( ) A.硝酸钾和金刚石 B.晶体硅和水晶 C.冰和干冰 D.氯化钠和蔗糖 答案 B 10.(2017·浙江省桐庐中学高三年级模拟)下列说法正确的是( ) A.CaCl2晶体中存在共价键 B.H2SO4溶于水能电离出H+和SO,所以硫酸是离子化合物 C.SiO2属于原子晶体,熔化破坏共价键和分子间作用力 D.I2是分子晶体,加热升华过程中只需克服分子间作用力 答案 D 11.(2017·浙江省温州中学高三3月高考模拟)下列变化需克服相同类型作用力的是( ) A.碘和干冰的升华 B.硅和C60的熔化 C.氯化氢和氯化钾的溶解 D.溴和汞的汽化 答案 A 12.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是( ) A.电解水 B.干冰受热直接变成气体 C.HCl溶解于水 D.打雷放电时,O2变成O3 答案 B 13.(2017·浙江省温州中学高三3月高考模拟)在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( ) A.CO2 B.PCl3 C.CCl4 D.H2O 答案 D 解析 CO2电子式是 - 20 - ,分子中各原子最外层都达到8电子稳定结构,A错误;PCl3电子式是,分子中各原子最外层都达到8电子稳定结构,B错误;CCl4电子式是,分子中各原子最外层都达到8电子稳定结构,C错误;H2O电子式是,分子中H原子最外层只有2个电子,未达到8电子稳定结构,D正确。 14.(2017·浙江省教育绿色评价联盟高三3月适应性试题)下图分别代表NaCl、金刚石、干冰、石墨结构的一部分。下列说法正确的是( ) A. NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子 B.金刚石中存在的化学键只有共价键,不能导电 C.干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华 D.石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大 答案 B 15.下图为元素周期表的一部分,请回答下列问题。 (1)若①和⑤可以形成原子个数比1∶1的化合物,此时①显________价。①和⑧形成的化合物的电子式为__________。 (2)②和③的最高价含氧酸的酸性强弱顺序________>________(填分子式)。 (3)④和⑦形成的常见化合物晶体类型为________,微粒间通过________形成了该晶体。④和②形成的常见化合物的晶体类型为________,相邻微粒间通过______形成了该晶体。 (4)⑥为材料的容器可以装运浓硫酸或浓硝酸的理由是___________________________。 答案 (1)-1 (2)HNO3 H2CO3 (3)原子晶体 共价键 分子晶体 分子间作用力 (4)常温下,Al在浓硫酸或浓硝酸中钝化,可以阻止反应进一步进行 解析 根据元素在周期表中的位置可以推断①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。 16.(2017·台州市书生中学高三月考) - 20 - A、B、C、D、E、F六种短周期元素,它们的质子数依次递增。A元素原子核外只有1个电子;B元素原子和C元素原子最外层电子数之差为2;B元素原子L层上的电子数为K层电子数的2倍;B、C、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色;0.5 mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移;F与C 同主族。 (1)写出指定元素的名称:B________,D________。 (2)BC2的电子式为________,D2C2的电子式为________,BA4的结构式为________, BA4的空间构型________________________________________________________。 (3)E单质与D元素最高价氧化物对应水化物反应的离子方程式:_______________。 (4)写出B的最高价氧化物与D2C2反应的化学方程式:____________________。 (5)写出两种均含有A、C、D、F四种元素的化合物相互作用逸出气体的离子方程式: ________________________________________________________________________。 答案 (1)碳 钠 (2) 正四面体型 (3)2Al+2H2O+2OH-===2AlO+3H2↑ (4)2CO2+2Na2O2===2Na2CO3+O2 (5)H++HSO===H2O+SO2↑ 解析 根据元素信息可以判断A为H,B为C,C为O,D为Na,F为S,1 mol E失去电子的物质的量为=3 mol,所以E为Al。 - 20 -查看更多