- 2021-05-13 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考全国卷化学
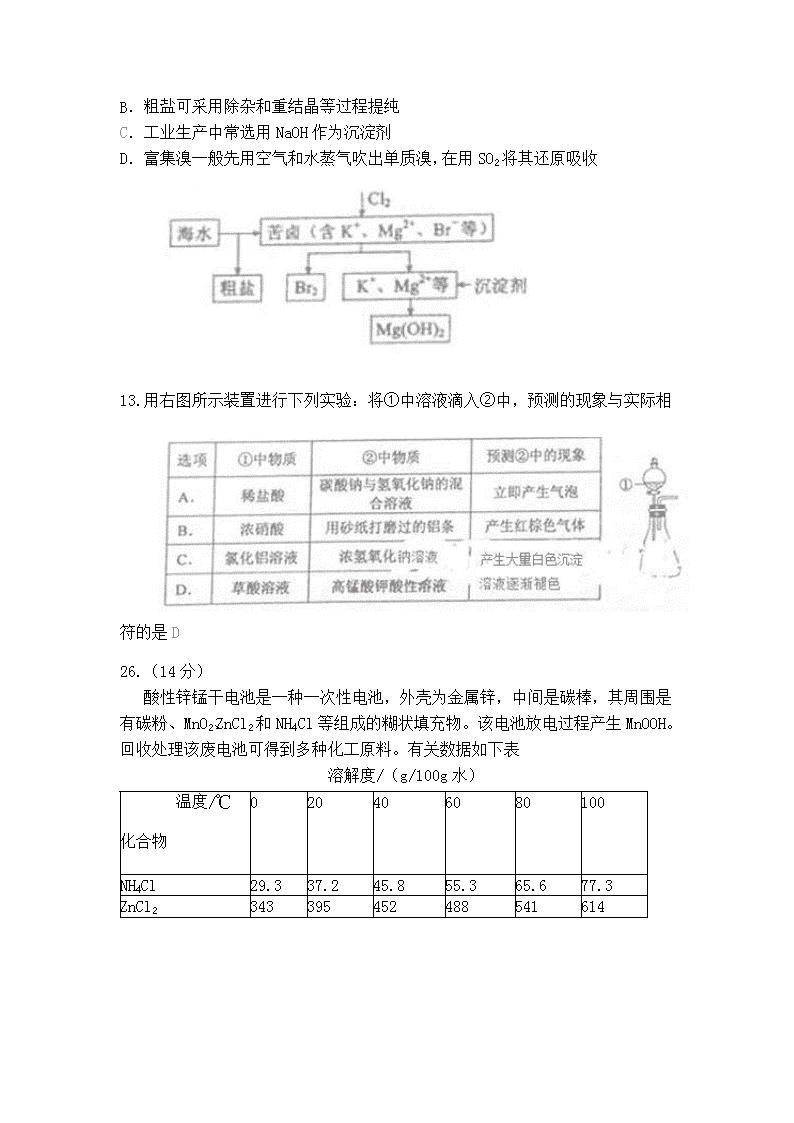
2015高考——理综化学(新课标Ⅱ卷) 可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 AI 27 P 31 S 32 CL 35.5 Ca 40 Fe 56 Zn 65 Br 80 一、 选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的 7.食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是 A.硅胶可用作食品干燥剂 B.P2O5不可用作食品干燥剂 C.六水氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 8.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为 A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5 9.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是 A.元素的非金属性次序为c>b>a B. a和其他3种元素均能形成共价化合物 C. d和其他3种元素均能形成离子化合物 D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 10. NA代表阿伏加德罗常熟的值。下列叙述正确的是 A.60g丙醇中存在的共价键总数为10NA B.1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA C.钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA D.235g核素发生裂变反应:+++10,净产生的中子()数为10NA 11.分子式为C5H10O2并能饱和NaHCO3,溶液反应放出气体的有机物有(不含立体结构) A.3种 B.4种 C.5种 D.6种 12. 海水开发利用的部分过程如图所示。下列说法错误的是 A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 13.用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是D 26.(14分) 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表 溶解度/(g/100g水) 温度/℃ 化合物 0 20 40 60 80 100 NH4Cl 29.3 37.2 45.8 55.3 65.6 77.3 ZnCl2 343 395 452 488 541 614 化合物 Zn(OH)2 Fe(OH)2 Fe(OH)3 Ksp近似值 10-17 10-17 10-39 回答下列问题: (1)该电池的正极反应式为________,电池反应的离子方程式为________。 (2)维持电流强度为0.5A,电池工作5分钟,理论上消耗锌________g。(已知F=96500C﹒mol-1) (3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过_____分离回收;滤渣的主要成分是MnO2、_______和_______,欲从中得到较纯的MnO2,最简便的方法为_________,其原理是_________。 (4)用废电池的锌皮制备ZnSO4﹒7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2溶解,铁变为______,加碱调节至pH为_______时,铁刚好沉淀完全(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。 27.(14分) 甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)CH3OH(g) △H1 ②CO2(g)+3H2(g)CH3OH(g) +H2O △H2 ③CO2(g)+H2(g)CH3OH(g)+ CO △H3 回答下列问题: (1) 已知反应①中相关的化学键键能数据如下: 化学键 H-H C-O C=O H-O C-H E/(kJ/mol) 436 343 1075 405 413 由此计算△H1= kJ/mol,已知△H2=-58kJ/mol ,则△H3= kJ/mol。(2)反应①的化学平衡常数K表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为__________(填曲线标记字母),其判断理由是_________。 (3)组成n(H2/n(CO+CO2)=2.60时,体系中的CO平衡转化率(a)温度和压强的关系如图2所示。a(CO)值随温度升高而______(填“增大”或“缩小”)其原因是_____;图2中的压强由大到小为_____,其判断理由是_____。 28.(15分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题: (1)工业上可用KClO3与NaSO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为_____。 (2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸铜)为原料,通过以下过程制备ClO2: ①电解时发生反应的化学方程式为_____。 ②溶液X中大量存在的阴离子有_____。 ③除去中ClO2的NH3可选用的试剂是_____(填标号)。 a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水 (3)用下图装置可以测定混合气中ClO2的含量: I.在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸; II.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口; III.将一定量的混合气体通入锥形瓶中吸收; IV.将玻璃液封装置中的水倒入锥形瓶中; V.用0.1000mol.L- 硫代酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O42- ),指示剂显示终点时共用去20.00mL硫代酸钠溶液。在此过程中: ① 锥形瓶内ClO2与碘化钾反应的离子方程式为 __________。 ② 玻璃液封装置的作用是_________。 ③ V中加入的指示剂通常为______,滴定至终点的现象是______。 ④ 测定混合器中ClO2的质量为______g (4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是________(填标号) a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁 NH4Cl 29.3 37.2 45.8 55.3 65.6 77.3 ZnCl2 343 395 452 488 541 614 36.[化学——选修2:化学与技术](15分) 苯酚和丙酮都是重要的化工原料,工业上课用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下: 回答下列问题: (1)在反应器A中通入的X是 。 (2)反应①和②分别在装置 和 中进行(填装置符号)。 (3)分解在C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 。 (4)反应2为 (填“放热”或“吸热”)反应。反应温度应控制在50~600 C,温度过高的安全隐患是 。 (5)中和釜D中加入的Z最适宜的是 (填序号,已知苯酚是一种弱酸) a.NaOH b.CaCO3 c.NaHCO3 d.CaO (6)蒸馏塔F中的馏出物T和P分别是 和 ,判断的依据是 。 (7)用该方法合成苯酚和丙酮的优点是 。 37.[化学-----选修3:物质结构与性质](15分) A、B、C、D为原子序数依次增大的四种元素,A2-和B+ 具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题: (1)四种元素中电负性最大的是 (填元素符号),其中C院子的核外电子排布式为 。 (2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ; A和B的氢化物所属的晶体类型分别是 和 。 (3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 ,中心原子的杂化轨道类型为 。 (4)化合物D2A的立体构型为 ,中心原子的的价层电子奇数为 ,单质D与湿润的Na2Co3反应可制成D2A,其化学方程式为 。 (5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm.F的化学式为 ;晶胞中A原子d的配位数为 ;列式计算晶体F的密度(g.cm-3) 38.[化学—选修5:有机化学基础](15分) 聚戊二酸丙二醇(PPG)是一种可降解的聚脂类高分子材料,在材料的生物相容性方面有限好的应用前景。PPG的一种合成路线如下: 已知; ① 烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢 化合物B为单氯代烃;化合物C的分子式为C5H8 ① E、F为相对分子质量差14的同系物,F是福尔马琳的溶质 稀NaOH ② R1CHO+R2CH2CHO 回答下列问题: (1)A的结构简式为 。 (2)由B生成C的化学方程式为 。 (3)由E和F生成G的反应类型为 ,G的化学名称为 。 (4)①由D和H生成PPG的化学方程式为 ; ②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。 a.48 b.58 c.75 d.102 (5)D的同分异构体重能同事满足下列条件的共有 种(不含立体异构); ①能与饱和NaHCO3溶液反应产生液体 ②既能发生银镜反应,又能发生皂化反应其中核磁共振请谱显示为3组峰,且峰面积比为6:1:1的是有 (写结构简式) D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有 (填标号)。 a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪 答案: 一、 选择题 题号 7 8 9 10 11 12 13 答案 C A B C B C D 一、 必考题 三、选考题查看更多