- 2021-05-13 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学复习专题溶液复习学案无答案
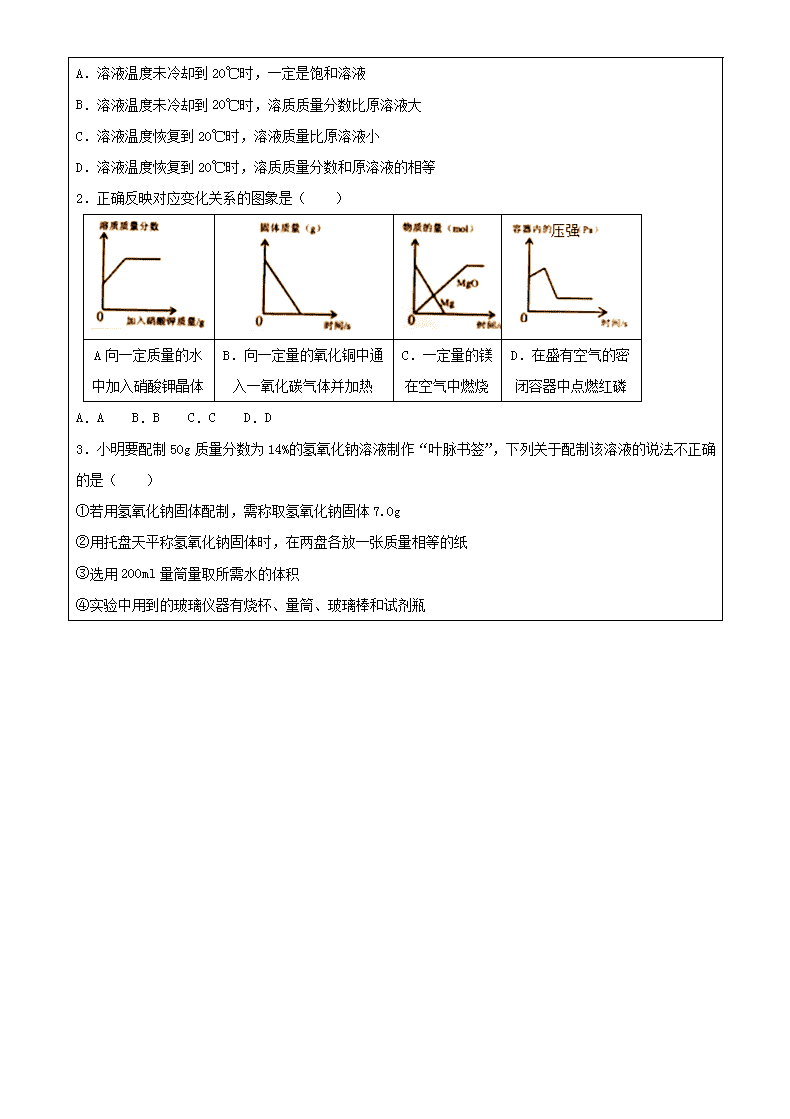
溶液 教学内容 溶液 教 学 重、难点 1溶液的形成 2溶解度 3溶液的浓度 一、 作业检查及点评 二、 知识点总结 一、 溶液 1、定义: 一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。 溶质:被溶解的物质叫溶质。可以是固体,液体,气体。 溶剂:能溶解其他物质的物质叫溶剂。水是最常用的溶剂,常见的还有汽油,酒精 2、溶液的特征 均一性:指溶液形成以后,溶液里各部分的组成、性质完全相同。如溶液中各部分的浓度,安度,颜色等完全一样。 稳定性:指外界条件不变时溶液长期旋转,溶质不会从溶液里分离出来。 3、溶液中溶质和溶剂的判定 l 当固体、气体溶于液体时,固体、气体做溶质,液体做溶剂 l 当两种液体互相溶解时,量多的叫溶剂,量少的叫溶质。但当其中一种液体是水时,不管水量多与少,一般把水叫做溶剂。 l 通常不指明溶剂的溶液,一般是水溶液 4、 浊液(悬浊液和乳浊液) 小液滴分散在水中形成的不均一、不稳定的混合物叫乳浊液 液体中悬浮着很多不溶于水的固体小颗粒,是液体呈现浑浊状态叫悬浊液 5、 溶解过程中的热现象 1溶解过程放热的主要物质:NaOH, H2SO4、 CaO 2溶解过程吸热的主要物质:铵盐 二、溶解度 1、饱和溶液和不饱和溶液 1、饱和溶液:在一定温度下,向一定量的溶剂里加入某种溶质,当溶质不能再溶解时所得到的溶液,是该溶质的饱和溶液。 2、不饱和溶液:在一定温度下,向一定量的溶剂里加入某种溶质,还能继续溶解的溶液,叫做该溶质的不饱和溶液。 2、饱和溶液和不饱和溶液的相互转化 饱和溶液→不饱和溶液:加入溶剂;升高温度 不饱和溶液→饱和溶液:增加溶质;降低温度;蒸发溶剂 3、固体物质的溶解度 1、定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。 2、影响固体物质溶解度的因素 内部因素:溶质和溶剂本身的性质。 外部因素:温度 4、溶解度曲线 表示的意义: l 某物质在不同温度下的溶解度或溶解度随温度变化的情况 l 每一个点表示该溶质在某温度下的溶解度,溶液必然是饱和溶液 l 在溶解度曲线下方的点,表示溶液是不饱和溶液;在溶解度曲线上方的点,表示溶液是过饱和溶液。 l 大多数固体物质的溶解度随温度升高而增大,随温度升高溶解度变化大的在曲线上表现为坡度较陡,而随温度升高溶解度变化小的在曲线上表现为坡度平缓 l Ca(OH)2的溶解度随温度的升高而降低 5、气体的溶解度 1、定义:压强为101kPa和一定温度时,气体溶解在1体积的水里达到饱和状态时的气体体积。 2、影响气体溶解度的因素: l 温度:在压强不变的条件下,温度越高,气体溶解度越小 l 压强:在温度不变的条件下,压强越大,气体溶解度越大。 6、结晶 1、定义:热的溶液冷却后,已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做结晶。析出晶体后的溶液叫线液,母液对于析出的溶质来说是饱和溶液。 2、结晶的方法: l 蒸发结晶:适用于固体溶解度爱温度影响不大的物质 l 除温结晶:适用于溶解度受温度影响变化较大的固体物质。 三、溶质的质量分数 1、定义:溶质质量与溶液质量之比 2、计算公式:溶质的质量分数=(溶质的质量/溶液的质量)*100% 3、溶液稀释的计算:稀释前后溶质的质量不变 4、溶液增浓的问题: l 向原溶液中添加溶质 l 将原溶液蒸发掉部分溶剂 l 与浓溶液混合 5、配制一定质量的溶质质量分数的溶液 a、计算 b、称量或量取 c、溶解 d、装瓶 三、练习巩固 一.选择题(共18小题) 1.向20℃的饱和澄清石灰水中投入适量的氧化钙粉末,充分反应,下列说法错误的是( ) A.溶液温度未冷却到20℃时,一定是饱和溶液 B.溶液温度未冷却到20℃时,溶质质量分数比原溶液大 C.溶液温度恢复到20℃时,溶液质量比原溶液小 D.溶液温度恢复到20℃时,溶质质量分数和原溶液的相等 2.正确反映对应变化关系的图象是( ) A向一定质量的水中加入硝酸钾晶体 B.向一定量的氧化铜中通入一氧化碳气体并加热 C.一定量的镁在空气中燃烧 D.在盛有空气的密闭容器中点燃红磷 A.A B.B C.C D.D 3.小明要配制50g质量分数为14%的氢氧化钠溶液制作“叶脉书签”,下列关于配制该溶液的说法不正确的是( ) ①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0g ②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸 ③选用200ml量筒量取所需水的体积 ④实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和试剂瓶 ⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小. A.①③ B.②③⑤ C.③⑤ D.②④⑤ 4.下列说法正确的是( ) A.凡是均一的、稳定的液体一定是溶液 B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污 C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液 D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5% 5.如上图表示A、B两种物质的溶解度(s)随温度(t)的变化情况,下列说法正确的是( ) A.A的溶解度大于B的溶解度 B.升高温度可使A的不饱和溶液变为饱和 C.t3℃时,在100g水中溶解60gA能形成饱和溶液 D.t2℃时,A和B的饱和溶液的溶质质量分数相等 6.如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( ) A.从N→M:先向N中加入适量固体A再降温到t2 B.从N→M:先将N降温到t1再加入适量固体A C.从M→N:先将M降温到t1再将其升温 D.从M→N:先将M升温到t3再加入适量的水 7.甲、乙、丙三种物质的溶解度曲线如图所示,下列有关认识错误的是( ) A.A点的含义是40℃时甲和乙的溶解度相同 B.将甲、乙、丙三种物质的饱和溶液降温时都有晶体析出 C.50℃时,与乙的饱和溶液具有相同质量分数的甲溶液属于饱和溶液 D.可通过降低温度结晶的方法把甲物质中少量的丙物质除去 8.科学研究中常用图象来表示两个量(x,y)之间的关系,以使研究的间压变得直观明了.在某温度下.将少量氧化钙加入到一定量的饱和氢氧化钙溶液中.图甲表示整个过程中温度的变化,图乙表示氢氧化钙的溶解度与温度的关系.小阳同学要依据观察和思考,作出了如图丙所示的图象,此图象反映了该过程中( ) A.溶质的质量与时间的关系 B.溶剂的质量与时间的关系 C.溶质的溶解度与时间的关系 D.溶质的质量分数与时间的关系 9. 将一定质量的生石灰加到一定质量饱和氢氧化钙溶液中,从开始到反应结束的过程中,温度先升高到最高温度后又恢复到原来温度,则下列关于溶液的分析错误的是( ) A B C D 10.如图是三种固体物质a、b、c的溶解度曲线,则以下说法不正确的是( ) A.t1℃时三种物质溶解度的大小为b>a=c B.将t2℃时a的饱和溶液150g降温到t1℃时,析出溶质30g C.t2℃时,将1g a物质加入到2g水中不断搅拌,能形成3g不饱和溶液 D.要从含有少量c的a溶液中得到较多的a晶体,通常采用降温结晶的方法 11.A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中正确的是( ) A.t1℃时,A的饱和溶液65 g中含有溶剂50 g B.将C的不饱和溶液转变为饱和溶液可采用降温的方法 C.在t2℃,A、B两种溶液中溶质的质量分数相同 D.要从B溶液中得到B,通常可采用降温结晶的方法 12.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,下列推理结果正确的是( ) A.将t1℃时a、b、c三种物质的饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是a>b>c B.t2℃时,将15ga物质加入到25g水中充分溶解,所形成溶液的质量是40g;溶液是饱和的 C.从溶解度曲线上看出a物质在水中的溶解能力最强 D.将t1℃时三种物质的饱和溶液升温至t2℃,有晶体析出的是C物质 13.向如图所示的试管里的水中加入某物质后,原来U形管内两臂在同一水平面上红墨水,右边液面降低了些,左边的液面上升了些.则加入的物质是( ) A.生石灰 B.苛性钠 C.氯化钠 D.硝酸铵 14.如图为a、b、c三种固体物质(不含结晶水)的溶解度曲线.下列说法错误的是 ( ) A.t1℃时,a和c两种物质的饱和溶液溶质的质量分数相等 B.t2℃时,取三种物质各20 g分别放入100g水中充分溶解,只有c物质能形成饱和溶液 C.将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,a溶液中析出的晶体质量最大 D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,此时所得溶液溶质的质量分数是b>a=c 15.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中(如图),欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( ) A. 生石灰 B.氯化钠 C.硝酸铵 D.氢氧化钠 16.将相同质量的NaOH固体和NH4NO3 固体,分别同时放入2个装有100mL水的烧杯中,用仪器测出溶液温度随时间变化情况,则下列“温度一时间”曲线正确的是( ) A. B. C. D. 17.甲、乙两种固体的溶解度曲线如图.现将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里,则下列说法正确的是( ) A.甲溶液中溶质的质量分数增大 B.乙溶液中剩余的固体减少 C.试管里甲、乙物质的溶解度都增大 D.试管里甲、乙两溶液中的溶质都减少 18.现有氯化钠溶液140克,当蒸发掉20克水或向原溶液中加入4克氯化钠,均可得到质量分数相同的氯化钠溶液,则原溶液中含氯化钠的质量是( ) A.30克 B.24克 C.20克 D.16克 二.填空题 19.t℃时,分别向盛有40mL水的烧杯中加入等质量的甲、乙两种可溶性的固体物质,使其充分溶解,可观察到如图Ⅰ所示的现象. (1)t℃时, (填“A”或“B”)烧杯中的溶液一定是饱和溶液;两溶液中甲溶质质量分数 乙溶质质量分数(填“大于”“小于”或“等于”). (2)图Ⅱ中可表示甲物质的溶解度曲线的是 (填“a”或“b”).要使A烧杯中剩余的固体继续溶解可用 或 的方法. 20.在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化. (1)室温时, (选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液. (2)图2中能表示乙物质的溶解度曲线的是 (填“a”、“b”或“c”,下同), (3)t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中水的质量由大到小的顺序是 (4)小强同学要在实验室配制15%的氯化钠溶液50g.需要氯化钠的质量为 克,该同学按下图所示步骤依次操作: 其中操作错误的步骤是 (填字母);E中玻璃棒的作用是 .若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 克. 21.如图为A、B、C 三种固体物质的溶解度曲线. (1)在某一温度时,A、B两饱和溶液的溶质质量分数相等,此时为 ℃. (2)在t3℃时,10g水最多能溶解3g B物质,则10g水最多能溶解A物质的质量 3g(填“>”、“≤”或“=”). (3)三种物质的溶解度关系为B>A>C时的温度为 t℃,则t℃的取值范围是 . (4)将A、B、C饱和溶液从t3℃降温到t1℃时,溶质质量分数保持不变的是 . 22.(1)汽油与酒精分别加入蒸馏水中,能形成溶液的是 . (2)如右上图是a、b两种固体物质的溶解度曲线. ①10℃时,a、b两物质的溶解度由大到小的顺序为 . ②若要使a物质从它的饱和溶液中大量析出,最适宜的方法是 (填“冷却”或“蒸发”)结晶. ③t℃时,将a、b两物质的饱和溶液均升温至40℃(a、b不分解,水分未蒸发),两种溶液中溶质的质量分数:A b(选填“>”“<”或“=”). 23.图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线.在t1℃时,将质量为a g的A、B、C三种物质分别加入100g水中,根据图示回答下列问题: (1)三种物质中,随温度升高溶解度减小的物质是 ; (2)t1℃时,所得三种物质的溶液中为不饱溶液的是 ; (3)若使这三种溶液溶质的质量分数相等,则温度应由t1℃升至 ℃; (4)若将温度由t1℃升至t4℃时,三种溶液中溶质质量分数的大小关系为 . 24.如图是A、B、C三种物质在水中的溶解度曲线,根据图回答: (1)在10℃至20℃之间,三种物质的溶解度大小顺序是: . (2)N点是30℃A物质的 溶液,M点的意义: ,该温度下30克B的饱和溶液中含B物质 克; (3)若要从A中含少量B的混合物中分离出A,则可采用 的方法进行; (4)10℃时,三种物质的饱和溶液升温至30℃有晶体析出的是 ; (5) 除以上内容,根据此图你还能获得的信息有: . 25.海水晒盐后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含有多种成分,在食品、化工等方面有重要应用.请根据已知信息回答下列问题. (1)如图是苦卤中有关物质的溶解度曲线,已知t1℃时,氯化镁和氯化钾的溶解度分别为M、N,则它们溶解度大小的关系为 :将苦卤加热到t2℃以上,根据溶解度曲线,首先析出的晶体应是 . (2)化工厂利用苦卤制取生产镁的原料﹣﹣无水氯化镁的生产流程如图: ①在苦卤中加入试剂a可以选用 ,要将氢氧化镁沉淀分离出来,应该采用的方法是 .验证苦卤中氯化镁已完全转化为氢氧化镁沉淀的方法是 . ②试剂b可以选用 (填溶质化学式),该步反应的化学方程式为 ,该反应的基本反应类型是 反应.查看更多