- 2021-05-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2015年大连市中考化学试题及答案
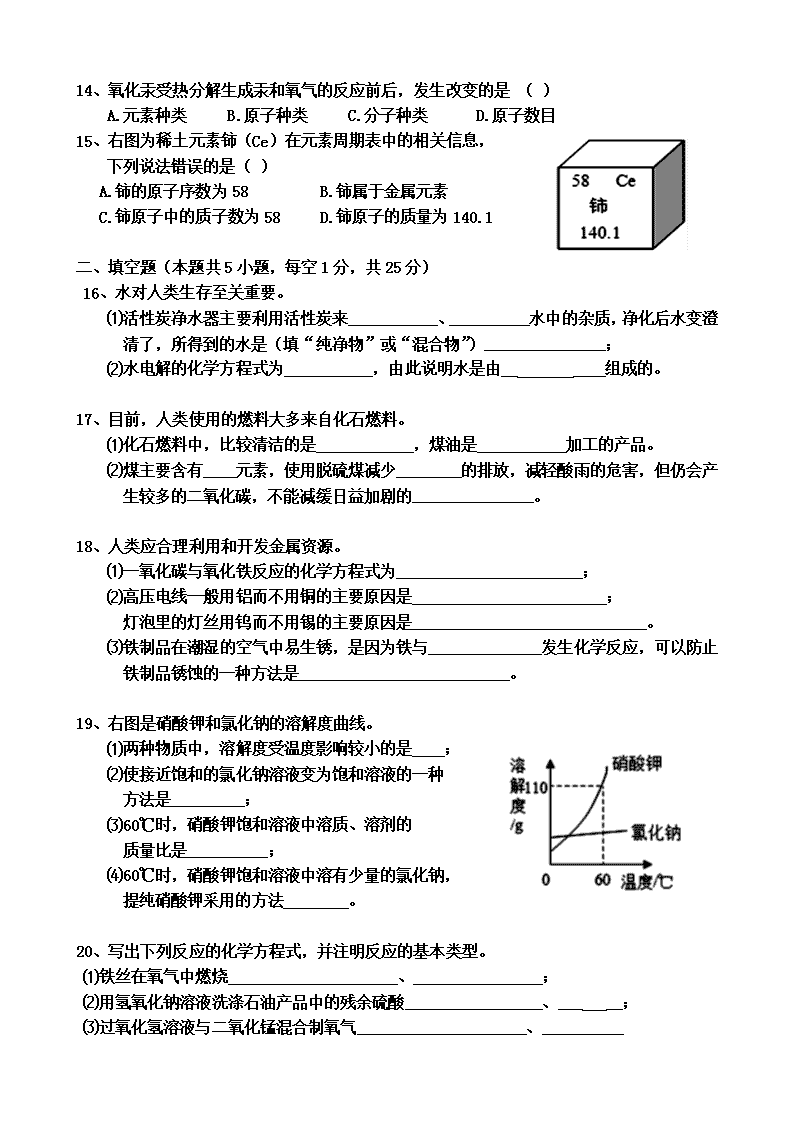
2015年大连市中考化学试题 相对原子质量:C —12 O— 16 Cu —64 一、选择题(本题共15小题,每小题1分,共15分。每小题只有一个选项符合题意) 1、下列变化中,属于化学变化的是 ( ) A.铁铸成锅 B.瓷碗破碎 C.粮食酿醋 D.石蜡熔化 2、空气中含量较多,可用作焊接金属保护气的是 ( ) A.氮气 B.氧气 C.二氧化碳 D.稀有气体 3、人体缺少某种元素易产生龋齿,该元素是 ( ) A.Fe B.F C.Zn D.I 4、下列化肥中,属于磷肥的是 ( ) A.CO(NH2)2 B.NH4HCO3 C.KNO3 D.Ca3(PO4)2 5、下列纺织材料中,属于合成纤维的是 ( ) A.棉花 B.腈纶 C.羊毛 D.蚕丝 6、利用下列物质清洗油污时,发生乳化现象的是 ( ) A.汽油 B.洗涤剂 C.纯碱溶液 D.烧碱溶液 7、下列食物中,富含蛋白质的是 ( ) A.鸡肉 B.米饭 C.黄瓜 D.豆油 8、下列物质中,氯元素的化合价为+5价的是 ( ) A.HCl B.Cl2 C.KClO3 D.Cl2O7 9、下列物质中,属于化合物的是 ( ) A.硫酸锌 B.生理盐水 C.黄铜 D.红磷 10、下列物质中,属于氧化物的是 ( ) A.O2 B.Cu(OH)2 C.CaO D.NH4NO3 11、下表是部分食物的pH,有关说法错误的是 ( ) 苹果汁 葡萄汁 牛奶 蛋清 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0 A.苹果汁和葡萄汁显酸性 B.牛奶和鸡蛋清显碱性 C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少喝苹果汁 12、下列微粒结构示意图中,表示阳离子的是 ( ) D C B A 13、下列关于物质用途的叙述,错误的是 ( ) A.碳酸钙用作补钙剂 B.二氧化碳用于制碳酸型饮料 C.碳酸氢钠用于焙制糕点 D.氢氧化钠用于干燥二氧化碳气体 14、氧化汞受热分解生成汞和氧气的反应前后,发生改变的是 ( ) A.元素种类 B.原子种类 C.分子种类 D.原子数目 15、右图为稀土元素铈(Ce)在元素周期表中的相关信息, 下列说法错误的是( ) A.铈的原子序数为58 B.铈属于金属元素 C.铈原子中的质子数为58 D.铈原子的质量为140.1 二、填空题(本题共5小题,每空1分,共25分) 16、水对人类生存至关重要。 ⑴活性炭净水器主要利用活性炭来___________、__________水中的杂质,净化后水变澄清了,所得到的水是(填“纯净物”或“混合物”)_______________; ⑵水电解的化学方程式为___________,由此说明水是由__ ____组成的。 17、目前,人类使用的燃料大多来自化石燃料。 ⑴化石燃料中,比较清洁的是____________,煤油是___________加工的产品。 ⑵煤主要含有____元素,使用脱硫煤减少________的排放,减轻酸雨的危害,但仍会产生较多的二氧化碳,不能减缓日益加剧的_______________。 18、人类应合理利用和开发金属资源。 ⑴一氧化碳与氧化铁反应的化学方程式为_______________________; ⑵高压电线一般用铝而不用铜的主要原因是________________________; 灯泡里的灯丝用钨而不用锡的主要原因是_____________________________。 ⑶铁制品在潮湿的空气中易生锈,是因为铁与______________发生化学反应,可以防止铁制品锈蚀的一种方法是__________________________。 19、右图是硝酸钾和氯化钠的溶解度曲线。 ⑴两种物质中,溶解度受温度影响较小的是____; ⑵使接近饱和的氯化钠溶液变为饱和溶液的一种 方法是_________; ⑶60℃时,硝酸钾饱和溶液中溶质、溶剂的 质量比是__________; ⑷60℃时,硝酸钾饱和溶液中溶有少量的氯化钠, 提纯硝酸钾采用的方法________。 20、写出下列反应的化学方程式,并注明反应的基本类型。 ⑴铁丝在氧气中燃烧_____________________、________________; ⑵用氢氧化钠溶液洗涤石油产品中的残余硫酸_________________、___ __; ⑶过氧化氢溶液与二氧化锰混合制氧气_____________________、__________ 三、简答题(本题共5小题,共24分) 21、(4分)用坩埚钳夹住一团棉花,蘸上酒精后点燃,观察到:开始时酒精蒸气燃烧,棉花未燃烧;当酒精快燃尽时,棉花开始燃烧。分析出现以上现象的原因。 22、(3分)将柠檬(一种水果)切片,放入冰箱冷冻后,取出一部分放入真空冷冻环境中,留在冰箱中的柠檬片,时间久了会失去部分水分;真空冷冻环境中的柠檬片,在短时间内会变成干燥的柠檬片。用微粒的观点解释。 ⑴为什么冷冻后的柠檬片还会失去水分? ⑵为什么真空冷冻环境中的柠檬片,在短时间内就会变干燥? 23、(6分)在实验室常用以下装置制取气体。 ⑴用高锰酸钾制氧气的化学方程式为______________; 发生装置应选_______ (填字母,下同)。 ⑵用装置B制二氧化碳的化学方程式为_______________________,长颈漏斗末端应位于液面下的目的是_________ ____________;收集装置应选__________,依据二氧化碳_______ _____。 24、(5分)某合金由铝、铁、铜三种金属组成。现要测定一定质量该合金中铝的质量,设计以下流程并实验。 ⑴通过以上实验也可验证三种金属的活动性顺序,写出判断依据; ⑵为什么要向合金粉末中加入适量的稀硫酸? ⑶为达实验目的,需要称量上述流程中哪些物质的质量?如何确定铝的质量? 25、(6分)碳酸钠与盐酸的反应是分两步进行的,第一步反应的化学方程式为: Na2CO3 + HCl = NaCl + NaHCO3,为验证该反应分两步进行,如图所示进行 实验(装置气密性良好)。 步骤Ⅰ:用注射器1向小药瓶中缓慢注入一定量的稀盐酸,边注入变振荡,细玻璃管中液柱略微升高;换注射器2从瓶中缓慢抽取气体,澄清石灰水不浑浊。 步骤2:…… ⑴补充步骤Ⅱ的实验操作和预期现象。 ⑵说明细玻璃管在实验中的作用。 ⑶实验后,将小药瓶、注射器1、注射器2中的所有物质依次倒入一个洁净的烧杯中,只得到无色溶液,向其中滴加酚酞溶液不变色。写出溶液中溶质成分存在的几种情况(酚酞省略不写)。 四、计算题(本题6分) 26、碳和氧化铜反应生成铜和二氧化碳。现有碳和氧化铜的混合物20g,其中氧元素的质量分数为18%。高温加热该混合物一段时间后,产生4.4g二氧化碳, 计算: ⑴参加反应的氧化铜质量; ⑵剩余固体中氧元素的质量分数。(计算结果保留到0.1%) 2015中考化学参考答案及评分标准 一、选择题 1~5 CABDB 6~10 BACAC 11~15 BADCD 二、填空题 (每空一分,方程式错一处0.5分,共1分,扣完为止) 16.⑴吸附、过滤,混合物 ⑵2H2O 通电 2H2↑+ O2 ↑,氢、氧元素 17.⑴天然气,石油 ⑵碳,二氧化硫,全球变暖或温室效应 18. ⑴Fe2O3+3CO高温2Fe+3CO2 ⑵①铝的密度比铜小②钨的熔点比锡高 ⑶氧气和水,保持干燥等合理答案, 19.⑴氯化钠 ⑵加氯化钠或蒸发水分 ⑶11:10或110:100 (4)降温结晶/冷却结晶 20.⑴3Fe + 2O2 点燃Fe3O4 ,化合反应 ⑵ H2SO4 + 2NaOH ==== Na2SO4 + 2H2O ,复分解反应 ⑶ 2H2O2 MnO2 2H2↑+ O2 ↑,分解反应 21.点燃时,酒精遇热蒸发,且温度达到其着火点,酒精蒸气燃烧(1分),酒精蒸气笼罩着棉花,棉花因未与氧气充分接触而不能燃烧(1分),酒精燃烧放热,部分热量用于酒精蒸发,部分热量传递给棉花,使其温度逐渐达到着火点以上(1分),当酒精快燃尽时,达到着火点的棉花与氧气接触开始燃烧(1分)。 22.⑴冰由水分子构成,水分子不断运动,会从柠檬片中逸出。 ⑵真空冷冻环境中,因压强减小,水分子间的间隔骤然变大(1分),水分子运动加速并扩散,所以短时间柠檬片会变干(1分) 23.⑴①2KMnO4 △ K2MnO4 + MnO2 + O2↑,② A ⑵① CaCO3+2HCl==CaCl2+H2O+CO2↑ ②防止气体从长颈漏斗下端逸出 ③ C ④密度比空气大 24.⑴铝、铁能与稀硫酸反应,铜不能;铝能将铁从硫酸亚铁溶液中置换出来,证明三种金属的活泼性顺序是铝>铁>铜(1分) ⑵加入适量的稀硫酸可将合金中的铝、铁恰好溶解,既能测量出铜的质量(1分),还能保证步骤②中所加铝粉只与硫酸亚铁反应,既而确定铁的质量(1分) ⑶称量步骤①中的铜的质量、步骤②中加入铝粉的质量(假设为a)和铁铝混合物的质量(假设为b),根据铝与硫酸亚铁反应的化学方程式,求出铁的质量(设铁为x,剩余的铝为b-x,参加反应的铝为a-(b-x),二者有比例关系,此处求解过程可不回答),因混合物质量已知,铜和铁已测出,则铝的质量可知 25.⑴换注射器1向小药瓶中继续注入稀盐酸,至较多气泡产生,细玻璃管中液柱明显升高(1分),换注射器2从瓶中缓慢抽取气体,澄清石灰水变浑浊(1分), ⑵调节小药瓶内的气压,防止瓶内气压过大时瓶塞弹出(1分),显示小药瓶内、外的压强差,帮助判断瓶中是否有气体生成(1分) ⑶氯化钠、氯化钙(1分);氯化钠、氯化钙、氯化氢(1分) 26.⑴设:参加反应的氧化铜的质量为x C+ 2CuO 高温 2Cu + CO2↑(1分) 160 44 X 4.4g 160/x=44/4.4g (1分) x=16g(1分) ⑵剩余固体的质量:20g-4.4g=15.6g (1分) 剩余固体中氧元素质量:20g×18%-16g ×16/80=0.4g(1分) (或20g×18%-4.4g ×32/44=0.4g) 剩余固体中氧元素质量分数: 0.4g/15.6g×100%=2.6%(1分) 答:参加反应的氧化铜质量为16g;剩余固体中氧元素的质量分数2.6%。查看更多