- 2021-05-13 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020(通用版)中考化学重难点易错点复习讲练巧学离子的形成与符号书写(含解析)
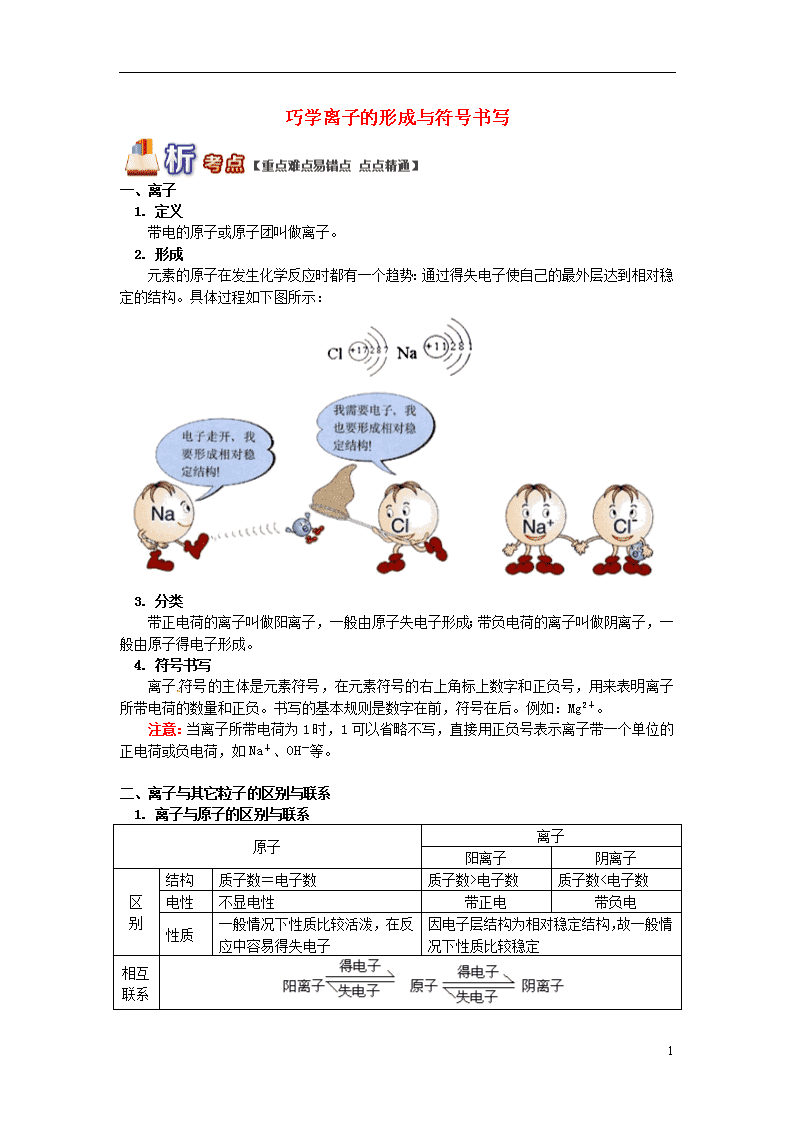
巧学离子的形成与符号书写 一、离子 1. 定义 带电的原子或原子团叫做离子。 2. 形成 元素的原子在发生化学反应时都有一个趋势:通过得失电子使自己的最外层达到相对稳定的结构。具体过程如下图所示: 3. 分类 带正电荷的离子叫做阳离子,一般由原子失电子形成;带负电荷的离子叫做阴离子,一般由原子得电子形成。 4. 符号书写 离子符号的主体是元素符号,在元素符号的右上角标上数字和正负号,用来表明离子所带电荷的数量和正负。书写的基本规则是数字在前,符号在后。例如:Mg2+。 注意:当离子所带电荷为1时,1可以省略不写,直接用正负号表示离子带一个单位的正电荷或负电荷,如Na+、OH-等。 二、离子与其它粒子的区别与联系 1. 离子与原子的区别与联系 原子 离子 阳离子 阴离子 区 别 结构 质子数=电子数 质子数>电子数 质子数<电子数 电性 不显电性 带正电 带负电 性质 一般情况下性质比较活泼,在反应中容易得失电子 因电子层结构为相对稳定结构,故一般情况下性质比较稳定 相互联系 7 2. 注意粒子与离子的区别 (1)粒子并不等同于离子,粒子的范围更广泛,包括分子、原子、离子等,则离子只是粒子的一部分。 (2)原子变成离子时,由于最外层电子数发生了变化,所以化学性质也发生了改变。 (3)具有稳定结构的粒子并不一定是离子,所以具有相同的电子层结构的粒子也并不一定是同一种粒子。 例如:和,它们的核外电子排布完全相同,但核内质子数不同,一个是氖原子,一个是镁离子,所以它们不是同种粒子,化学性质也不一样。 3. 原子转化为离子后的变化 (1)原子得失电子变成离子后,变化的是其核外电子数,核内质子数没有变化,所以元素种类保持不变。形成离子所带的电荷数等于该原子(或原子团)得失的电子数。 (2)原子转化为离子,电子层结构可能发生变化。 ①金属元素的原子,失去电子形成阳离子后,少了一个电子层; ②非金属元素的原子,得到电子形成阴离子,电子层数不变。 注意:具有相同的电子层结构的两种粒子,不一定是同种元素。 (3)同种元素所形成的离子,因其所带电荷不同,性质也不同,如Fe2+和Fe3+。 例题 下图是A、B、C、D四种粒子的结构示意图,回答下列问题: (1)A、B、C中属于离子的是 。 (2)若D表示某元素的原子,则m= ,该元素的原子在化学反应中容易 (选填“得”或“失”)电子。 (3)在A、C形成的化合物中,A、C的原子个数比是 。 解析:离子是由原子得失电子形成的,其核外电子总数与核内质子数不等;阳离子的核内质子数大于核外电子数,阴离子的核内质子数小于核外电子数,如果是原子,则核内质子数等于核外电子数,所以D原子的核外电子总数应该是17,因此m=17-10=7,若是A、C形成化合物,A的核外只有一个电子,可以失去一个电子,而C的最外层有6个电子,需要得到2个电子形成稳定结构,它们形成稳定化合物时,正负电荷的数目必须相等,故原子个数比应为2∶1。 答案:(1)B (2)7;得 (3)2∶1 点拨:电子是原子结构的一部分,不会凭空产生和消失,因此无论是分子中电子的转移还是离子中电子的得失,其总数必须相等,保证电荷守恒。 【方法提炼】 7 用等电子数法判断物质形成时的原子个数比 原子通过得失电子形成离子,离子是构成物质的基本粒子之一,阴离子和阳离子不能单独存在,它们彼此所带电荷不同,往往通过互相吸引形成稳定化合物。原子在形成离子时,电子不会凭空消失,也不会凭空产生,得失电子的过程其实是电子的转移过程,所以在形成离子的过程中,得失的电子总数是相等的。解题时应用等电子数法往往可以使解题变得更为简单。 等电子数法的解题要领: 1. 得失电子总数是相等的 2. 原子个数= 例题 已知A原子核外最外层的电子数是2,B原子核外有7个电子,则A、B所形成物质的粒子模型是( ) A. AB2 B. A2B C. AB D. A3B2 解析:A原子核外最外层的电子数为2,所以A原子可以失去两个电子形成A2+离子;而B的核外有7个电子,按照核外电子分层排布的规律,其最外层有5个电子,需要得到3个电子形成阴离子B3-,根据等电子数法可知,A、B形成物质时,得失的电子数必须相等,可以确定其得失电子总数为6,则需要A原子的个数为3,需要B原子的个数为2,因此其粒子模型中A、B原子的个数比应该是3∶2。 答案:D 点拨:得失电子总数相等,一般可通过确定其得电子与失电子的最小公倍数来实现,然后根据得失电子总数确定相应的原子(离子)个数即可解题。 (答题时间:30分钟) 1. 下列粒子结构示意图中表示阴离子的是( ) 2. 下列物质中,由离子构成的是( ) A. 硫 B. 氯化钠 C. 氧气 D. 水 3. 下列化学用语书写正确的是( ) A. 钴元素CO B. 4个氢原子2H2 C. 铵根离子NH4+ D. 氮分子N 4. 对于下列化学用语,有关说法正确的是( ) ① N2 ②Mg2+ ③S ④ ⑤ A. ①可表示两个氮原子 B. ③中硫可形成的阴离子是S2- C. ②和⑤均表示阳离子 D. ④和⑤表示的微粒化学性质相同 7 5. 下列粒子结构示意图不正确的是( ) A. 氢原子 B. 钠离子 C. 氯离子 D. 氧原子 6. 下列关于钠原子和钠离子的说法中,正确的是( ) A. 它们的核外电子数相同 B. 它们的性质完全相同 C. 钠原子的质量比钠离子大得多 D. 它们的质子数和中子数都相同 7. 人体缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。结合图中信息判断,下列叙述正确的是( ) A. 碘原子的质量是126.9 g B. 碘离子(I-)的核外电子数为54 C. 碘是人体必需的微量元素,摄入越多越好 D. 碘原子核外有5个电子层,参加化学反应时易失去最外层电子 8. 粒子M通过一定方式转化为N, 如下图所示,变化前后保持不变的是( ) A. 核电荷数 B. 带电情况 C. 核外电子数 D. 化学性质 *9. 下图是钠原子的结构示意图,据图回答下列问题: (1)在化学反应中,钠原子一般易 (填得到或失去)电子,形成 (填阳或阴)离子。 (2)该元素与氧元素形成的化合物中原子个数比是 。 (3)钠原子与下面哪种原子的化学性质相似 (填选项)。 7 10. 化学用语可准确、简洁地表达化学信息。请用化学符号和数字填空。 (1)硝酸根离子 ; (2)2个碳酸根离子 ; (3)铵根离子 ; (4)氢氧根离子 。 11. 根据下列图示回答问题。 (1)A、B、C、D共表示______种元素,其中属于金属元素的是________(填元素名称)。 (2)Cl在化学反应中易_________(填“得到”或“失去”)电子,形成________(填化学符号) (3)钠元素与氯元素形成的化合物的原子个数比是____________。 *12. 下面是部分原子或离子的结构示意图。请你仔细观察、分析,然后回答问题: (1)上述粒子中,属于阳离子的是___________(填序号,下同),属于阴离子的是_______; (2)电子层结构完全相同的离子是__________(填写序号); (3)能与①形成AB4型分子的是____________(填写序号)。 7 1. C 解析:A中核内质子数大于核外电子数,属于阳离子;B中核内质子数等于核外电子数,属于原子;C中核内质子数小于核外电子数,属于阴离子;D中核内质子数大于核外电子数,属于阳离子,故选C。 2. B 解析:硫属于非金属固体单质,是由原子直接构成;氯化钠是由钠离子和氯离子构成;氧气是由氧分子构成;水是由水分子构成。 3. C 解析:钴元素的元素符号为Co,而CO表示的是一氧化碳;4个氢原子用4H表示,2H2表示两个氢分子;氮分子用N2表示,N表示氮元素或一个氮原子。 4. B 解析:“N2”表示氮气,还可表示一个氮分子、一个氮分子中含有2个氮原子,“2N”表示2个氮原子,A错误;S是16号元素,核外一共有16个电子,最外层有6个,可得到两个电子形成阴离子S2-,B正确;②表示阳离子——镁离子,由⑤的结构示意图可知,核内质子数<核外电子数,属于阴离子,C错误;④和⑤表示的微粒属于同一种元素,但由于两者的最外层电子数不同,因此两者的化学性质不同,D错误。 5. B 解析:区分原子和离子的关键是看质子数和电子数是否相等,质子数等于电子数为原子,否则为离子,所以钠离子的结构示意图为:,B中表示的是钠原子的结构示意图。 6. D 解析:金属原子易失去最外层电子形成具有相对稳定结构的阳离子,非金属原子得到电子形成具有相对稳定结构的阴离子,因此离子和原子的核外电子数不等,A错误;元素的化学性质与原子的最外层电子数关系密切。钠原子的最外层电子数没有达到相对稳定结构,在化学变化中表现为易失去电子,钠离子最外层达到相对稳定结构,B错误;原子的质量主要集中在原子核上,一个电子的质量非常小,因此钠原子和钠离子的质量差不多,C错误;原子形成离子的过程中质子数和中子数没有变化,D正确。 7. B 解析:根据碘在周期表中的信息可知,碘的原子序数为53,碘的相对原子质量为126.9,相对原子质量的单位不是质量单位,所以A不正确;碘原子最外层电子数为7,在化学反应中易得到电子形成碘离子,所以碘离子的核外电子数为54,即B正确;碘是人体必需的微量元素,但微量元素在体内有一个合理的浓度范围,高于或低于这一范围对人体健康都不利,所以C不正确;根据碘原子的结构示意图可知,碘原子核外有五个电子层,但在化学反应中易得到电子,所以D不正确。 8. A 解析:通过观察粒子M的结构示意图可以看出,M表示的是原子,最外层电子数为1,少于4个,在化学反应中易失去最外层电子变成离子,也就是粒子N,在此过程中,原子核没有发生改变,所以核电荷数没有改变,故选项A正确;粒子M失去1个电子变成带1个单位正电荷的离子N,故选项B错误;粒子M变成粒子N,失去1个电子,故选项C错误;M的最外层电子数为1,而N的最外层电子数为8,故两者的化学性质不同,选项D错误。 9. 失去;阳;2∶1;A 解析:钠原子最外层电子数为1,容易失去电子形成阳离子,离子形成稳定化合物时,得失电子总数是相等的,故钠原子和氯原子的个数比应为2∶1,原子的最外层电子数相同,化学性质相似,A中最外层电子数与钠原子相同。 10. (1)NO3- (2)2CO32- (3)NH4+ (4)OH- 解析:表示离子要在元素符号或原子团的右上角写上正负号与数字,数字在前,正负号在后,数字为“1”时要省略不写;表示几个离子要在离子前面加数字,故2个碳 7 酸根离子可表示为2CO32-。 11. (1)两;钠 (2)得到;Cl- (3)1∶1 解析:不同元素的根本区别在于原子核内的质子数不同,氯元素的最外层电子数是7,容易得到1个电子形成阴离子,带一个单位的负电荷;钠原子会失去一个电子形成阳离子,带一个单位的正电荷,根据得失电子总数相等,可知形成化合物时原子个数比为1∶1。 12. (1)⑤;③ (2)③④⑤ (3)⑥ 解析:原子得失电子形成离子,阳离子的核内质子数大于核外电子数,阴离子的核内质子数小于核外电子数;电子层结构完全相同指的是电子层数相同,每一层容纳的电子数也完全一样,注意与粒子的种类无关,可以是原子,也可能是阴离子或阳离子;①的核外只有一个电子,只能转移或失去一个电子。要形成AB4型分子,则另一个原子的最外层电子数必须是4个,按照得失电子总数相等的原则,原子个数比为1∶4。 7查看更多