- 2021-05-13 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学专题练习粗盐提纯
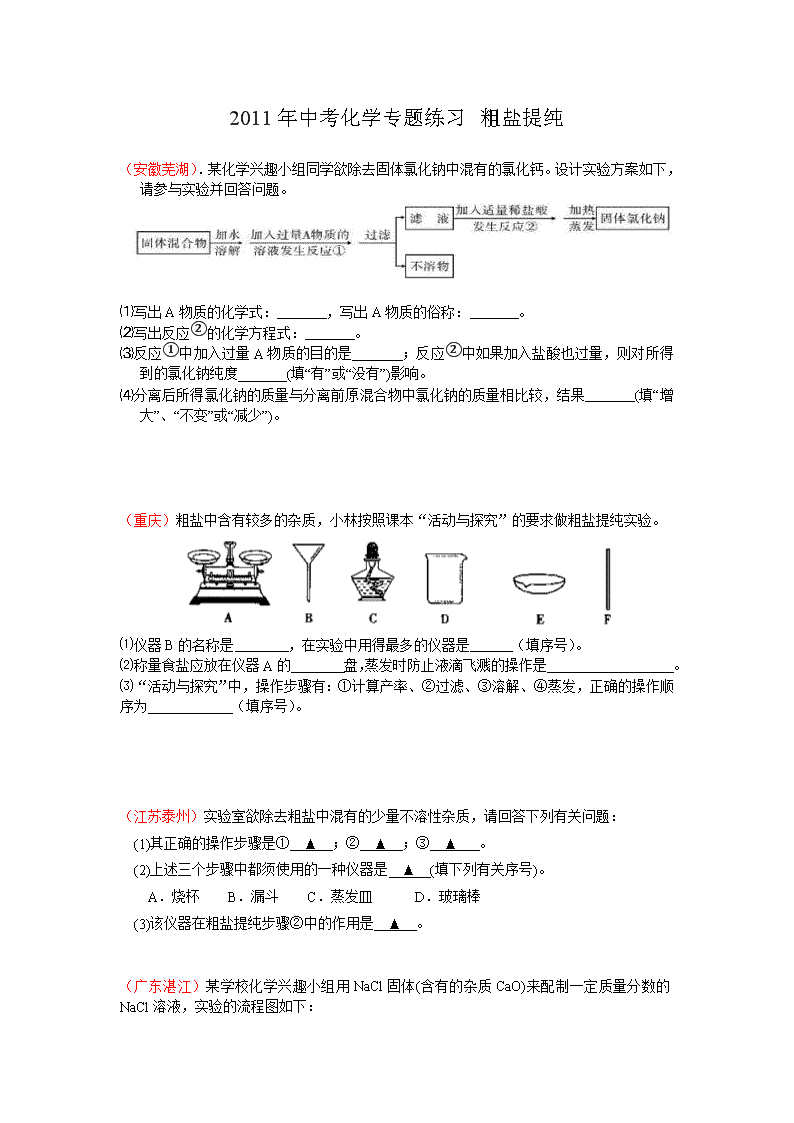
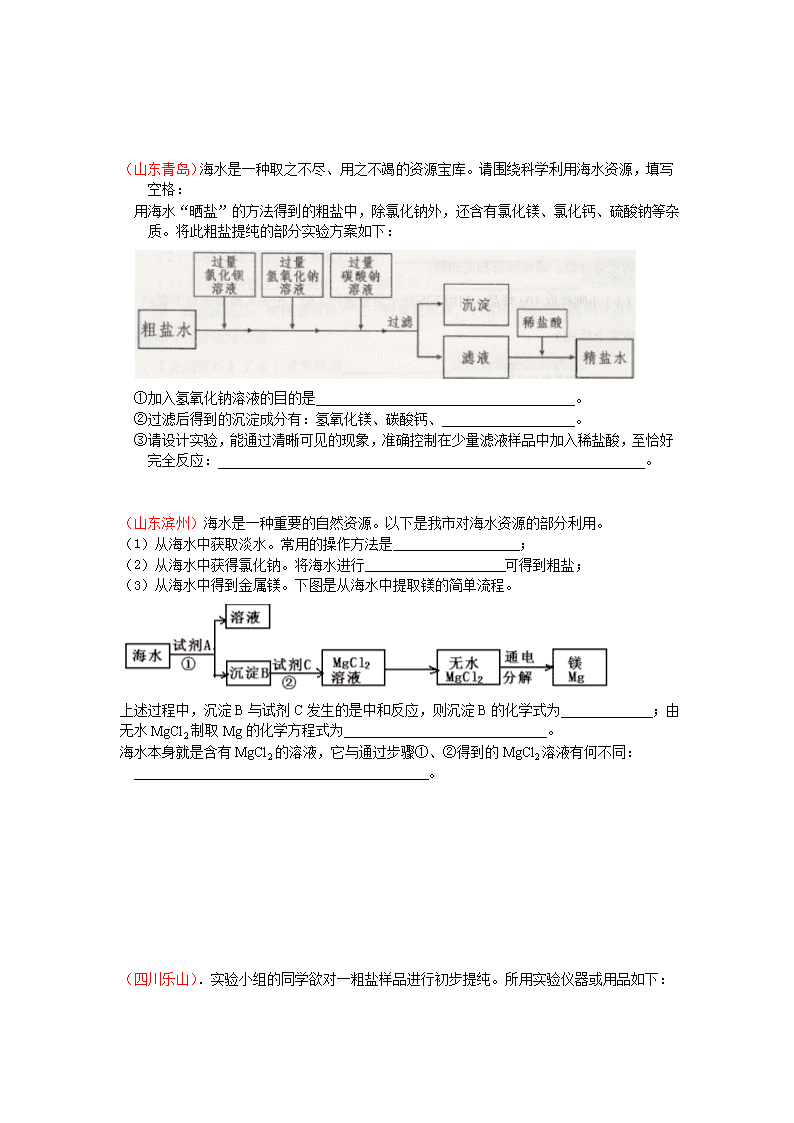
2011 年中考化学专题练习 粗盐提纯 (安徽芜湖).某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下, 请参与实验并回答问题。 ⑴写出 A 物质的化学式: ,写出 A 物质的俗称: 。 ⑵写出反应②的化学方程式: 。 ⑶反应①中加入过量 A 物质的目的是 ;反应②中如果加入盐酸也过量,则对所得到 的氯化钠纯度 (填“有”或“没有”)影响。 ⑷分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 (填“增 大”、“不变”或“减少”)。 (重庆)粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。 ⑴仪器 B 的名称是 ,在实验中用得最多的仪器是 (填序号)。 ⑵称量食盐应放在仪器 A 的 盘,蒸发时防止液滴飞溅的操作是 。 ⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺 序为 (填序号)。 (江苏泰州)实验室欲除去粗盐中混有的少量不溶性杂质,请回答下列有关问题: (1)其正确的操作步骤是① ▲ ;② ▲ ;③ ▲ 。 (2)上述三个步骤中都须使用的一种仪器是 ▲ (填下列有关序号)。 A.烧杯 B.漏斗 C.蒸发皿 D.玻璃棒 (3)该仪器在粗盐提纯步骤②中的作用是 ▲ 。 (广东湛江)某学校化学兴趣小组用 NaCl 固体(含有的杂质 CaO)来配制一定质量分数的 NaCl 溶液,实验的流程图如下: 请回答: (1)写出适量 HCl 加入到溶液 B 中所发生反应的化学方程式为___________________。 (2) 操 作 2 的 名 称 是 __________ , 在 溶 液 A 中 加 入 过 量 碳 酸 钠 的 目 的 是 ________________。 (3)若要配制 100g 质量分数为 10%的氯化钠溶液,除了用到天平、烧杯、量筒外,还 需用到的玻璃仪器是__________,其作用是______________________________。 (贵州遵义)我国拥有丰富的海洋资源,我们可以从海水中提取食盐,并以此为原料制得具 有广泛用途的烧碱,其制取的主要工艺流程如下: (1)利用风吹日晒可以从海水中提取粗盐,风吹日晒的丰要作用是 ; (2)氯化钠溶解过程中搅拌的目的是 ; (3)写出氯化钠饱和溶液在通电条件下发生反应的化学方程式 。 (江苏淮安).医院救治病人急需一批生理盐水,制药厂积极支援,用含有少量碳酸钠的氯 化钠为原料生产纯净的氯化钠,再用其配制生理盐水。某化学学习小组运用所学知识, 在实验室设计了如图的氯化钠的生产流程。 请根据上述内容回答下列问题: (1) 操作①中常用玻璃棒搅拌,其目的是 。 (2) 操作②中应加入的试剂 B 为 ,该小组同学认为过量的 B 无需再用试剂除去, 最终对氯化钠的纯度不会造成影响,其原因是 。 (3) 若用不纯的氯化钠配制生理盐水可能会危及病人生命,请你选用下列所提供的试剂, 对该小组制得的氯化钠进行检验,以判断碳酸钠被除尽。请写出实验具体步骤和现象。 供选用的试剂:蒸馏水、澄清石灰水、氢氧化钠溶液。 实验步骤和现象: 。 (山东青岛)海水是一种取之不尽、用之不竭的资源宝库。请围绕科学利用海水资源,填写 空格: 用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂 质。将此粗盐提纯的部分实验方案如下: ①加入氢氧化钠溶液的目的是_____________________________________。 ②过滤后得到的沉淀成分有:氢氧化镁、碳酸钙、___________________。 ③请设计实验,能通过清晰可见的现象,准确控制在少量滤液样品中加入稀盐酸,至恰好 完全反应:_____________________________________________________________。 (山东滨州)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。 (1)从海水中获取淡水。常用的操作方法是 ; (2)从海水中获得氯化钠。将海水进行 可得到粗盐; (3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。 上述过程中,沉淀 B 与试剂 C 发生的是中和反应,则沉淀 B 的化学式为 ;由 无水 MgCl2 制取 Mg 的化学方程式为 。 海水本身就是含有 MgCl2 的溶液,它与通过步骤①、②得到的 MgCl2 溶液有何不同: 。 (四川乐山).实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下: A B C D E F G H (1)A 的名称是 ; (2)提纯的步骤是:溶解、过滤、 、计算产率; (3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是 ; (4)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测 得的结果比实际偏低,请分析可能的原因: 。 (四川达州)海水是一种重要的自然资源(海水中含 NaCl、MgCl2 等物质),被誉为“国防 金属”的镁主要是从海水中提取的,下面是从海水中提取金属镁的简单流程。 ⑴从海水中获得淡水,常用的方法是 。 ⑵从海水中获得粗盐,可将海水进行 。 ⑶试剂 A 最好选用 。 (辽宁鞍山)氯化钠是日常生活的必需品,也是重要的化工原料。 (1)粗盐除含 NaCl 外,还含有少量 MgCl2、CaCl2、Na2SO4 以及泥沙等杂质。以下是 粗盐提纯的操作流程。 提供的试剂:Na2CO3 溶液、K2CO3 溶液、NaOH 溶液、BaCl2 溶液、Ba(NO3)2 溶液、饱 和 NaCl 溶液。 ①欲除去溶液 I 中的 MgCl2、CaCl2、Na2SO4,从提供的试剂中选出 a 所代表的试剂,按 海水 溶液 Mg(OH)2 MgCl2 溶液 无水 MgCl2 Mg 试剂 A 试剂 B 通电 滴加顺序依次为:过量的 NaOH 溶液、 、 ; ②在滤液中加盐酸的作用是 ; (2)用提纯的 NaCl 配制 200g0.9%的生理盐水,需要 NaCl 的质量为 g。 ①配制该溶液时所需要的玻璃仪器有 ②如果配制后溶液溶质的质量分数低于 0.9%,你认为可能的原因是 。(任写一个) (广东佛山)通过海水晾晒可得粗盐,粗盐除 NaCl 外,还含有 MgCl2、CaCl2、Na2SO4 以 及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下: (1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。 (2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步 操作的目的是除去滤液中 。 (3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。 (4)在第③步操作中,选择的除杂的试剂不能用 KOH 代替 NaOH,理由是 。 (浙江丽水)某学习小组设计分离 NaCl 和 CaCl2 两种固体混合物方案如下: (1)操作 A 是_________________。 (2)蒸发氯化钙溶液过程中需要用到的仪器除蒸发皿、烧杯、铁架台(带铁圈)、酒精灯、火 柴外,还必须要有的一种仪器是_________________。 (3)有同学提出滤液中含有少量的碳酸钠,应加入_________________至过量,再蒸发结晶 才能得到纯净的氯化钠。 (4)如果实验过程中得到白色沉淀 80 克,试计算原混合物中有多少克 CaCl2 固体?(假设实 验过程中无损耗) (山东潍坊)某校化学活动小组查阅资料发现,粗盐中除 NaCl 外,还含有 MgCl2、 CaCl2、MgSO4 以及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验方案(序号①~ ⑧表示实验操作,用于沉淀的试剂稍过量..): 根据上述方案,回答下列问题: (1)操作①中玻璃棒的作用是_____________。 (2)第⑤步操作的名称是_____________。 (3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、_______、 (4)实验中加入“Na2SO4 溶液”的目的是_______________________________ (5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):_____________。 (山东青岛)海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、 氯化钙等可溶性杂质,他们在溶液中主要以 SO42-、Ca2+、Mg2+的形式存在,为将这些杂质 离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再 加入适量的盐酸,得到精盐水,最后经蒸发即得精盐。以下是某化工厂对海水进行综合利用 的示意图: (1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制 得的,请写出制取石灰乳的化学方程式_________________________________________。 (2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________, 理由是_____________________________________________________________________; (3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是__________ ____________________________________________________________________。 (·山东烟台)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。 (1)从海水中获取淡水。常用的操作方法是 。 (2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有 的 SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的 Na2CO3 溶液; ③加过量 海水 粗盐 溶解 ① BaCl2 溶液 ② NaOH 溶液 ③ Na2CO3 溶液 ④ 过滤 ⑤ 沉淀 滤液 盐酸 ⑥ 蒸发、结晶 烘干 精盐 苦卤 石灰乳 MgCl2 溶液盐酸 Mg(OH)2 一定条件 MgCl2 通电 Mg Cl2 的 BaCl2 溶液;④加适量的盐酸;⑤加过量 NaOH 溶液;⑥蒸发结晶;⑦过滤。正确的操作 顺序是 。(用序号填一种合理组合)。 (3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。 上述过程中,沉淀 B 与试剂 C 发生的是中和反应,则沉淀 B 的化学式为 , 由无水 MgCl2 制取 Mg 的化学方程式为 。海水本 身就是含有 MgCl2 的溶液,它与通过步骤①、②得到的 MgCl2 溶液有何不同: 。 (4)海水“制碱”。下图是海水“制碱”的部分简单流程。 步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、 。 制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会 降低。这是因为 。 某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品。岩盐水主要含氯化钠,此 外还含有较多硫酸钠,以及少量氯化钙和氯化镁。岩盐水初步处理后,经净化、精制得到生 产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下: (1)“降温”的目的是析出副产品“A晶体”,A的化学式是_______________。 (2)“操作I”中的操作是_____ _______________,若在实验室进行该操作,需要用到的 玻璃仪器除烧杯、玻璃棒外,还有______________________________。 (3)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是________________。 (4)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是__________________。 通过海水晾晒可得粗盐。粗盐除 NaCl 外,还含有 MgCl2、CaCl2 以及泥沙等杂质。为 了有效将粗盐提纯,实验的各步操作流程如下图所示。 根据以上信息回答: (1)在完成操作Ⅰ之前,必须加入的 X 物质是 。 (2)操作Ⅰ和操作Ⅱ的名称是 。 (3)在实验过程中加入过量的 NaOH 溶液,其实验目的是 ,有关化学方程式 是 。 (4)判断加入的盐酸“适量”的方法是 。 (5)实验所得精盐的质量大于粗盐中 NaCl 的质量,原因是 。查看更多