- 2021-05-11 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学氧化铜的还原
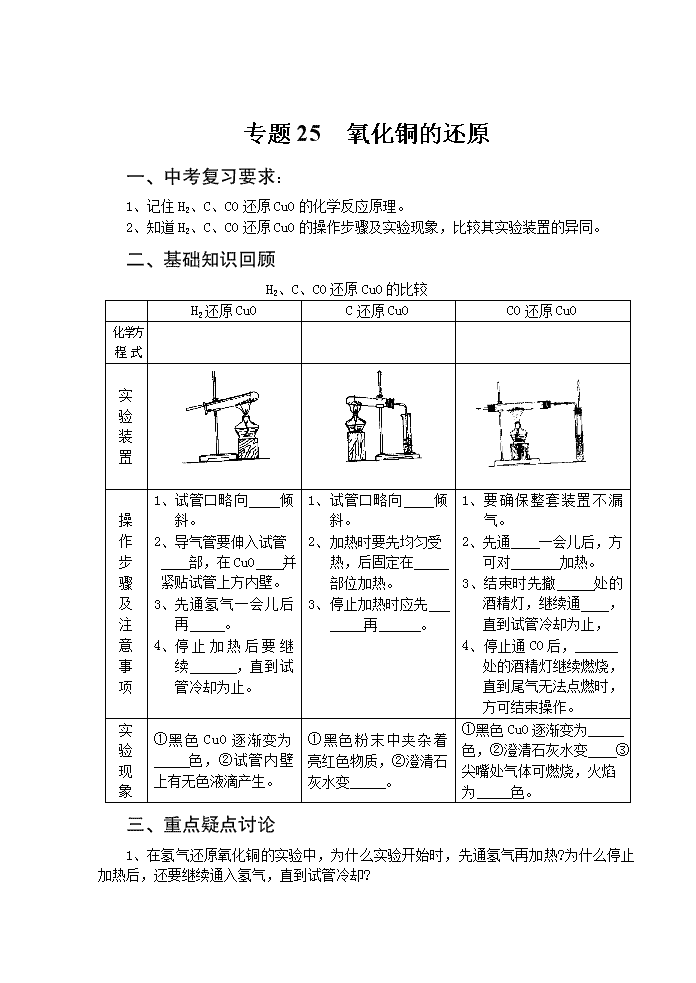
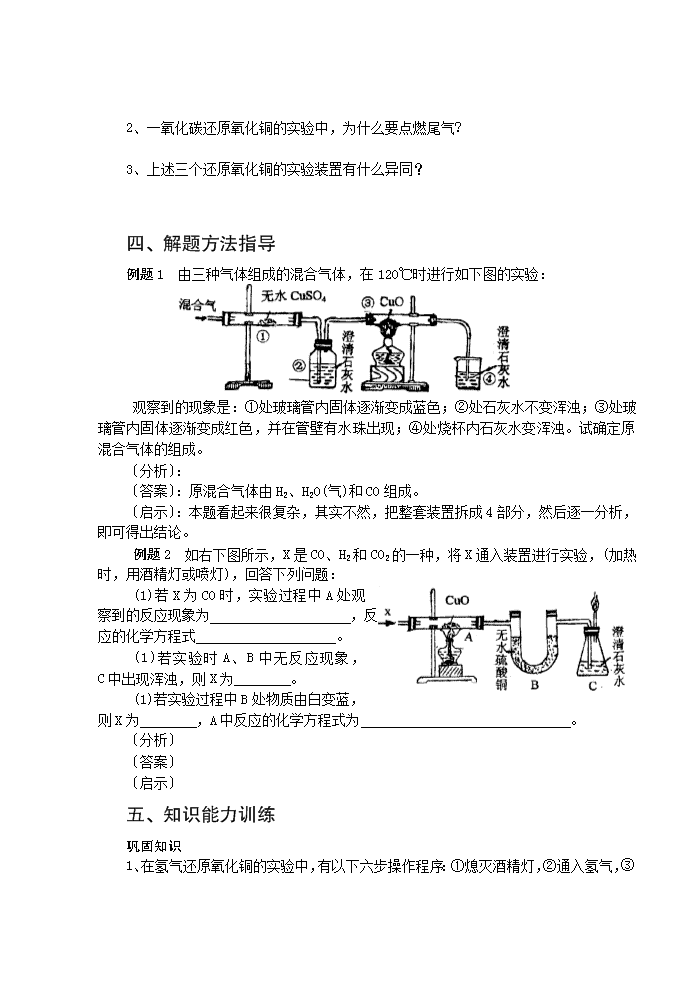
专题25 氧化铜的还原 一、中考复习要求: 1、记住H2、C、CO还原CuO的化学反应原理。 2、知道H2、C、CO还原CuO的操作步骤及实验现象,比较其实验装置的异同。 二、基础知识回顾 H2、C、CO还原CuO的比较 H2还原CuO C还原CuO CO还原CuO 化 学 方程 式 实验 装置 操作 步骤 及 注意 事项 1、 试管口略向 倾斜。 2、 导气管要伸入试管 部,在CuO 并紧贴试管上方内壁。 3、 先通氢气一会儿后再 。 4、 停止加热后要继续 ,直到试管冷却为止。 1、 试管口略向 倾斜。 2、 加热时要先均匀受热,后固定在 部位加热。 3、 停止加热时应先 再 。 1、 要确保整套装置不漏气。 2、先通 一会儿后,方可对 加热。 3、结束时先撤 处的酒精灯,继续通 ,直到试管冷却为止, 4、 停止通CO后, 处的酒精灯继续燃烧,直到尾气无法点燃时,方可结束操作。 实验 现象 ① 黑色CuO逐渐变为 色,②试管内壁上有无色液滴产生。 ①黑色粉末中夹杂着亮红色物质,②澄清石灰水变 。 ①黑色CuO逐渐变为 色,②澄清石灰水变 ③尖嘴处气体可燃烧,火焰为 色。 三、重点疑点讨论 1、在氢气还原氧化铜的实验中,为什么实验开始时,先通氢气再加热?为什么停止加热后,还要继续通入氢气,直到试管冷却? 2、一氧化碳还原氧化铜的实验中,为什么要点燃尾气? 3、上述三个还原氧化铜的实验装置有什么异同? 四、解题方法指导 例题1 由三种气体组成的混合气体,在120℃时进行如下图的实验: 观察到的现象是:①处玻璃管内固体逐渐变成蓝色;②处石灰水不变浑浊;③处玻璃管内固体逐渐变成红色,并在管壁有水珠出现;④处烧杯内石灰水变浑浊。试确定原混合气体的组成。 〔分析〕: 〔答案〕:原混合气体由H2、H2O(气)和CO组成。 〔启示〕:本题看起来很复杂,其实不然,把整套装置拆成4部分,然后逐一分析,即可得出结论。 例题2 如右下图所示,X是CO、H2和CO2的一种,将X通入装置进行实验,(加热时,用酒精灯或喷灯),回答下列问题: (1)若X为CO时,实验过程中A处观察到的反应现象为 ,反应的化学方程式 。 (1) 若实验时A、B中无反应现象, C中出现浑浊,则X为 。 (1) 若实验过程中B处物质由白变蓝, 则X为 ,A中反应的化学方程式为 。 〔分析〕 〔答案〕 〔启示〕 五、知识能力训练 巩固知识 1、在氢气还原氧化铜的实验中,有以下六步操作程序:①熄灭酒精灯,②通入氢气,③ 加热,④停止通氢气,⑤继续通氢气,⑥检验氢气纯度。其正确的操作顺序是( ) A、①②③④⑤⑥ B、⑥②③①⑤④ C、⑥④②③⑤① D、④⑤①③⑥② 2、在氢气还原氧化铜的实验中,氧化铜先变成亮红色,后又变成暗红色,造成这种后果的原因可能是( ) A、通入氢气量不足 B、加热温度不够 C、撤酒精灯过早 D、没有继续通H2到试管冷却 3、木炭、氢气、一氧化碳分别与黑色的氧化铜粉末反应,下列叙述错误的是( ) A、都有红色铜产生 B、都有氧化物产生 C、反应时都需加热条件 D、反应都属置换反应 4、木炭、氢气、一氧化碳分别跟足量灼热的氧化铜粉末充分反应,若木炭、氢气、一氧化碳三者质量相同,则下列说法正确的是( ) A、一氧化碳还原出铜最多 B、木炭还原出铜最少 C、氢气还出铜最多 D、木炭与一氧化碳还原出铜一样多 提高能力 5、氢气还原CuO的实验: (1)在实验过程中,可以观察到的现象是:试管内黑色固体逐渐变为 色,试管口有 生成。 (2)该反应的化学方程式是 。 (3)欲完成此实验,实验室仅提供以下实验用品(数量有限): 稀H2SO4,氧化铜、锌粒、试管、烧杯、药匙、胶头滴管、铁架台(带铁夹)、漏斗,带导管的橡皮塞,玻璃导管,橡皮塞,橡皮管,滤纸,火柴,纸槽。 学生甲认为这个实验不能完成,学生乙认为这个实验可以完成,试分析: 学生甲遇到的困难是 。 学生乙用 的方法完成了此实验。 6、下图中,a是纯净气体,b是黑色粉末为氧化铜或炭粉或氧化铜与炭粉的混合物。 根据实验装置回答下列问题。 (1)若a为二氧化碳气体,在C处无变化,d的出口有可燃性气体导出,则b中反应的化学方程式是 。 (2)若b中黑色粉末为氧化铜,实验中黑色粉末变为红色,C处无变化,则a为 ,d中的现象为 。 (3)若C中的白色物质变为黑色,d中出现浑浊,则a为 ,黑色粉末为 。 7、下图是利用锌粒与盐酸反应制取纯净氢气,并用以测定水的组成的实验装置。(1)装置B的作用是 ,有关化学方程式为 。 (2)装置D中的现象是 ,化学方程式为 。 (3)装置E中放有无水CaCl2,用来吸收生成的水,若反应后D的质量减少1.32g,E的质量增加1.485g,试通过计算求出水中氢、氧两种元素的质量比(最简整数比) 8、为了确定三种可燃性气体;CH4、H2、和CO(简称试验气),分别将它们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶(如右下图),回答下列问题: (1)装置A的液体是 。 装置B的液体是 。 (2)若装置A的质量增加,B的质量不变, 则试验气是 ,燃烧的化学方 程式为 。 (3)若装置A的质量不变,B的质量增加则试验气是 ,燃烧的化学方程式为 。 B (4)若装置A、B的质量都增加,则试验气是 ,若B的质量增加mg,则A的质量增加 g。查看更多