- 2021-05-10 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学酸碱盐知识点归纳
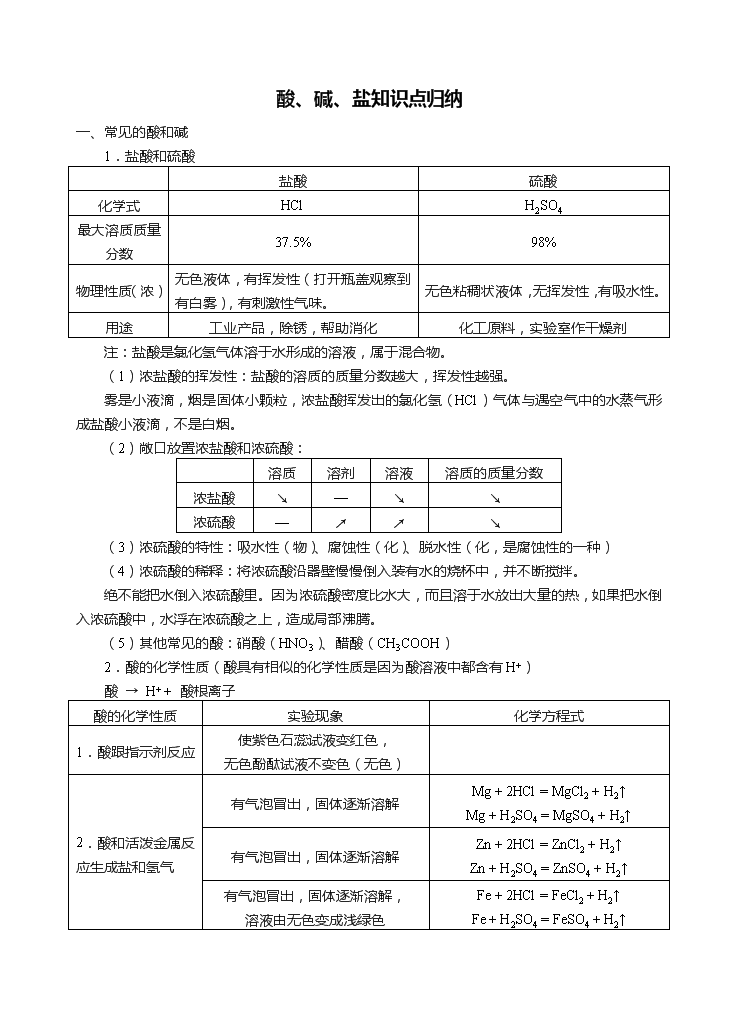
酸、碱、盐知识点归纳 一、常见的酸和碱 1.盐酸和硫酸 盐酸 硫酸 化学式 HCl H2SO4 最大溶质质量分数 37.5% 98% 物理性质(浓) 无色液体,有挥发性(打开瓶盖观察到有白雾),有刺激性气味。 无色粘稠状液体,无挥发性,有吸水性。 用途 工业产品,除锈,帮助消化 化工原料,实验室作干燥剂 注:盐酸是氯化氢气体溶于水形成的溶液,属于混合物。 (1)浓盐酸的挥发性:盐酸的溶质的质量分数越大,挥发性越强。 雾是小液滴,烟是固体小颗粒,浓盐酸挥发出的氯化氢(HCl)气体与遇空气中的水蒸气形成盐酸小液滴,不是白烟。 (2)敞口放置浓盐酸和浓硫酸: 溶质 溶剂 溶液 溶质的质量分数 浓盐酸 ↘ — ↘ ↘ 浓硫酸 — ↗ ↗ ↘ (3)浓硫酸的特性:吸水性(物)、腐蚀性(化)、脱水性(化,是腐蚀性的一种) (4)浓硫酸的稀释:将浓硫酸沿器壁慢慢倒入装有水的烧杯中,并不断搅拌。 绝不能把水倒入浓硫酸里。因为浓硫酸密度比水大,而且溶于水放出大量的热,如果把水倒入浓硫酸中,水浮在浓硫酸之上,造成局部沸腾。 (5)其他常见的酸:硝酸(HNO3)、醋酸(CH3COOH) 2.酸的化学性质(酸具有相似的化学性质是因为酸溶液中都含有H+) 酸 → H+ + 酸根离子 酸的化学性质 实验现象 化学方程式 1.酸跟指示剂反应 使紫色石蕊试液变红色, 无色酚酞试液不变色(无色) 2.酸和活泼金属反应生成盐和氢气 有气泡冒出,固体逐渐溶解 Mg + 2HCl = MgCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑ 有气泡冒出,固体逐渐溶解 Zn + 2HCl = ZnCl2 + H2↑ Zn + H2SO4 = ZnSO4 + H2↑ 有气泡冒出,固体逐渐溶解, 溶液由无色变成浅绿色 Fe + 2HCl = FeCl2 + H2↑ Fe + H2SO4 = FeSO4 + H2↑ 3.酸和金属氧化物反应生成盐和水 固体逐渐溶解, 溶液由无色变成黄色 Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 固体逐渐溶解, 溶液由无色变成蓝色 CuO + 2HCl = CuCl2 + H2O CuO + H2SO4 = CuSO4 + H2O 4.酸和碱反应生成盐和水(中和反应) NaOH + HCl = NaCl + H2O Ca(OH)2 + H2SO4 = CaSO4 + 2H2O 5.酸和盐反应生成新酸和新盐 有白色沉淀生成, 加入稀硝酸,沉淀不溶解 AgNO3 + HCl = AgCl↓ + HNO3 BaCl2 + H2SO4 = BaSO4↓ + 2HCl 固体逐渐溶解,产生大量的气泡, 生成能使澄清石灰水变浑浊的气体 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 3.氢氧化钠和氢氧化钙 氢氧化钠 氢氧化钙 化学式 NaOH Ca(OH)2 俗名 烧碱、火碱、苛性钠 熟石灰、消石灰 物理性质 白色固体,有吸水性(易潮解), 易溶于水(溶于水溶液温度升高)。 白色粉末状固体,微溶于水。 用途 工业产品,除锈,帮助消化 化工原料,实验室作干燥剂 (1)用石灰石、水、纯碱为原料制熟石灰、烧碱: ①石灰石→生石灰: ②生石灰→熟石灰:CaO + H2O = Ca(OH)2,放出大量的热 ③纯碱→烧碱:Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (2)其他常见的碱:氢氧化钾(KOH)、氨水(NH3·H2O) 4.碱的化学性质(碱具有相似的化学性质是因为碱溶液中都含有OH-) 碱 → 金属离子 + OH- 碱的化学性质 氢氧化钠 氢氧化钙 1.碱跟指示剂反应 使紫色石蕊试液变蓝色,无色酚酞试液变红色 2.碱和非金属氧化物反应生成盐和水 2NaOH + CO2 = Na2CO3 + H2O 吸收CO2 Ca(OH)2 + CO2 = CaCO3↓ + H2O 澄清石灰水变浑浊,用于检验CO2 2NaOH + SO2 = Na2SO3 + H2O 吸收SO2 Ca(OH)2 + SO2 = CaSO3 + H2O 3.碱和酸反应生成盐和水(中和反应) NaOH + HCl = NaCl + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O Ca(OH)2 + 2HCl = CaCl2 + 2H2O Ca(OH)2 + H2SO4 = CaSO4 + 2H2O 4.碱与铵盐反应 (NH4)2SO4 + Ca(OH)2 = CaSO4 + 2H2O + 2NH3↑ NH4Cl + NaOH = NaCl + H2O + NH3↑ 注:并不是所有非金属氧化物都能与碱反应,如H2O、CO。 5.浓硫酸、氢氧化钠事故的处理: (1)浓硫酸:立即用大量的水冲洗,并涂上3%~5%的碳酸氢钠溶液; (2)氢氧化钠:用较多的水冲洗,并涂上硼酸溶液。 6.常见的干燥剂: (1)浓硫酸:因能与NH3反应,所以不能用于干燥NH3 (2)氢氧化钠固体:因能与CO2、SO2等反应,所以不能用于干燥CO2、SO2 (3)生石灰:吸收水分,食品的干燥剂,CaO + H2O = Ca(OH)2 (4)铁粉:吸收氧气、水蒸气,抗氧化剂,食品的保鲜剂 7.氢氧化钠固体为什么要密封保存? (1)氢氧化钠易吸收空气中的水而潮解; (2)氢氧化钠易吸收空气中的二氧化碳而变质,2NaOH + CO2 = Na2CO3 + H2O 8.中和反应:酸和碱作用生成盐和水的反应。 (1)NaOH + HCl = NaCl + H2O该反应无明显现象,为了便于观察,在NaOH溶液中滴几滴无色酚酞,溶液呈红色,再逐滴滴加稀盐酸,红色逐渐消失,证明NaOH与盐酸发生了反应。 (2)中和反应关键是“酸和碱之间的反应”。 Fe2O3 + 6HCl = 2FeCl3 + 3H2O,CuO + H2SO4 = CuSO4 + H2O,2NaOH + CO2 = Na2CO3 + H2O 以上反应虽然有盐和水生成,但都不是中和反应。 所以说:有盐和水生成的反应不一定是中和反应。 9.酸性氧化物、碱性氧化物: 金属 碱性 氧化物 碱 盐 非金属 酸性 氧化物 酸 盐 酸性氧化物+ 水→酸 碱→盐+水(可溶性碱) (1)酸性氧化物: 碱性氧化物+ 水→碱(可溶性碱) 酸→盐+水 (2)碱性氧化物: 酸性氧化物→酸 水+ 碱性氧化物→碱(可溶性碱) CuSO4→CuSO4·5H2O (3)水: 二、酸碱性和酸碱度 1.酸碱性:酸性、碱性、中性。注意:呈酸性不等于一定是酸、呈碱性不等于一定是碱。如纯碱不是碱,但其水溶液呈碱性,pH>7。 2.酸碱度:溶液酸碱性的强弱程度。用pH表示,范围:0~14。 (1)pH = 7 时,溶液呈中性;滴入紫色石蕊试液不变色,滴入无色酚酞溶液不变色; (2)pH < 7 时,溶液呈酸性;pH越小,酸性越强,越接近7,酸性越弱;滴入紫色石蕊试液变红色,滴入无色酚酞溶液不变色; (3)pH > 7 时,溶液呈碱性,pH越大,碱性越强,越接近7 ,碱性越弱;滴入紫色石蕊试液变蓝色,滴入无色酚酞溶液变红色。 3.一些pH变化的图像 4.pH试纸的使用注意事项: (1)广泛pH试纸只能精确到整数; (2)不能把pH试纸直接浸入待测液中,以免污染待测液; (3)能不能事先湿润pH试纸?不能,这样做相当于把待测液稀释了。 若将pH试纸先润湿,对实验结果有什么影响?如果为酸性溶液,则pH偏大;若为碱性溶液,则pH偏小;若为中性溶液,则不影响。 5.雨水的pH:因溶有CO2,生成碳酸:H2O + CO2 = H2CO3,所以正常的雨水呈酸性,pH约为5.6,若pH < 5.6,则为酸雨。 三、常见的盐(盐 → 金属离子 + 酸根离子) 1.氯化钠(化学式:NaCl) (1)俗名:食盐 (2)用途:生理盐水(0.9%)、调味品、消融公路积雪(降低水的熔点) 2.常见的碳酸盐 碳酸钙 碳酸钠 碳酸氢钠 化学式 CaCO3 Na2CO3 NaHCO3 俗名 大理石、石灰石的主要成分 纯碱(纯碱不是碱)、苏打 小苏打 常见用途 建筑业、补钙剂、 治疗胃酸过多 玻璃、造纸、纺织等、 焙制糕点 焙制糕点、治疗胃酸过多 3.碳酸盐的化学性质 (1)与酸反应 与盐酸反应 实验现象 化学方程式 碳酸钙 有大量气泡产生,生成能使澄清石灰水变浑浊的气体,固体逐渐溶解 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 常用于实验室制CO2 碳酸钠 迅速产生大量气泡,生成能使澄清石灰水变浑浊的气体,固体溶解 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 碳酸氢钠 迅速产生大量气泡,剧烈反应,生成能使澄清石灰水变浑浊的气体,固体溶解 NaHCO3 + HCl = NaCl + H2O + CO2↑ 注:①因为Na2CO3、NaHCO3 与盐酸反应过快,不便于收集,因此不能用于实验室制取CO2。 ②能够治疗胃酸过多的物质:MgO、Mg(OH)2、CaCO3、NaHCO3、Al(OH)3。 (2)与碱反应 实验现象 化学方程式 碳酸钠与澄清石灰水 有白色沉淀生成 Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH 碳酸钠与Ba(OH)2溶液 Na2CO3 + Ba(OH)2 = BaCO3↓ + 2NaOH (3)与盐反应 实验现象 化学方程式 碳酸钠与Ba(NO3)2溶液 有白色沉淀生成 Na2CO3 + Ba(NO3)2 = BaCO3↓ + 2NaNO3 碳酸钠与CaCl2溶液 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl 4.盐的化学性质 盐的化学性质 实验现象 1.盐(可溶)与金属反应生成新盐和新金属 2AgNO3 + Cu = Cu(NO3)2 + 2Ag Fe + CuSO4 = FeSO4 + Cu 2.盐和酸反应生成新盐和新酸 H2SO4 + BaCl2 = BaSO4↓ + 2HCl Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 3.盐(可溶)与碱(可溶)反应生成新盐和新碱 Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (NH4)2SO4 + 2NaOH = Na2SO4 + 2H2O + 2NH3↑ 4.盐(可溶)与盐(可溶)反应生成新盐和新盐 NaCl + AgNO3 = AgCl↓ + NaNO3 Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl 四、复分解反应 1.复分解反应的特点: (1)反应物和生成物都是化合物;(2)反应物之间一定要互相交换成分。 注:①酸、碱、盐之间的反应都是复分解反应,金属氧化物与酸的反应是复分解反应; ②非金属氧化物与碱的反应不是复分解反应,如:2NaOH + CO2 = Na2CO3 + H2O。 2.复分解反应的条件: (1)两种反应物必须都是可溶的!但难溶于水的金属氧化物、难溶性碱、难溶性的碳酸盐却能与盐酸、硫酸、硝酸等强酸反应(能溶于酸)。 化学方程式 能否进行反应 理由 Fe2O3 + 6HCl = FeCl3 + 3H2O 能 Fe2O3能溶于酸 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 能 CaCO3能溶于酸 Mg(OH)2 + 2HCl = MgCl2 + 2H2O 能 Mg(OH)2能溶于酸 CuO + NaCl = CuCl2 + Na2O 否 CuO难溶于水 CaCO3 + BaCl2 = BaCO3 ↓+ CaCl2 否 CaCO3难溶于水 Mg(OH)2 + CuSO4 = Cu(OH)2↓ + MgSO4 否 Mg(OH)2难溶于水 (2)生成物中有沉淀或水或气体。 常见碱、盐溶解性规律: ①钾钠铵钡钙碱可溶, ②钾钠铵硝酸盐可溶,③盐酸盐不溶氯化银,④硫酸盐不溶硫酸钡,⑤碳酸盐只记钾钠铵。 请记住以下7个常见的沉淀: 碳酸钙 碳酸钡 氢氧化镁 氢氧化铜 氢氧化铁 氯化银 硫酸钡 化学式 CaCO3 BaCO3 Mg(OH)2 Cu(OH)2 Fe(OH)3 AgCl BaSO4 颜色 白 白 白 蓝 红褐 白 白 物质类别 盐 盐 碱 碱 碱 盐 盐 说明 难溶于水,可溶于酸 难溶于水,难溶于酸 请记住以下离子结合(不共存)的组合: 序号 阳离子 阴离子 生成物 说明 ① H+ OH- H2O 酸、碱中和 ② H+ CO32- H2O + CO2↑ 酸与碳酸盐反应 ③ Ca2+ CO32- CaCO3↓ ④ Ba2+ CO32- BaCO3↓ ⑤ Ba2+ SO42- BaSO4↓ ⑥ Ag+ Cl- AgCl↓ ⑦ Mg2+ OH- Mg(OH)2↓ ⑧ Cu2+ OH- Cu(OH)2↓ ⑨ Fe3+ OH- Fe(OH)3↓ ⑩ NH4+ OH- H2O + NH3↑ 碱与铵盐反应 注意 ①K+、Na+共存(不反应) ②两种物质若含相同离子则不反应,如:HCl和NaCl共存 五、粗盐提纯:粗盐因含CaCl2、MgCl2等杂质而容易潮解。 1.步骤:溶解、过滤、蒸发、计算产率 2.使用次数最多的一种仪器是玻璃棒 操作步骤 溶解 过滤 蒸发 转移药品 玻璃棒的作用 搅拌,加速粗盐溶解 引流 搅拌,以防液滴飞溅 转移 3.能够用溶解、过滤、蒸发的步骤提纯的混合物由可溶和难溶物质组成。 4.产率评价: (1)偏低:①过滤时,盛粗盐水烧杯内有残留液体;②蒸发皿、玻璃棒上留有食盐;③蒸发时没有用玻璃棒搅拌,液滴飞溅;④没有分次溶解粗盐; (2)偏高:蒸发不充分,精盐中含水分较多。 六、化肥简介 1.化肥的分类:氮肥、磷肥、钾肥、复合肥 2.化肥的作用:氮肥 → 叶、磷肥 → 根、钾肥 → 茎。 3.化肥的简易鉴别: (1)物理方法: ①看:只有氨水是液态的化肥;一般磷肥不是白色晶体; ②闻:有氨臭味的是碳酸氢铵; ③溶:氮肥、钾肥都溶于水,磷肥大部分不溶于水或部分溶于水;铵态氮肥(NH4+)溶于水时,溶液温度降低。 (2)化学方法: 加熟石灰研磨,铵态氮肥能放出具有刺激性气味的气体(有氨臭味的气体)。 七、物质的检验和鉴别 1.离子的检验和鉴别 检验和鉴别的内容 检验和鉴别的方法(或试剂)和现象 酸 (酸性溶液、H+) 1.pH试纸测定,pH<7; 2.紫色石蕊试液,溶液变红(注意不能用无色酚酞检验); 3.镁、锌、铁等活泼金属,现象是:有气泡冒出; 4.金属氧化物,如CuO,现象是:固体逐渐溶解,溶液由无色变成蓝色;如用Fe2O3,现象是:固体逐渐溶解,溶液由无色变成黄色; 5.碳酸钠等碳酸盐,现象是:有气泡产生,生成能使澄清石灰水变浑浊的气体。 碱 (碱性溶液、OH-) 1.pH试纸测定,pH>7; 2.紫色石蕊试液,溶液变蓝;无色酚酞试液,溶液变红; 3.加入CuSO4溶液,现象是:产生蓝色沉淀;如用FeCl3溶液,现象是:产生红褐色沉淀;如用NH4Cl溶液(铵盐溶液),现象是:产生能使湿润的红色石蕊试纸变蓝的气体。 盐酸 (可溶性盐酸盐、Cl-) AgNO3溶液,有白色沉淀生成;再滴加稀硝酸(酸化,避免CO32-干扰),沉淀不溶解。 硫酸 (可溶性硫酸盐、SO42-) Ba(NO3)2溶液,有白色沉淀生成;再滴加稀硝酸(酸化,避免CO32-干扰),沉淀不溶解。有时也可以用Ba(OH)2、BaCl2溶液代替Ba(NO3)2。 碳酸盐(CO32-) 1.加入稀盐酸,生成能使澄清石灰水变浑浊的气体。 2.有时可用Ba(OH)2溶液、澄清石灰水、或可溶性钙盐、钡盐溶液(如CaCl2)来检验,现象是:有白色沉淀产生。 铵盐(铵态氮肥、NH4+) 1.固态铵盐,加熟石灰研磨,现象是:有刺激性气味(氨臭味)的气体产生。 2.铵盐溶液,加入Ba(OH)2(或NaOH)溶液,加热,现象是:生成能使湿润的红色石蕊试纸变蓝的气体。 2.为什么要加入稀HNO3酸化? 要检验的离子 加入AgNO3溶液 加入稀HNO3酸化 Cl- 有白色沉淀生成 沉淀不溶解 CO32- 有白色沉淀生成 (影响Cl-的检验) 沉淀溶解 有气泡冒出 要检验的离子 加入Ba(NO3)2溶液 加入稀HNO3酸化 SO42- 有白色沉淀生成 沉淀不溶解 CO32- 有白色沉淀生成 (影响SO42-的检验) 沉淀溶解 有气泡冒出 为了避免CO32-的干扰。Na2CO3、K2CO3等可溶性碳酸盐也能与AgNO3 、Ba(NO3)2溶液反应生成白色沉淀,现象与Cl-、SO42-的相同,影响Cl-、SO42-的检验。加入稀HNO3酸化后,Ag2CO3、BaCO3等沉淀会溶解,但AgCl、BaSO4沉淀不溶解。 3.某未知溶液中SO42-、Cl-检验的方法:先检验并除去SO42-、后检验Cl-。 (1)取样,先加入Ba(NO3)2溶液和稀硝酸,若有白色沉淀生成,证明含有SO42-。 (2)过滤(1)所得混合物,在滤液中滴加AgNO3溶液,若有白色沉淀生成,证明含有Cl-。 注:①若先加AgNO3溶液,Ag+与SO42-结合生成的Ag2SO4是微溶物,也可能沉淀下来。影响Cl-的检验。所以必须先检验并除去SO42-,才检验Cl-。 ②检验SO42-只能用Ba(NO3)2溶液,不能用BaCl2、Ba(OH)2溶液,以免Ag+的干扰。 4.NaOH变质的检验 (1)NaOH变质的反应:2NaOH + CO2 = Na2CO3 + H2O (2)检验有无变质(即检验是否含有Na2CO3) 检验试剂和方法 方法1 方法2 试剂:加入足量的稀盐酸① 判断:有气泡产生,则证明NaOH已经变质 试剂:滴加澄清石灰水② 判断:若有白色沉淀生成,则证明NaOH已经变质 注:①NaOH与Na2CO3都能与稀盐酸反应,根据中和反应优先进行原则,稀盐酸先与NaOH反应,再与Na2CO3反应。如果加入的稀盐酸不足,可能检验不出Na2CO3的存在。 ②澄清石灰水、Ba(OH)2溶液、可溶性的钙盐、钡盐都能达到目的,若有白色沉淀生成,则证明NaOH已经变质。 (3)检验变质的程度 部分变质 全部变质 成分 NaOH和Na2CO3 只有Na2CO3 检验试剂和方法 方法:NaOH溶液和Na2CO3溶液都是呈碱性的,若有Na2CO3存在,无法检验NaOH。所以应先除去Na2CO3,再检验NaOH。 试剂:先加CaCl2溶液至不再产生沉淀为止③,再加无色酚酞。 判断:若有白色沉淀产生,溶液变红,则证明NaOH部分变质;若有白色沉淀产生,溶液不变红,则证明NaOH全部变质。 注:③加入可溶性钙盐、钡盐到不再产生沉淀为止。不能用稀盐酸和澄清石灰水、Ba(OH)2溶液来除去Na2CO3,以免影响NaOH的检验。NaOH + HCl = NaCl + H2O,中和反应优先,消耗NaOH;Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH,生成NaOH。 5.CaO变质的检验 (1)CaO长期露置在空气中变质:CaO + H2O = Ca(OH)2,Ca(OH)2 + CO2 = CaCO3 + H2O (2)检验CaO变质程度(只考虑是否全部变质) 部分变质 全部变质 可能成分 CaO、Ca(OH)2、CaCO3 没有CaO 检验试剂和方法 方法:检验是否存在CaO;试剂:往样品中加水 判断:若放热,放出大量水雾,则部分变质;若不放热,则完全变质。 6.Ca(OH)2变质的检验 (1)Ca(OH)2变质的反应:Ca(OH)2 + CO2 = CaCO3 + H2O(因为是固体,所以不用“↓”); (2)检验Ca(OH)2变质的程度 没有变质 部分变质 全部变质 固体成分 只有Ca(OH)2 Ca(OH)2和CaCO3 只有CaCO3 检验试剂和方法 方法:检验有无CaCO3 试剂:加入稀盐酸 现象:无气泡产生,固体溶解 试剂:滴加无色酚酞,再加入稀盐酸 现象:酚酞变红,有气泡产生 方法:检验有无Ca(OH)2 试剂:滴加无色酚酞 现象:酚酞不变红 八、需要熟记的物质的(色、味、类别) 1.常见有刺激性气味的气体:SO2、HCl、NH3 2.常见的有颜色固体 (1)黑色固体主要有:炭粉(C)、铁粉(Fe)、CuO、MnO2、Fe3O4; (2)红色固体单质:Cu、红磷;红色固体化合物:Fe2O3; (3)有色沉淀:蓝色沉淀Cu(OH)2,红褐色沉淀Fe(OH)3; (4)暗紫色固体:高锰酸钾 3.有色的溶液 (1)蓝色溶液(含有Cu2+):CuSO4、CuCl2、Cu(NO3)2。(可溶性铜盐溶液) (2)浅绿色溶液(含有Fe2+):FeSO4、FeCl2、Fe(NO3)2。(可溶性亚铁盐溶液) (3)黄色溶液(含有Fe3+):Fe2(SO4)3、FeCl3、Fe(NO3)3。(可溶性铁盐溶液) 九、单质、氧化物、酸、碱、盐之间的转化关系 纵向转化: (1)金属单质 + O2 → 金属氧化物 、、 (2)金属氧化物(可溶)+ H2O → 碱(可溶) 、 (3)碱(难溶)→ 金属氧化物(难溶) + H2O (4)酸 + 碱 → 盐 + H2O (5)非金属单质 + O2 → 非金属氧化物 、、 (6)非金属氧化物(易溶)+ H2O → 酸(易溶) (7)酸(易挥发) → 非金属氧化物 + H2O 注:从纵向来看,金属单质→金属氧化物→碱→盐,其中金属元素相同,如:Ca → CaO → Ca(OH)2 → CaCO3;非金属单质→非金属氧化物→(含氧)酸→盐,其中非金属元素相同,如:C → CO2 → H2CO3 → Na2CO3。 横向转化: (8)金属单质 + 非金属单质 → (无氧酸)盐 (9)金属氧化物 + 非金属氧化物 → (含氧酸)盐【不考】 (10)(含氧酸)盐 → 金属氧化物 + 非金属氧化物 (11)盐(可溶) + 盐(可溶) → 盐 + 盐 、 交叉转化: (12)金属氧化物 + 酸 → 盐 + H2O 、 (13)非金属氧化物 + 碱 → 盐 + H2O 、 (14)酸 + 盐 → 新酸 + 新盐 、 (15)碱 + 盐 → 新碱 + 新盐 、 (16)(活泼)金属 + 酸 → 盐 + H2 (17)金属 + 盐 → 新盐 + 新金属 1.以上17条规律的应用: ①可知某物质的性质; ②可知某物质的制法,如:(4)、(8)、(9)、(11)~(17)为盐的10种制取方法 ③可知各类物质间的相互关系。 以上规律是各物质间转化的一般规律,具体到某些物质有些规律要具体分析,未必均能适用。 2.反应规律和反应类型的关系: ①属化合反应的:(1)、(2)、(5)、(6)、(8)、(9) ②属分解反应的:(3)、(7)、(10) ③属置换反应的:(16)、(17) ④属复分解反应:(4)、(11)、(12)、(14)、(15) 规律(13)不属于任何一种基本反应类型, 初中化学中不属于任何一种基本反应类型的反应有: 非金属氧化物 + 碱 → 盐 + H2O; ; ;查看更多