- 2021-05-10 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学冲刺1
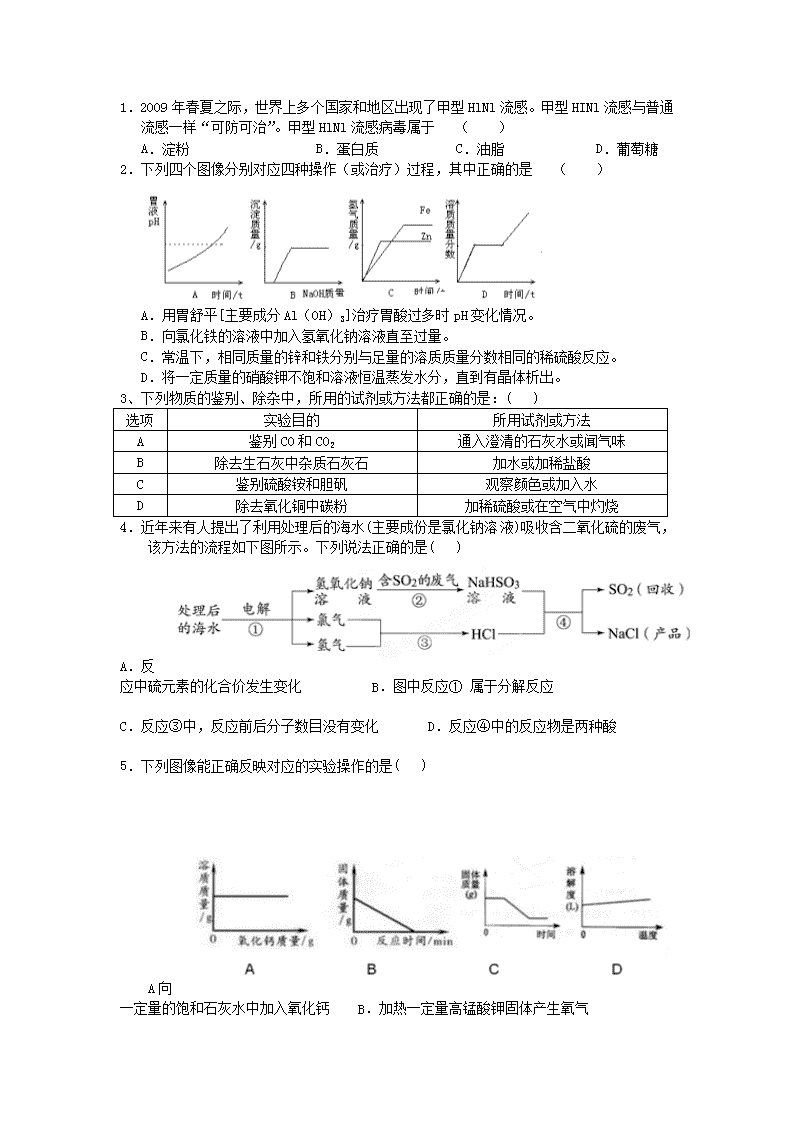
1.2009年春夏之际,世界上多个国家和地区出现了甲型HlNl流感。甲型HINl流感与普通流感一样“可防可治”。甲型HlNl流感病毒属于 ( ) A.淀粉 B.蛋白质 C.油脂 D.葡萄糖 2.下列四个图像分别对应四种操作(或治疗)过程,其中正确的是 ( ) A.用胃舒平[主要成分Al(OH)3]治疗胃酸过多时pH变化情况。 B.向氯化铁的溶液中加入氢氧化钠溶液直至过量。 C.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应。 D.将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直到有晶体析出。 3、下列物质的鉴别、除杂中,所用的试剂或方法都正确的是:( ) 选项 实验目的 所用试剂或方法 A 鉴别CO和CO2 通入澄清的石灰水或闻气味 B 除去生石灰中杂质石灰石 加水或加稀盐酸 C 鉴别硫酸铵和胆矾 观察颜色或加入水 D 除去氧化铜中碳粉 加稀硫酸或在空气中灼烧 4.近年来有人提出了利用处理后的海水(主要成份是氯化钠溶液)吸收含二氧化硫的废气,该方法的流程如下图所示。下列说法正确的是( ) A.反应中硫元素的化合价发生变化 B.图中反应① 属于分解反应 C.反应③中,反应前后分子数目没有变化 D.反应④中的反应物是两种酸 5.下列图像能正确反映对应的实验操作的是( ) A向一定量的饱和石灰水中加入氧化钙 B.加热一定量高锰酸钾固体产生氧气 C.高温煅烧CaCO3 D.O2在水中的溶解性 6、下列有关说法正确的是( ) A.实现COCO2的相互转化,都只有一种途径 B.Al可以实现单质氧化物碱 C.实现C CO的转化,都利用了碳的可燃性 D.实现H2OO2相互转化,化学反应的基本类型不同 7、如下图,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡。然后将两球分别浸没在稀H2SO4和CuSO4溶液中片刻,下列说法中正确的是 ( ) A.只有左边烧杯中溶液的质量增加 B.只有右边烧杯中溶液的质量增加 C.两边烧杯中溶液的质量都增加 D.取掉烧杯后,杠杆仍然保持平衡 8、推理是化学学习中常用的思维方法。下列推理正确的是( ) A、置换反应一定有单质生成,所以有单质生成的反应一定是置换反应; B、有机物完全燃烧都产生二氧化碳,所以有机物中一定含有碳元素; C、燃烧都伴随发光、放热,所以有发光、放热现象的就是燃烧; D、氧化物中都含有氧元素,所以含有氧元素的化合物一定是氧化物。 9、无土栽培是现代农业的一项新技术,其营养液是多种化合物的混合溶液,含有植物生长所需的营养元素。某种植物进行无土栽培时,需含氮、钾等元素的中性或弱酸性营养液,下列能用来配制营养液的一组化合物是:( ) A.KCl、(NH4)2SO4、NaOH B.NH4Cl、K2SO4 C.KNO3、H2SO4 D.K2CO3、CaCl2 10.向一定质量的AgNO3溶液中加入Cu,溶液质量与加入 Cu的质量关系如图所示,下列说法中不正确的是( ) A.a点对应溶液中的溶质有2种 B.b点对应固体只有Ag C.b~c段对应溶液中含有AgNO3 D.c点时反应已经停止 11、近日,清华学子不畏网络舆论的压力,捍卫了“PX”低毒的科学真相。PX:无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物。右图是“PX”的结构模型,下列有关“PX”的说法不正确的是 A、“PX”属于有机化合物 B、“PX”可燃,具有芳香气味,低毒都属于它的化学性质 C、“PX”中C、H两种元素的质量比为48:5 D、“PX”的化学式为C8H10 12、实验室有三瓶化肥标签脱落,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种,为鉴别三种化肥,某同学分别取少量样品编号为X、Y、Z,并进行如下实验(此处箭头表示得出实验结论) 根据上述实验,下列说法错误的是 A.X物质为尿素 B.Y物质为碳酸氢铵 C.常温下如要鉴别Y、Z两种样品,能采取闻气味的方法 D.如果实验Ⅱ中Y、Z两种样品没有另取,则会使检验结果不准确 13、现有①白菜、②大米、③鸡蛋、④花生油、⑤食盐五种食物,其中主要为人体提供能量的是____________,提供维生素的是____________,提供脂肪的是____________(填序号)。 10.化学就在我们身边,它与我们的生活息息相关.请填写物质的名称. (1)铅笔芯的主要成分是__________; (2)我国实施的“西气东输”工程输送的物质是__________; (3)食盐的成分是__________; (4)羊毛、蚕丝、头发的主要成分是__________; (5)棉、麻等天然植物纤维的主要成分是__________. (6)人体缺维生素A患_________ 缺维生素C患_________ 必须要从食物中获取的六大营养素是哪个?_________ 14、如右图装置具有多种用途,请回答: (1)当气体由a管进b管出时,可用于收集密度比空气____________的气体;当气体由b管进a管出时,能收集的气体有____________(填两种气体)。 (2)若用其干燥酸性气体,应在瓶中装入的物质是____________;若用其测定气体体积时,可在瓶中充满水,并在b处添加____________。 15、某兴趣小组在实验室发现了一块绿色的孔雀石标本,查阅资料知其主要成分是 Cu2 (OH)2 CO3。他们以Cu2 (OH)2 CO3原料制取铜,其工艺流程如下图所示: (1)过滤操作中用到的铁制仪器为 。玻璃棒的作用是搅拌和 。 (2)无色气体A的化学式是 ,大气中该气体含量不断上升,会导致 增强,全球气候变暖。 (3)写出蓝色溶液B与铁粉反应的化学方程式 (4)试剂E可选用 溶液。写出固体C与试剂E反应的化学方程式 16、氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氢气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙. 【提出问题】滤液中溶质的成分是什么? (1)【猜想与假设】 猜想一:NaOH 猜想二: 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2 经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 。 (2)【实验验证】 实验 现象 结论 实验一:取滤液,向其中滴入少量碳酸钠溶液 无明显现象 猜想 不成立 实验二:另取滤液,向其中加入 先无变化后产生气泡 猜想三成立 (3)【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是氢气和 .②登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是 . 17、A~F是六种常见物质:铁、氧化钙、盐酸、氢氧化钙、硫酸铜、碳酸氢铵中的某一种,B是胃液中的主要成分,E常用于改良酸性土壤。他们之间的相互关系如右图所示(其中实线表示物质间可以相互反应,虚线表示物质间不直接能反应)。请回答下列问题: (1)F的化学式 ,E和F有相同的用途是 。 (2)B与E反应的化学方程式为: ,该反应的基本反应类型是 反应,也称 反应。 (3)C与F反应的一个重要现象 。 (4)A不能与D直接反应,但放入D溶液中却能与D反应,能反应的原因是(用一个化学方程式表示) 。 18、某兴趣小组做以下实验探究分子的运动。请回答实验中的有关问题。 (1)实验I:在盛有少量蒸馏水的小烧杯中滴入2滴~3滴酚酞试液,再向其中滴加浓氨水。由实验I得出的结论有 , (2)实验II(如上图中甲所示):烧杯B中的现象是 ;产生这一现象的原因是 。 19、常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。某研究小组设计了下列实验装置 (所有装置的气密性良好),试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。 (1)请根据上图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中: 装置 操作方法 实验现象 图A 将充满二氧化碳的试管倒扣在水中 试管内的液面略有上升 图B 将充满二氧化碳的试管倒扣在烧碱溶液中 图C 将氢氧化钠溶液滴入烧瓶 图D 将氢氧化钠溶液滴入锥形瓶 旁边集气瓶中冒气泡 图E 将胶头滴管中氢氧化钠溶液挤入烧瓶 (2)若再分别向A.B装置的烧杯中滴入少量氯化钙溶液,将会看到的现象是: A ;B 。 (3)C中反应的化学方程式为 。 20、现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠4瓶失去标签的溶液, 分别编号为A、B、C、D。每次取少量溶液两两混合,所观察到的现象记录在下表中(“—”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成)。由此推断4瓶溶液中的溶质的化学式分别为: A. ;B. ;C. ;D. 写出上述实验过程的有关反应方程式: A+B C+D 21、碳酸钠用途非常广泛,是工业生产中重要的化工原料。在1921年我国科学家 侯德榜创造了一种著名的纯碱生产方法——“联合制碱法”。 “联合制碱法”生产过程: (1)第一步主要反应为NH3+CO2+H2O = NH4HCO3 该反应属于 反应基本反应类型。 (2)第二步用食盐与NH4HCO3反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下: 食盐水 初步处理后的粗盐水(室温) 降温 操作I 硫酸钠 盐水 精制I 过量 A 碱 过量B盐 盐水 精制II 过滤 调节pH 适量HCl 滤渣 溶解度/g 温度℃ ①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠 和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图 (如右图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图。 ②“精制I”操作中,加入过量含钙元素的碱的化学式是 。 其反应化学方程示为 。 ③“精制II”操作中,加入B盐的有关反应方程式为 。 ④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告。 实验操作 实验现象 实验结论 ⑤查阅资料得知NaCl 、NH4HCO3、 NaHCO3 、NH4Cl在30℃时的溶解度如下表所示: 温度 NH4Cl NH4HCO3 NaHCO3 NaCl 30℃ 41.1g 27.0g 11.1g 36.3g 请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: 。 (3)第三步处理制得碳酸钠,反应原理为2NaHCO3 Na2CO3+H2O+CO2↑ 29、(8分)有三种白色粉末,分别是碳酸钠、氯化铁和氯化钠中的一种。请设计一个实验方案,把这三种粉末区分开来。叙述实验操作、预期现象和结论。 实验操作 预期现象与结论 22.下面是实验室的常用仪器。请回答下列问题: ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ (1)写出有标号的的仪器名称:② ③ ⑧ (2)请选择上述仪器的序号填空:制取一瓶CO2且随时控制气体的发生与停止用到的仪器是 ;用KMnO4制取一瓶较纯净的氧气用到的仪器是 , 其化学方程式为__________________________________________。 (3)如右A图,贮气瓶中已装入X气体,现开启分液漏斗活塞,将水放入贮气瓶中,导出气体作燃烧实验,并用干燥的小烧杯、底部涂有澄清石灰水的小烧杯轮换罩在火焰上方观察现象。若X气体为CH4、H2、CO中的一种气体,则:当烧杯底部只有水雾、澄清石灰水不变浑浊,则证明X气体是 ;当烧杯底部没有水雾、澄清石灰水变浑浊,则证明X气体是 ;当烧杯底部既有水雾、澄清石灰水也变浑浊,则证明X气体是 。 A B (4)如果要将A图中的X气体导出,得到干燥气体进行其它实验,应在贮气瓶与尖嘴管间加装一个气体的干燥装置,请你将B图补画完善为气体干燥装置,并在横线上填写应装入的试剂名称。 23.有1包粉末,可能由C、CuO、Fe三种物质中的一种或几种组成。某同学为了探究它的成分,按如下步骤进行实验。 (1)先对实验做了如下设想和分析。取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况)。请你完成下表。 烧杯中可能出现的现象 结论 ① 只含C ② 含C、CuO ③有黑色不溶物,有气泡逸出,溶液呈浅绿色 (2)通过实验及分析,确定该粉末为C、CuO的混合物。为了进一步探究C、CuO的性质,他又利用这种混合物补充做了下面两个实验。 实验1将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。烧杯中 (填“有”或“元”)不溶物,溶液呈 颜色。 实验2 将此粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。请回答:①烧杯中 (填“有”或“无”)不溶物; ②若静置后溶液呈无色,则该溶液中溶质是 (写化学式); ③若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式为 、 。 24、在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气。某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出。加水的质量与剩余固体的质量见下表:(MnO2不溶于水) 编号 1 2 3 4 加水的质量(g) 10 10 10 10 剩余固体的质量(g) 7.25 4.05 m 3 试求:(1)表中m值为___________。 (2)所制得氧气的质量。 25.小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但有同学告诉她菠菜不能与豆腐同 [发现问题]菠菜为什么不能与豆腐同食? [查阅资料]a.制作豆腐需要加入石膏(主要成分:CaSO4); b.菠菜中含有草酸、草酸盐等成分; c.草酸钙是一种既不溶于水也不溶于醋酸的白色固体,是诱发人体结石的物质之一. [提出猜想]菠菜与豆腐同食可能会产生人体不能吸收的沉淀物. [设计实验] 实验步骤 实验现象 实验结论 ①将菠菜在少量开水中煮沸2~3min,取l~2mL滤液于试管中,并滴加少量__________溶液. 产生白色沉淀 有草酸钙生成 ②在步骤①的沉淀物中加入过量醋酸 沉淀部分溶解,且产生气泡 被溶解的沉淀一定不是__________ __________ [发现新问题]被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究: 实验步骤 实验现象 实验结论 ③将步骤②产生的气体通入__________ __________中 __________ __________ 产生的气体是__________; 步骤②被溶解的沉淀是碳酸钙 [反思与应用]家庭中常常将菠菜放在开水中烫过后再烹饪,其目的是__________. 26.现有三种常用化肥,分别是碳酸氢铵、氯化铵和硫酸钾.小周对此开展识别化肥的探究活动,步骤如下: 第一步:取上述三种研细的化肥各少量,分盛于三支试管中,均滴入少量盐酸.有气泡放出的是__________(写化学式),无明显现象的是氯化铵和硫酸钾. 请完成碳酸氢铵与盐酸反应的化学方程式,并指出反应类型: NH4HCO3+HCl=NH4Cl+__________+__________反应类型__________ 第二步:另取少量氯化铵和硫酸钾两种化肥,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的是__________,无明显现象的是__________.写出生成白色沉淀是发生反应的化学方程式:__________. 27.图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空): 【查阅资料】 (1)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致; (2)酒石酸是一种易溶解于水的固体有机酸; (3)Na2CO3受热不分解. 【提出问题】 NaHCO3在发酵粉加水或加热时如何产生CO2? 【猜想】 甲:… 乙:酒石酸与NaHCO3在溶液中反应产生CO2 丙:NaHCO3加热产生CO2 【实验探究】 (1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是__________. 小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是__________; (2)小英同学为探究猜想丙设计了右图所示的实验装置: 小英另取适量NaHCO3粉末加入a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊.b试管中反应的化学方程式为__________. 持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是__________. 【小结】 NaHCO3在发酵粉中产生CO2的条件是__________; NaHCO3受热发生变化的化学方程式为:__________. 19.(8分)某化学小组围绕燃烧与灭火的主题开展了相关活动,请你参与完成: (1)可燃物燃烧的必备条件是_________________________、____________________________。 (2)改进后的装置(如图二)与图一相比,其优点是____________________________。欲使图二中的红磷着火,可将试管从水中取出并___________________后才能对试管加热。 (3)将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是______________。 (4)“水火不相容”是指水能灭火,其实水有时也可以“生火”,比如钾遇水会立刻着火,因为钾遇到水生成H2和一种碱,该反应是_______________(填“吸热”或“放热”)反应,其反应化学方程式为________________________________________________。 28、 某兴趣小组同学对实验室制取氧气的条件进行如下探究实验. (1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验: Ⅰ.将3.0g KClO3与1.0gMnO2均匀混合加热 Ⅱ.将χg KClO3与1.0gCuO均匀混合加热 在相同温度下,比较两组实验产生O2的快慢. Ⅰ中反应的化学方程式是______________________________;Ⅱ中χ的值为____________。 (2)乙探究了影响双氧水分解速度的某种因素,实验数据记录如表: 双氧水的质量 双氧水的浓度 MnO2的质量 相同时间内产生O2的体积 Ⅰ 50.0g 1% 0.1g 9mL Ⅱ 50.0g 2% 0.1g 16mL Ⅲ 50.0g 4% 0.1g 31mL 实验中,测量O2的装置是_____________(填序号)。 实验结论:在相同条件下,_________________________,双氧水分解越快。 29、实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究: (1)【猜想】 猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH; 猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。 则CaO与水反应的反应方程式为:________________________________。 (2)【实验】如下图所示: (3)【判断】 ①若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ________(填“成立”或“不成立”)。 ②操作④发生化学反应的化学方程式为:__________________________;由操作⑤⑥的现象判断:滤液中含有__________(写化学式);由此判断猜想Ⅰ____________(填“成立”或“不成立”)。 ③综合①和②的结论,判断该样品变质情况为____________。 (4)【拓展】由上述实验说明,实验室中“碱石灰”应____________保存;操作③中玻璃棒的作用是__________________________________。 30、常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。 (1)试管尾部放一团湿棉花的目的是_______________。 (2)探究生成的气体是什么? 用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是_________。 (3)探究试管中剩余固体成分是什么? 【查阅资料】 常见铁的氧化物 FeO Fe2O3 Fe3O4 颜色、状态 黑色粉末 红棕色粉末 黑色晶体 能否被磁铁吸引 否 否 能 【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。 【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。 【实验探究】 实验操作 实验现象及结论 【实验结论】铁和水蒸气反应的化学方程式为___________________________________。 【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。 【 拓展 】 把赤铁矿冶炼成铁,其主要反应原理是在高温下,一氧化碳夺取铁矿石里的氧,将铁还原出来,请写出化学反应方程式:______________________________________。 31、某混合溶液可能含Na2SO4、Na2CO3、NaOH中的一种或几种溶质,为验证其组成,实验如下: 混合溶液 无色气体 无色溶液 +过量 HCl溶液 +过量Ba(NO3)2 溶液 白色沉淀 无色溶液 +无色酚 酞溶液 无明显现象 ① ② ③ (1)混合溶液的溶质中一定有_________________、________________。 (2)按该加入试剂的顺序,不能验证的物质是_________________,写出验证过程中②所发生的反应方程式_______________________________; (3) 改变上述三步骤中所用三种试剂的滴加顺序,可以验证是否有这种物质,则这三种试剂滴加的顺序依次为__________________(填写序号) (4)步骤①中加入的盐酸为什么要“过量” ; 32、过氧化钠(Na2O2)可用作呼吸面具的供氧剂.实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究. 【查阅资料】1.过氧化钠能与空气中水和二氧化碳反应生成氧气: 2Na2O2+2H2O=4NaOH+02↑, 2Na202+2C02==2Na2CO3+O2. 【提出问题]1.过氧化钠是否变质? 【猜想与假设】 假设1:过氧化钠未变质; 假设2:过氧化钠部分变质; 假设3:过氧化钠全部变质. 【实验探究】 【提出新问题】部分变质的过氧化钠中是否含有氢氧化钠? 【实验探究】③ 取少量①中溶液于试管中,加人足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液变红. 【定性分析】 (1)由实验③可以确定①中溶液含有的溶质是___ ____(填化学式); (2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钠,理由是_________。 【定量研究】称取6.04g的过氧化钠样品于锥形瓶中,加入足量的蒸馏水,共收集到气体0.64g,再向上述锥形瓶中加入足量的澄清石灰水,充分反应后,经过沉淀、过滤、干燥等,得到固体2.00g。 (1)写出加入澄清石灰水的反应方程式_____________________ (2)6.04g上述样品中,含氢氧化钠的质量_______________。 【反思与提高】过氧化钠长期暴露在空气中,最终会变质为 (填化学式) 33、在20mL溶质质量分数为1.60%的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜和氢氧化钠的反应),用电导仪测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如下图所示(假设所有稀溶液的密度均为l g/cm3) (1) 硫酸铜和氢氧化钡溶液发生反应的化学方程式为: : (2) 图I中C点所示溶液中,含量较多的微粒有: , D点所示溶液能导电是因为溶液中含有 ; (3) 从图II中可知:将打磨过的铝片放入上述该硫酸铜溶液中,可以观察到的现象是: ;如有固体析出,请写出反应的化学方程式 。 34、 某校化学兴趣小组对1瓶溶液进行分析,初步确定它是含有同种阴离子的M、N混合液,继续分析的步骤如下(每一步骤都充分反应): 请根据过程及现象回答下列问题: (1)若没有产物A,则M、N可能是 和 (写化学式);步骤①中发生反应的化学方程式是 ;滤液中的溶质是 (写化学式)。 (2)若有产物A,且A是一种常见的复合肥,则M、N可能是 和 (写化学式)。 35、某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究: HCll Ca(OH)2)2 石蕊 酚酞 【提出问题】这瓶溶液是什么溶液? 【获得信息】实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠 【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液; 猜想三:碳酸钠溶液。 【实验推断】 (1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能 是 溶液,理由是 ; (2)小刚另取样滴加稀盐酸有 产生,反应的化学方程式为 ,小刚得出结论:该溶液是碳酸钠溶液。 (3)小青认为小刚的结论不完全正确,理由是 。小组同学讨论后一致认为还需要进行如下实验: 【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ;静置后,取上层清液,滴入酚酞试液,溶液呈红色。 【实验结论】这瓶溶液是 。 【探究启示】实验取完药品后应 。 【拓展迁移】若氢氧化钠溶液与盐酸发生中和反应,恰好完全反应的微观过程如右图所示,反应的实质表达式为:H+ + OH- = H2O,则反应后溶液中存在的阴、阳离子是 、 (填离子符号); 请写出【继续探究】实验中加CaCl2溶液反应的实质表达式: (仿照上例,用离子符号表示。)查看更多