- 2021-05-10 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
北京中考化学各区一模科学探究
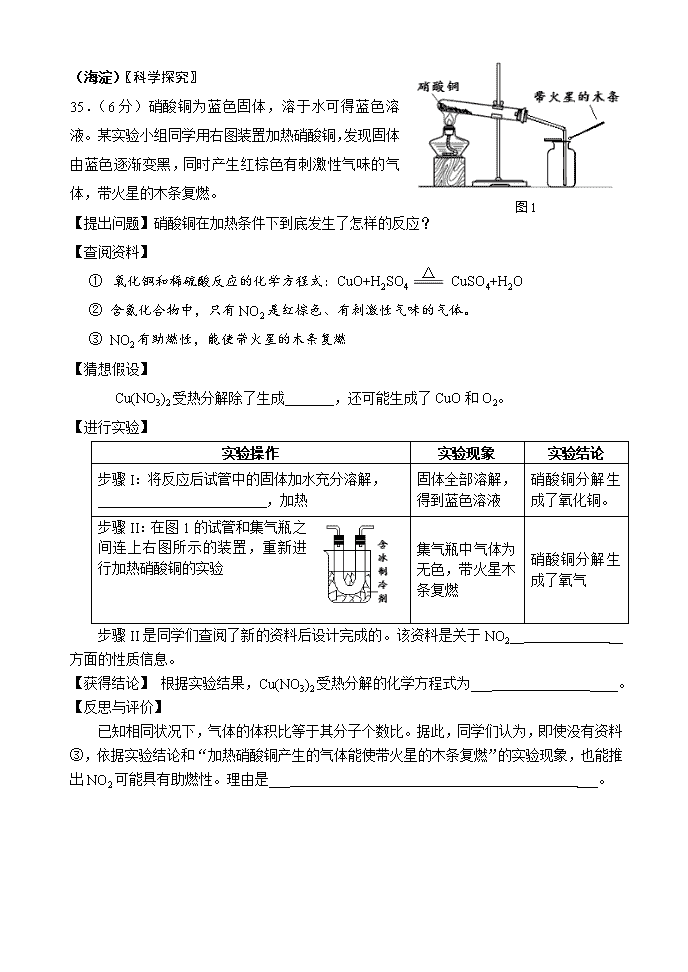
2015科学探究 (朝阳)36.(6分)化学小组同学取一定量碳酸钙固体高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究。 【提出问题】剩余固体成分是什么? 【查阅资料】工业上通常采用高温煅烧石灰石的方法制生石灰, 化学方程式为:CaCO3高温CaO+CO2↑。 【猜想与假设】剩余固体成分: I.全部是氧化钙 Ⅱ. Ⅲ.全部是碳酸钙 在老师指导下,小组同学设计如下实验,探究上述猜想是否成立。 【进行实验】 ①甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立。乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是 。 ②乙同学取一定量的剩余固体于试管中,加入一定量的水,触摸试管外壁感觉发热,继续向试管中加入几滴稀盐酸,没有气泡产生。乙同学据此认为试管中的固体只有氧化钙,即猜想I成立。丙同学认为乙的实验不足以证明猜想I成立,理由是 。 ③丙同学利用水、无色酚酞溶液和稀盐酸证明了猜想Ⅱ成立,请完成实验报告。 实验步骤 实验现象 实验结论 猜想Ⅱ成立 【反思拓展】 工业制生石灰的过程中同时得到副产品二氧化碳。下列用途是利用二氧化碳化学性质的是 。 A.气体肥料 B.制干冰 C.制纯碱 D. 制碳酸饮料 (西城)33.(7分)课外小组同学进一步研究铁与氧气的反应。 【提出问题】铁丝燃烧时为什么会有“火星四射”的现象? 【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。 【进行实验】探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系。 实验 现象 解释与结论 实验1:取直径0.20 mm、含碳0.1% 的铁丝,在氧气中燃烧 零星的火星四射 ① 铁燃烧的化学方程式是 ② 0.20 mm的铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为 实验2:取直径0.20 mm、含碳0.32%的铁丝,在氧气中燃烧 较明显的火星四射 实验3:取直径0.20 mm、含碳0.52%的铁丝,在氧气中燃烧 【提出问题】纯铁在氧气中燃烧溅落的“黑色固体”是什么? 【查阅资料】 ①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO易被氧化) ②铁的氧化物均能溶于酸溶液 【进行实验】测定黑色固体的成分。 实验 现象及数据 解释与结论 实验4:将冷却后的黑色固体碾碎,装入试管,加入 溶液 现象是 铁燃烧时溅落下来的黑色 固体中含有铁 实验5:取2.8 g纯铁在氧气中燃烧,收集溅落的黑色固体,干燥并称其质量 黑色固体质量为3.44 g 黑色固体的组成及质量 为 【实验拓展】 同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验。若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360 mL的集气瓶中加水,水的体积约为_ ____mL。 (海淀)〖科学探究〗 图1 35.(6分)硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用右图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。 【提出问题】硝酸铜在加热条件下到底发生了怎样的反应? △ 【查阅资料】 ① 氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4 CuSO4+H2O ② 含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。 ③ NO2有助燃性,能使带火星的木条复燃 【猜想假设】 Cu(NO3)2受热分解除了生成_______,还可能生成了CuO和O2。 【进行实验】 实验操作 实验现象 实验结论 步骤I:将反应后试管中的固体加水充分溶解, ,加热 固体全部溶解,得到蓝色溶液 硝酸铜分解生成了氧化铜。 步骤II:在图1的试管和集气瓶之间连上右图所示的装置,重新进行加热硝酸铜的实验 集气瓶中气体为无色,带火星木条复燃 硝酸铜分解生成了氧气 步骤II是同学们查阅了新的资料后设计完成的。该资料是关于NO2__ __方面的性质信息。 【获得结论】 根据实验结果,Cu(NO3)2受热分解的化学方程式为___ ____。 【反思与评价】 已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是___ ___。 (丰台)35.(6分)在学习碱的化学性质时,某小组同学进行了如图所示的实验。 Ⅰ.探究碱的化学性质 ①实验甲,随着稀盐酸的不断滴入,观察到溶液由红色变为无色; ① 实验乙滴加氢氧化钠溶液后,观察到的气球变鼓; ② 实验丙观察到试管内有白色沉淀产生,发生反应的化学方程式为 。 Ⅱ.探究废液成分 实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问。 【提出问题】废液中含有哪些物质? 【查阅资料】BaCl2溶液呈中性且Na2CO3 +BaCl2 ==BaCO3↓ +2NaCl 【讨论交流】 ① 废液中一定含有的物质:碳酸钙、指示剂、水和 ; ②还含有能使废液呈碱性的物质,同学们有如下猜想: 猜想1:碳酸钠; 猜想2:氢氧化钠; 猜想3:氢氧化钠和碳酸钠;猜想4:氢氧化钠和氢氧化钙。 【查阅资料】BaCl2溶液呈中性,Na2CO3+BaCl2=BaCO3↓+2NaCl 【实验设计】 同学们认为需要先验证猜想4是否成立,所需要的试剂是 。 若猜想4不成立,则需要进行后续实验,请你完成表格。 实验操作 预计现象 预计结论 猜想1正确 若没有白色沉淀,溶液呈红色 猜想2正确 猜想3正确 【进行实验】同学们进行实验,通过观察实验现象,得出了猜想2成立。 【反思拓展】分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否有剩余。 (大兴)36. 小明在做实验时,不小心将镁条掉入到碳酸氢钠溶液中,发现产生大量的气泡和白色不溶物。他非常好奇,进行了如下探究。 【提出问题】镁条与碳酸氢钠溶液反应,产生的气体和白色不溶物分别是什么? 【查阅资料】 ① MgHCO3能溶于水;Mg(OH)2、MgCO3难溶于水。 ② Mg(OH)2、MgCO3受热易分解,分别生成两种氧化物。 ③ 碱石灰的主要成分为氧化钙和氢氧化钠。 【作出猜想】 小明认为白色不溶物的组成存在3种可能,分别为 。 【进行实验】 (1)探究镁条与碳酸氢钠溶液反应产生什么气体 实验操作 实验现象 ①点燃产生的气体 气体燃烧,产生蓝色火焰 ②火焰上罩内壁涂有石灰水的烧杯 无现象 通过上述实验得到的结论是 。 (2)探究镁条与碳酸氢钠反应后产生的白色不溶物中是否含有MgCO3 实验操作及现象 实验结论 白色不溶物中一定含有MgCO3 (3)定量测定白色不溶物的组成 在老师的帮助下,小明设计了如下装置进行实验。 ① C中碱石灰的作用是 。 ② 若白色不溶物为22.6g,实验前后装置A增重1.8g,装置B增重8.8g,则该白色不溶物的组成及质量比为 。 (怀柔)35.(5分)维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。化学课外小组应用实验方法测定橙汁、果味饮料中维生素C的含量。 实验目的:测定不同饮料中维生素C的含量。 查阅资料:学科网学科网 (1)维生素C是一种无色易溶于水的有机物,其水溶液呈弱酸性,能使碘水褪色; (2)淀粉遇到碘水变蓝色。 实验试剂:碘水、淀粉溶液、已知浓度(7.5mg/100mL)的标准维生素C溶液、蒸馏水网 实验过程:学科网 步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。学科网 步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数。 实验记录:学科网 测定物质 ① ② ③ ④ 滴入碘水的数量(滴) 1 8 15 5 试回答下列问题: (1)当橙汁滴入碘水15滴前后的颜色变化是 ,测得它的维生素C的含量为 。学科网学科网科网 (2)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。学科网 A.每次实验所用饮料的颜色不同 B.每次量取的被测试物质的体积不同学科网 C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水 (3)反思与评价:①实验中所用的淀粉溶液的作用是 。 ②标准维生素C溶液的作用是 。 (石景山)36.(6分)实验小组研究碳酸钠和碳酸氢钠的性质。 实验一:甲、乙、丙三位同学分别用溶质质量分数为5%的NaHCO3溶液和Na2CO3溶液进行了如下实验。 实验内容 NaHCO3溶液 Na2CO3溶液 (1)加入无色酚酞溶液 溶液变红 溶液变红 (2)加入澄清石灰水 产生白色沉淀 现象Ⅰ (3)加入5%的CaCl2溶液 产生白色沉淀、有气泡产生 产生白色沉淀 (4)加入稀盐酸 现象Ⅱ 有气泡产生 (5)加热溶液,并用导管与澄清石灰水连接 石灰水变浑浊 石灰水无明显变化 (1)表中的现象Ⅰ为 ;用化学方程式表示现象Ⅱ的原因 。 (2)若要鉴别实验中用到的NaHCO3和Na2CO3两种溶液,实验一中提供了 种方法。 实验二:甲、乙、丙三位同学分别将各自实验一中NaHCO3溶液与澄清石灰水反应后的物质进行过滤,对滤液中的溶质成分进行了如下探究。 【查阅资料】 (1)氯化钙溶液显中性,与氢氧化钠溶液不反应。 (2)两种溶液的取用量不同,滤液中溶质的组成情况可能有:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH。 【进行实验】 实验操作 实验现象 实验结论 甲同学 取少量滤液于试管中,滴加足量的稀盐酸 有气泡产生 滤液中的溶质一定含有Na2CO3 乙同学 取少量滤液于试管中,向其中通入少量CO2 产生白色沉淀 则滤液中的溶质是 丙同学 取少量滤液于试管中,塞紧胶塞,并用导管与澄清石灰水连接,加热 澄清石灰水变浑浊 则滤液中的溶质是Na2CO3和NaHCO3 【反思与评价】 (1)根据丙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是 。 (2)甲同学进一步实验,确定了滤液中的溶质是Na2CO3和NaOH。其实验方案是 。 (顺义)35.(6分)科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图所示)。 化学小组的同学对此非常感兴趣,在老师的指导下,设计如下装置探究上述设想的反应原理是否可行。 (1)证明装置A能“释放CO2”的现象是 ,“释放CO2”的化学方程式为 。 (2)装置B在该设计中的作用是 。 (3)上述实验后,小组同学还需进行的实验操作是 。 (4)其中证明能捕捉到二氧化碳的现象是 。 (5)对该“捕捉”、“释放”CO2的过程,你还想继续探究的问题是 。 (门头沟)35.(6分)某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行探究。 【查阅资料】(1)Na2O2化学性质很活泼,能与水、二氧化碳反应,相关化学方程式为:2Na2O2+2H2O=4NaOH+O2↑ ; 2Na2O2+2CO2=2Na2CO3+O2。 (2) Na2CO3溶液于中性的CaCl2溶液能发生复分解反应。 【猜想】Ⅰ:固体为Na2O2、NaOH、Na2CO3的混合物 Ⅱ:固体为NaOH和Na2CO3的混合物 Ⅲ:固体为NaOH Ⅳ:固体为Na2CO3 【实验探究】 实验操作 实验现象 实验结论 ①取少量固体于试管中,加水振荡,直至完全溶解。 无气泡产生 ②取少量①中的溶液于试管中,滴加CaCl2溶液。 _________ 证明有Na2CO3存在 ③___________________________________________ ___________ 证明有NaOH存在 综合以上实验现象,说明猜想 是成立的。 【反思评价】固体Na2O2应 保存 (通州)35.某化学兴趣小组的同学对能制氧气的呼吸面具进行研究。 [查阅资料] (1)呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2)。过氧化钠分别能和二氧化碳、水反应,都生成氧气,反应的化学方程式为: ①2Na2O2 + 2H2O ═ 4NaOH + O2↑ ②2Na2O2 +2CO2 ═ 2Na2CO3 + O2 (2)氯化钙溶液呈中性;碳酸钠溶液呈碱性; 氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+ CaCl2 ═ CaCO3↓ + 2NaCl。 同学们对用过一段时间后的面具中的固体成分产生兴趣。 [猜想与假设] 固体可能为:①Na2CO3;②NaOH和Na2CO3;③Na2O2和Na2CO3;④ 。 为了确定用过一段时间后呼吸面具中的成分,该小组的同学在老师的指导下进行了以下的探究。 [进行实验] 实验Ⅰ:取少量固体放入试管中,加足量水,看到 ,证明固体中有Na2O2。 实验Ⅱ:取少量固体放入试管中,滴加足量的稀盐酸,产生大量气泡,则证明固体中含有Na2CO3。 实验Ⅲ:取少量固体放入试管中,加足量水,再滴加足量的氯化钙溶液后,过滤。向滤液中加入酚酞试液,若溶液变成 ,则证明固体中含有NaOH。 [反思与评价] 通过上述实验,有些同学认为其中有些不妥的结论。 (1)有些同学认为通过实验Ⅱ并不能确定固体中含有Na2CO3。如何改进此实验? 。 (2)还有些同学认为通过实验Ⅲ也不能证明固体中一定含有NaOH。其原因是: 。 科学探究 2015朝阳答案 36.(6分) 【猜想与假设】Ⅱ.氧化钙和碳酸钙 【进行实验】 ①氧化钙与水反应生成的氢氧化钙微溶于水,也可能出现白色不溶物 ②即使有碳酸钙,加入的少量稀盐酸先消耗氢氧化钙,也不会出现气泡 ③(合理给分) 实验步骤 实验现象 取少量剩余固体于试管中,加水 振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 溶液变红 有气泡产生 (4)A、C、D 2015西城答案 点燃 33. (7分) 实验3:明显的火星四射 ① 3Fe +2O2 Fe3O4 ②含碳量越高,火星四射的现象越明显 实验4:稀盐酸 有气泡产生 实验5: Fe和Fe3O4质量分别为1.12 g、2.32 g 【实验反思】270 2015年海淀答案 35.(6分) [猜想假设] NO2[进行实验]①过滤,洗涤,向滤渣中加入足量稀硫酸 ②NO2的沸点(或低温下NO2能否反应生成液态或固态物质) [获得结论] 2Cu(NO3)22CuO+4NO2↑+ O2↑ [分析及反思]硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性(此空2分,、、 答对任意一处即给1分,三处答全给2分) 2015丰台答案 35.(6分)(1)Na2CO3 +Ca(OH)2 ===CaCO3↓ +2NaOH (2)氯化钠或NaCl (3)碳酸钠溶液或二氧化碳 实验内容 预计现象 (4)取少量废液缸中上层清液于试管中,加入过量氯化钡溶液,静置。 (5)有白色沉淀,溶液无色 (6)有白色沉淀,溶液呈红色 2015大兴答案 36.【作出猜想】 Mg(OH)2 ;MgCO3 ;Mg(OH)2和 MgCO3 【进行实验】 (1)镁条和碳酸氢钠溶液反应产生的气体为氢气。 (2)将反应后的浊液过滤,洗涤滤渣,向滤渣中加入稀盐酸,有气泡产生,将产生的气体通入到澄清的石灰水中,石灰水变浑浊。 (3)① 防止空气中的水和二氧化碳进入装置B中。 ② Mg(OH)2和MgCO3,质量比为29∶84 2015怀柔答案 35.(5分)(1)黄色变为蓝色;14.1 mg/100mL网科网 (2)AD学科网 (3)①证明维生素C是否存在。②是维生素C含量的参照标准 2015石景山答案 36.(6分) 实验一: (1)产生白色沉淀 NaHCO3 + HCl === NaCl + H2O + CO2↑ (2)2 实验二: 乙同学的实验结论:NaOH和Ca(OH)2 (1)2NaHCO3 + Ca(OH)2 === CaCO3↓+ Na2CO3 +2H2O (2)取甲反应后的滤液于试管中,向其中加入过量的5%CaCl2溶液,没有气泡产生;过滤,再向滤液中滴加无色酚酞溶液,溶液变为红色。 2015顺义答案 高温 35.(6分) (1)C中澄清石灰水变浑浊 CaCO3 === CaO + CO2↑ (2)防止C中石灰水倒吸炸裂玻璃管 (3)取D中反应后固体3于试管中,滴加稀盐酸 (4)有气泡产生 (5)该捕捉过程中二氧化碳的捕捉效率是多少 2015通州答案 35.【猜想与假设】④Na2O2、NaOH和Na2CO3 【进行实验】 实验Ⅰ:固体溶解,有气泡 实验Ⅲ:红色 【反思与评价】 (1)取少量固体放入试管中,滴加足量的稀盐酸,产生大量气泡,再通入澄清的石灰水,若变浑浊。则证明固体中含有Na2CO3[或取少量放入试管中,再滴加足量的氯化钙溶液(或石灰水),若变浑浊,则证明固体中含有Na2CO3;或取少量固体,加入足量水充分溶解至不再产生气泡,再加入稀盐酸,产生气泡,则有Na2CO3]。 (2)固体中若含有Na2O2加水时会产生NaOH,所以,不能证明固体中一定含有NaOH。 2015门头沟答案 35.(6分) ①猜想Ⅰ不成立 ②产生白色沉淀 ③取少量①中的溶液于试管中,加入过量CaCl2溶液使沉淀完全,静置后,向上层清液中滴加酚酞试液。 酚酞试液变红 Ⅱ 密封 高温 35.(6分) (1)C中澄清石灰水变浑浊 CaCO3 === CaO + CO2↑ (2)防止C中石灰水倒吸炸裂玻璃管 (3)取D中反应后固体3于试管中,滴加稀盐酸 (4)有气泡产生 (5)该捕捉过程中二氧化碳的捕捉效率是多少查看更多