2018年山东省济南市中考化学模拟试卷
2018年山东省济南市中考化学模拟试卷
一、选择题(下列各题只有一个正确选项)
1. 下列有关物质的性质和用途,不存在对应关系的是( )
A.干冰升华 人工降雨 B.大理石硬度大 建筑材料
C.钢铁熔点高 金属导线 D.过氧化氢易分解 制取氧气
2. 日常生活中的下列做法,一定含有化学变化的是( )
A.用胶带粘合破损书画 B.用白醋泡制软皮鸡蛋
C.用钢丝球擦除灶具污渍 D.用汽油清洗衣服油污
3. 从分子、原子角度对下面一些现象和变化的解释,合理的是( )
A.花香四溢 分子很小,质量也很小
B.热胀冷缩 温度变化,分子或原子大小发生变化
C.滴水成冰 温度降低,分子间隔变小,停止运动
D.食品变质 分子发生变化,分子性质发生变化
4. 下列物质的分类,不正确的一组是( )
A.H2O、MgO、H2CO3 都属于氧化物
B.H2S、H2SO3、H2SO4 都属于酸
C.NaOH、Ca(OH)2、Fe(OH)2 都属于碱
D.NaCl、Na2CO3、NaHCO3 都属于盐
5. 下列化学方程式书写和对反应类型的判断,都正确的是( )
A.4Fe+302点燃¯2Fe2O3 化合反应
B.Cu+2AgCl=2Ag+CuCl2 置换反应
C.SiO2+3C高温¯SiC+2CO↑ 置换反应
D.BaCO3+2HCl=BaCl2+H2O+CO2↑ 复分解反应
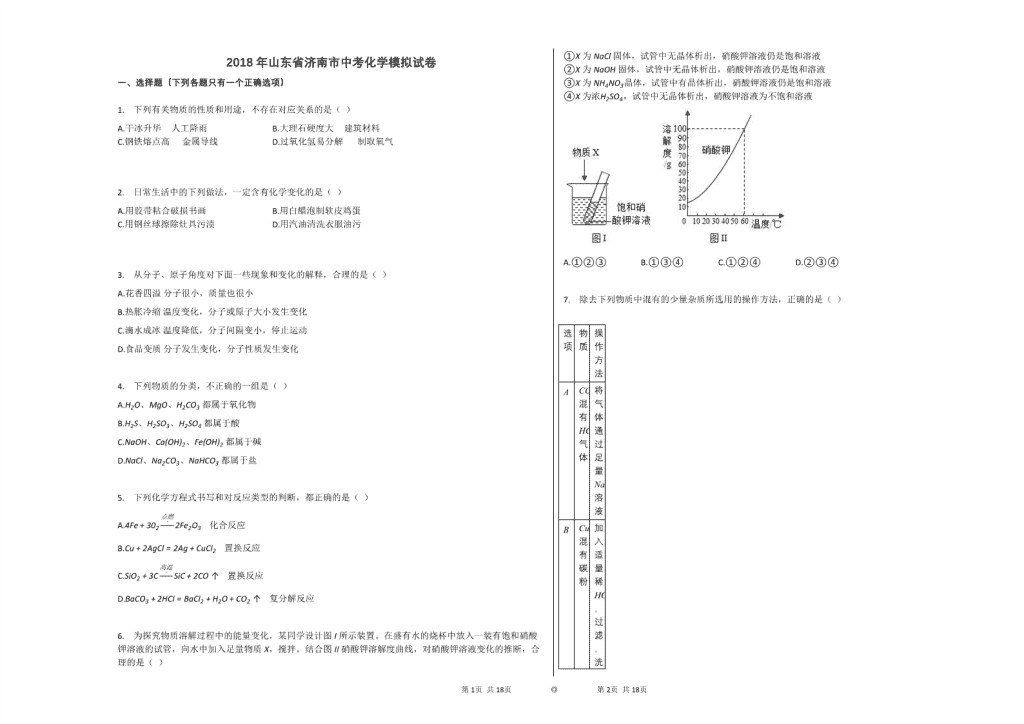
6. 为探究物质溶解过程中的能量变化,某同学设计图I所示装置。在盛有水的烧杯中放入一装有饱和硝酸钾溶液的试管,向水中加入足量物质X,搅拌。结合图II硝酸钾溶解度曲线,对硝酸钾溶液变化的推断,合理的是( )
①X为NaCl固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
②X为NaOH固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
③X为NH4NO3晶体,试管中有晶体析出,硝酸钾溶液仍是饱和溶液
④X为浓H2SO4,试管中无晶体析出,硝酸钾溶液为不饱和溶液
A.①②③ B.①③④ C.①②④ D.②③④
7. 除去下列物质中混有的少量杂质所选用的操作方法,正确的是( )
选项
物质
操作方法
A
CO2混有HCl气体
将气体通过足量NaOH溶液
B
CuO混有碳粉
加入适量稀HCl,过滤,洗涤,干燥
C
NaCl溶液混有CaCl2
加入过量Na2CO3溶液、过滤
D
Cu(NO3)2溶液混有CuCl2
加入适量AgNO3溶液、过滤
A.A B.B C.C D.D
第13页 共16页 ◎ 第14页 共16页
8. 分别向50g FeSO4和CuSO4溶液中,加入一定质量Mg粉恰好完全反应。随Mg粉消耗,Mg粉与溶液中FeSO4、CuSO4的质量变化见图。请读取图象信息并结合金属活动性顺序分析,下面说法不合理的是( )
A.反应前,溶液中溶质质量分数:FeSO4
B
9. 通过物质间相互反应可以实现物质间的相互转化。下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
10. 不使用其它试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是( )
A.H2SO4、Na2SO4、BaCl2、FeCl3
B.BaCl2、HCl、NaNO3、AgNO3
C.Na2CO3、HNO3、NaNO3、BaCl2
D.H2SO4、NaOH、MgCl2、Ba(NO3)2
二、填空题
高锰酸钾用途广泛,医药上可用作消毒剂、杀毒剂,实验室也经常使用高锰酸钾制取氧气。请按要求完成下面问题:
(1)高锰酸钾的化学式________;
(2)高锰酸钾中锰元素的化合价________;
(3)高锰酸钾中阳离子的符号________;
(4)高锰酸钾中阴离子的符号________。
镓是一种奇妙的金属,放在手心马上熔化,犹如荷叶上的水珠流来流去。请阅读信息后回答:
(1)金属镓________ (填物理性质);
(2)镓原子结构示意图中X的数值________;
(3)镓的氧化物的化学式________;
(4)氮化镓(GaN)是第三代半导体材料,一般采用GaCl3与NH3在一定条件下反应制得,同时得到另一种化合物。该反应的化学方程式为________。
海水晒制粗盐的主要成分为NaCl,还含有少量的MgCl2、CaCl2、MgSO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:
请分析上面流程图示,回答:
(1)为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作I中依次加入的物质(过量)和顺序,合理的是( );
A.NaOH、BaCl2、Na2CO3 B.Ba(NO3)2、Na2CO3、NaOH
C.Na2CO3、BaCl2、NaOH D.BaCl2、NaOH、Na2CO3
(2)操作I过量加入各物质的目的是________;
(3)为获取较纯净精盐,操作Ⅱ的具体方法是________。
某工业园区甲、乙两化工厂排放的废水中含有K+、Cu2+、Fe3+、Cl−、OH−、NO3−六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来严重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水呈碱性。
第13页 共16页 ◎ 第14页 共16页
(1)甲厂废水中一定含有的离子是________,可能含有的离子是________;
(2)经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是________(填离子符号),过滤后的废水中主要含有________两种物质(填化学式),处理后的废水符合排放标准。
洗洁精是家庭必备的清清用品,可迅速分解油腻、去污、除菌,有味道淡雅、洁净温和、泡沫柔细低残留的优点。洗洁精的有效成分是表面活性剂,还含有泡沫剂、香精、水、色素等多种成分。请回答:
(1)洗洁精去除油污的有效成分是________;
(2)洗洁精去除油污的原理是________。
三、实验与探究(共11分)
(1)某研究性学习小组为验证“氨气还原氧化铜”的实验,认真阅资料并做出以下准备。
资料准备:
I.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
Ⅱ.氨气还原氧化铜的化学反应原理:2NH3+3CuO△¯3Cu+N2+3H2O。
实验准备:
请回答:
①为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序________;(填序号)
②装置A中发生反应的化学方程式________;
③装置B观察到的现象________,装置E的作用________;
④将装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变蓝色,原因是________。
(2)小凡同学利用氯化钡和氢氧化钠两种试剂,从硫酸钠、硫酸镁和氯化镁三瓶未贴标签的无色溶液中鉴别出硫酸镁溶液,设计并进行以下实验。请你补齐实验内容;
实验步骤
实验现象
实验结论
(1)取三支洁净试管,分别倒入三种无色溶液,然后滴加________,振荡,观察现象;
________
________
(2)________
________
________
四、分析与计算(共6分)
维生素C(化学式:C6H8O6对人体皮肤和牙龈健康有重要作用,缺乏维生素C,会引起坏血病,中学生每天需要补充60mg维生素C.请阅读信息后回答:
(1)维生素C中碳、氢、氧三种元素质量比是________;
(2)维生素C分子的相对分子质量是________。
长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分数,利用图Ⅰ装置将足量的盐酸加入到10.0g水垢中。随反应进行,装置C质量的变化如图Ⅱ所示。请回答:
(1)向图I装置A中不断通入氮气的目的是________;
(2)若不考虑盐酸的挥发和水垢中含有其他成分,请根据图Ⅱ数据计算:
水垢中碳酸钙的质量是________,水垢中氢氧化镁的质量分数是________; (不要求计算过程,精确到0.1)
(3)若考虑盐酸的挥发,会造成水垢中碳酸钙质量分数的测量结果________(填“增大”“减小”或“不变”)。
第13页 共16页 ◎ 第14页 共16页
参考答案与试题解析
2018年山东省济南市中考化学模拟试卷
一、选择题(下列各题只有一个正确选项)
1.
【答案】
C
【考点】
氧气的实验室制取
二氧化碳的用途
金属的物理性质及用途
常见盐的用途
【解析】
A、根据干冰的用途进行分析判断。
B、根据大理石的性质和用途进行分析判断。
C、根据钢铁熔点高与做金属导线无关进行分析判断。
D、根据过氧化氢易分解,可以制取氧气,进行分析判断。
【解答】
A、干冰升华吸热,使周围温度降低,用于人工降雨,故选项说法正确。
B、大理石硬度大,可用建筑材料,故选项说法正确。
C、钢铁熔点高,作炊具,与做金属导线无关,故选项说法错误。
D、过氧化氢易分解,可以制取氧气,故选项说法正确。
故选:C。
2.
【答案】
B
【考点】
化学变化和物理变化的判别
【解析】
化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。
【解答】
A、用胶带粘合破损书画过程中没有新物质生成,属于物理变化。
B、用白醋泡制软皮鸡蛋过程中有新物质生成,属于化学变化。
C、用钢丝球擦除灶具污渍过程中没有新物质生成,属于物理变化。
D、用汽油清洗衣服油污过程中没有新物质生成,属于物理变化。
3.
【答案】
D
【考点】
利用分子与原子的性质分析和解决问题
【解析】
根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实、酸具有相似化学性质的原因,进行分析判断即可。
【解答】
A、花香四溢,是由于分子是不断运动,花香的微粒通过运动分散到周围的空气中,不是因为分子很小,质量也很小,故选项解释错误。
B、物质的热胀冷缩,是因为分子或原子间的间隔(而不是大小)随温度的变化而改变,分子或原子大小没有发生变化,故选项解释错误。
C、分子总是在不断的运动的,滴水成冰,分子仍在不断的运动的,故选项解释错误。
D、食品变质,是由于分子发生变化,分子性质发生变化,故选项解释正确。
故选:D。
4.
【答案】
A
【考点】
常见的氧化物、酸、碱和盐的判别
【解析】
根据氧化物、酸、碱和盐的概念进行分析判断即可。
【解答】
A、H2CO3由三种元素组成,不属于氧化物,故错误;
B、H2S、H2SO3、H2SO4 都是电离时电离出来的阳离子全部是氢离子,都属于酸,故正确;
C、NaOH、Ca(OH)2、Fe(OH)2都是电离时电离出来的阴离子全部是氢氧根离子,都属于碱,故正确;
D、NaCl、Na2CO3、NaHCO3 都是由金属离子和硝酸根离子组成的化合物,都属于盐,故正确。
5.
【答案】
D
【考点】
反应类型的判定
书写化学方程式、文字表达式
【解析】
判断化学方程式书写正误主要从反应原理、反应条件、气体或沉淀的符号、配平角度进行分析。反应类型可根据反应的特征及反应物和生成物的种类进行判断。
【解答】
A.铁在氧气中燃烧的生成物是四氧化三铁,而不是氧化铁,正确的化学方程式为3Fe+202点燃¯Fe3O4,故错误;
B.氯化银是一种难溶性的盐,所以铜不能置换出氯化银中的银,故错误;
C.该反应的生成物是两种化合物,所以该反应不属于置换反应,故错误;
D.碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应是由两种化合物相互交换成分生成了两种新的化合物,故正确。
6.
【答案】
B
【考点】
溶解时的吸热或放热现象
固体溶解度曲线及其作用
第13页 共16页 ◎ 第14页 共16页
晶体和结晶的概念与现象
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】
通过分析溶解度曲线可知,硝酸钾的溶解度随温度的升高而增大,所以
①X为NaCl固体,加水溶解,溶液温度基本不变,所以试管中无晶体析出,硝酸钾溶液仍是饱和溶液,故正确;
②X为NaOH固体,溶于水,溶液温度升高,溶解度增大,所以试管中无晶体析出,硝酸钾溶液是不饱和溶液,故错误;
③X为NH4NO3晶体,溶于水,溶液温度降低,溶解度减小,所以试管中有晶体析出,硝酸钾溶液仍是饱和溶液,故正确;
④X为浓H2SO4,溶于水,溶液温度升高,溶解度增大,所以试管中无晶体析出,硝酸钾溶液为不饱和溶液,故正确,
7.
【答案】
D
【考点】
常见气体的检验与除杂方法
盐的化学性质
碳的化学性质
物质净化与除杂的综合应用
【解析】
根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【解答】
A、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、CuO能与稀HCl反应生成氯化铜和水,碳粉不与稀盐酸反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
C、CaCl2能与过量Na2CO3溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,故选项所采取的方法错误。
D、适量AgNO3溶液能与CuCl2溶液反应生成氯化银沉淀和硝酸铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:D。
8.
【答案】
D
【考点】
有关溶质质量分数的综合计算
金属的化学性质
根据化学反应方程式的计算
【解析】
此题暂无解析
【解答】
A.反应前,硫酸铜质量是8g,硫酸亚铁质量是7.6g,溶液质量相等,因此溶液中溶质质量分数:FeSO4
查看更多