- 2021-11-12 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考年化学考点跟踪:第26讲 专题五溶液
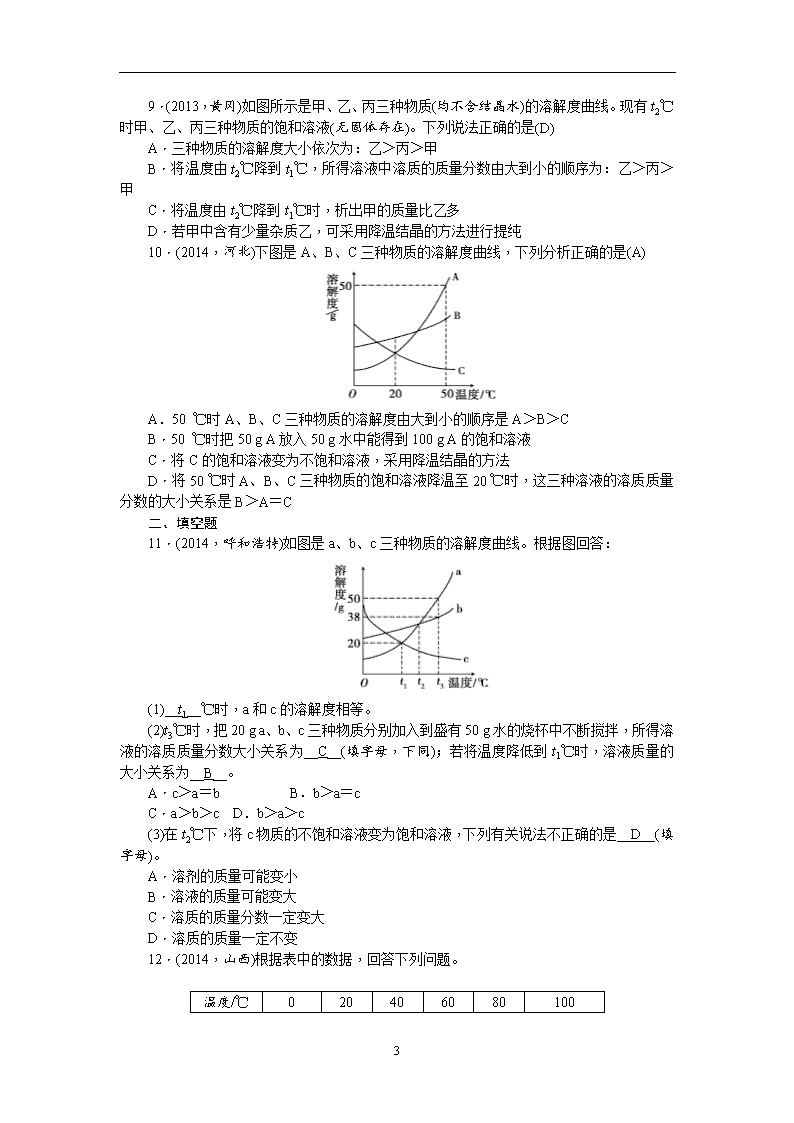
第26讲 溶液 一、选择题 1.(2013,成都)20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是(B) A.20 ℃时,100 g水中最多能溶解氯化钠36 g B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36 D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液 2.(2014,成都)最易洗净沾有油污的餐具的是(D) A.冷水 B.热水 C.加了餐具洗洁精的冷水 D.加了餐具洗洁精的热水 3.(2013,上海)室温时,对100 mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液(A) A.溶质质量相同 B.溶质质量分数相同 C.均为不饱和溶液 D.溶剂质量相同 4.(2014,南京)甲、乙两种不含结晶水的固体物质的溶解性曲线如图所示,下列说法中正确的是(C) A.甲的溶解度比乙大 B.t1℃时,甲的饱和溶液中溶质与溶液的质量比为1∶5 C.t2℃时,甲、乙两种饱和溶液中溶质的质量分数相等 D.将等质量甲、乙的两种溶液分别由t3℃降温至t2℃,析出甲的质量一定比析出乙的质量大 第4题图 第5题图 5 5.(2013,青岛)甲、乙两种固体物质的溶解度曲线如图所示。下列有关叙述错误的是(B) A.t2℃时甲的溶解度比乙的大 B.将甲、乙的饱和溶液从t2℃降到t1℃,析出的甲的质量大 C.升高温度可将甲的饱和溶液变为不饱和溶液 D.t1℃时,甲和乙的饱和溶液各100 g,其溶质的质量一定相等 6.(2014,广州)a、b两种物质的溶解度曲线如图所示。下列说法不正确的是(D) A.15 ℃时,a、b的溶解度均为20 g B.加水或升温可使b的饱和溶液变为不饱和溶液 C.将30 ℃时a的饱和溶液降温至15 ℃,溶质的质量分数不变 D.分别向100 g水中加入20 g a和b,升温至30 ℃,所得溶液均为饱和溶液 7.(2013,河北)20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表: 物质 甲 乙 丙 丁 未溶解固体的质量/g 4.2 2 0 9.2 下列说法正确的是(C) A.所得四杯溶液都是饱和溶液 B.丁溶液的溶质质量分数最大 C.20 ℃时四种物质溶解度的关系为:丙>乙>甲>丁 D.四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液 8.(2014,江西)X、Y、Z三种物质的溶解度曲线如图所示。将t2℃时三种物质的饱和溶液降温至t1℃,溶液中溶质的质量分数的大小关系正确的是(B) A.X>Y>Z B.Y>Z>X C.Z>Y>X D.X=Y>Z 第8题图 第9题图 5 9.(2013,黄冈)如图所示是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在)。下列说法正确的是(D) A.三种物质的溶解度大小依次为:乙>丙>甲 B.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙>甲 C.将温度由t2℃降到t1℃时,析出甲的质量比乙多 D.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯 10.(2014,河北)下图是A、B、C三种物质的溶解度曲线,下列分析正确的是(A) A.50 ℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C B.50 ℃时把50 g A放入50 g水中能得到100 g A的饱和溶液 C.将C的饱和溶液变为不饱和溶液,采用降温结晶的方法 D.将50 ℃时A、B、C三种物质的饱和溶液降温至20 ℃时,这三种溶液的溶质质量分数的大小关系是B>A=C 二、填空题 11.(2014,呼和浩特)如图是a、b、c三种物质的溶解度曲线。根据图回答: (1)__t1__℃时,a和c的溶解度相等。 (2)t3℃时,把20 g a、b、c三种物质分别加入到盛有50 g水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系为__C__(填字母,下同);若将温度降低到t1℃时,溶液质量的大小关系为__B__。 A.c>a=b B.b>a=c C.a>b>c D.b>a>c (3)在t2℃下,将c物质的不饱和溶液变为饱和溶液,下列有关说法不正确的是__D__(填字母)。 A.溶剂的质量可能变小 B.溶液的质量可能变大 C.溶质的质量分数一定变大 D.溶质的质量一定不变 12.(2014,山西)根据表中的数据,回答下列问题。 温度/℃ 0 20 40 60 80 100 5 溶解 度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8 KNO3 13.3 31.6 63.9 110 169 246 (1)40 ℃时,NaCl的溶解度是__36.6_g__。 (2)20 ℃时,称取31.6 g KNO3固体加入盛有100 g水的烧杯中,充分溶解形成的溶液是__饱和__(填“饱和”或“不饱和”)溶液;称取31.6 g KNO3固体时,发现托盘天平指针偏右,接下来的操作是__继续加KNO3固体至天平平衡__。 (3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为__降温结晶(或冷却热饱和溶液)__。 (4)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60 ℃降温到20 ℃,对所得溶液的叙述正确的是(填序号)__AC__。 A.都是饱和溶液 B.溶剂质量:KNO3>NaCl C.溶液质量:KNO3<NaCl 13.(2013,天津)溶液具有广泛的用途,根据溶液的有关知识,回答下列问题: (1)在20 ℃时,向盛有40 g氯化钠固体的烧杯中加入100 g水,充分搅拌后,仍有4 g固体未溶解。 ①所得溶液是20 ℃时氯化钠的__饱和__(填“饱和”或“不饱和”)溶液。 ②20 ℃时,氯化钠的溶解度为__36__g。 (2)现用质量分数为12%的氯化钠溶液(密度约为1.09 g/cm3),配制20 g质量分数为6%的氯化钠溶液。 ①需要质量分数为12%的氯化钠溶液__9.2__mL(计算结果精确到0.1),需要水__10__mL(水的密度为1 g/cm3)。 ②该溶液配制过程中用到的仪器除了量筒、烧杯、玻璃棒外,还需要__胶头滴管__。量取所需要的12%的氯化钠溶液时,应选用__10mL__(填“10 mL”“20 mL”或“50 mL”)规格的量筒。 ③把配制好的上述溶液装入__细口瓶__(填“广口瓶”或“细口瓶”)中,盖好瓶塞并贴上标签。 14.(2014,泰安)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题: 温度/℃ 0 10 20 30 40 50 60 70 溶解 度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 (1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图,图中能表示KNO3 5 溶解度曲线的是__A__(填“A”或“B”); (2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的取值范围是__20_℃~30_℃__; (3)某兴趣小组做了以下实验: 上述实验过程中得到的溶液一定属于不饱和溶液的是__①③④__(填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体__59.1__g; (4)硝酸钾中含有少量氯化钠时,可通过__降温结晶__(填“蒸发结晶”或“降温结晶”)的方法提纯。 5查看更多