- 2021-11-12 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年湖北省武汉市武大附中九年级3月月考化学卷
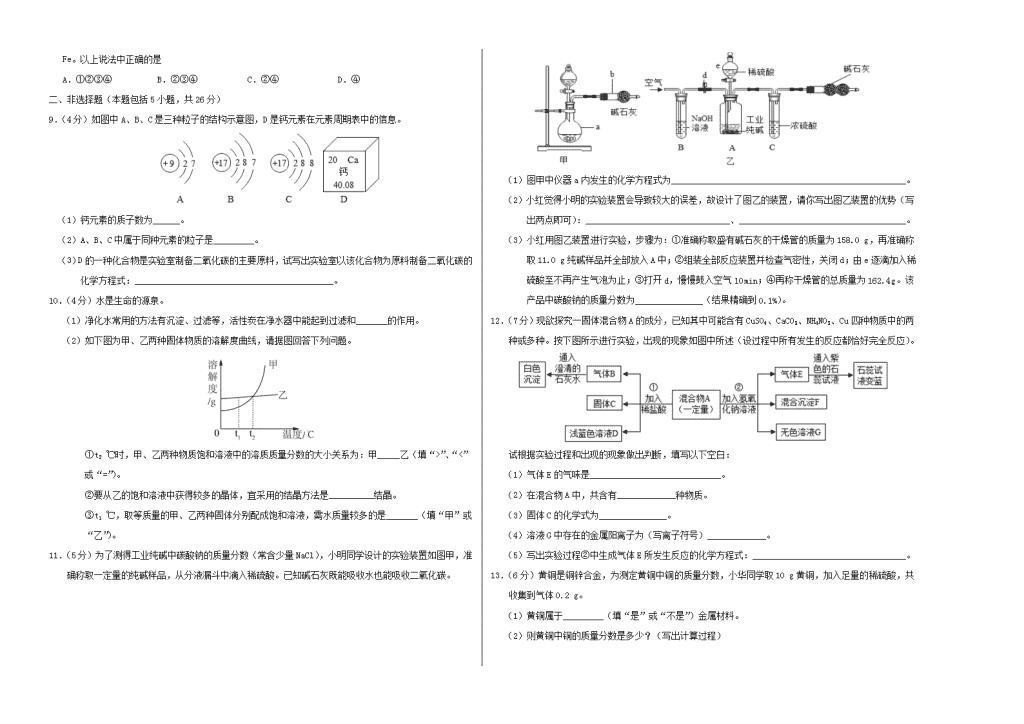
绝密★启用 武汉武大附中九年级月月考试卷 化 学 (考试时间:50分钟 试卷满分:50分) 注意事项: 1.本试卷共4页,二个大题,13个小题。 2.回答第一大题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。 3.回答第二大题时,请用蓝、黑色水笔或圆珠笔在答题卡上作答,写在本试卷上无效。 4.考试结束后,将本试卷和答题卡一并交回。 5.答卷前请将密封线内的项目填写清楚。 相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Ca:40 Fe:56 Zn:65 一、选择题:本大题共8小题,每小题3分,共24分。每题只有一个选项符合题目要求。 1.下列变化中,属于化学变化的是 A.电灯发光 B.粮食酿酒 C.干冰升华 D.矿石粉碎 2.下列有关说法正确的是 A.分子是保持物质性质的一种粒子 B.物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变 C.分子、原子、离子都可以直接构成物质 D.具有相同质子数的微粒一定属于同种元素 3.下列说法中不正确的是 A.塑料、纤维、橡胶都属于有机合成材料 B.当人体缺乏维生素C时,会引起坏血病 C.生活中通过煮沸可以降低水的硬度 D.使用一些新型的、可降解的塑料是解决“白色污染”的有效措施之一 4.下列说法正确的是 A.用汽油去除油脂属于乳化现象 B.焊接金属时常用氮气作保护气 C.碱溶液均能使酚酞试液变红,因此能使酚酞试液变红色的均为碱溶液 D.沙漠地区金属不易锈蚀的原因是氧气浓度较低 5.菠菜和豆腐不能一起食用,否则易在人体中形成结石,其中发生的一个反应是Na2C2O4+CaCl2X+2NaCl。下列关于X的说法中,正确的是 A.属于氧化物 B.钙、碳、氧三种元素的质量比是1∶2∶4 C.钙元素的质量分数最高 D.由一种金属元素和两种非金属元素组成 6.如图所示进行有关碳及其氧化物的性质实验(图中固定玻璃管的仪器已略去),下列说法正确的是 A.将丁处氢氧化钠溶液改为澄清石灰水,可检验乙处反应生成的二氧化碳 B.乙处发生的反应属于置换反应 C.丙装置的作用是收集二氧化碳 D.甲处发生的反应中,二氧化碳作氧化剂 7.下图中“—”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,部分反应物、生成物及反应条件未标出。则不可能出现的情况是 8.某黑色固体粉末可能是Fe、FeO、CuO、C中的一种或几种。为了探究其成分,小明同学按照如图所示流程进行了实验。 关于该实验有以下说法: ①若溶液甲呈浅绿色,则原黑色固体粉末中一定有Fe;②若步骤Ⅱ中无明显现象,则固体乙中一定有Cu;③若步骤Ⅱ中有气泡产生,则固体乙一定只有C;④若步骤Ⅱ 中有红色固体析出,则固体乙中一定无Fe。以上说法中正确的是 A.①②③④ B.②③④ C.②④ D.④ 二、非选择题(本题包括5小题,共26分) 9.(4分)如图中A、B、C是三种粒子的结构示意图,D是钙元素在元素周期表中的信息。 (1)钙元素的质子数为______。 (2)A、B、C中属于同种元素的粒子是_________。 (3)D的一种化合物是实验室制备二氧化碳的主要原料,试写出实验室以该化合物为原料制备二氧化碳的化学方程式:____________________________________________。 10.(4分)水是生命的源泉。 (1)净化水常用的方法有沉淀、过滤等,活性炭在净水器中能起到过滤和_______的作用。 (2)如下图为甲、乙两种固体物质的溶解度曲线,请据图回答下列问题。 ①t2 ℃时,甲、乙两种物质饱和溶液中的溶质质量分数的大小关系为:甲_____乙(填“>”、“<”或“=”)。 ②要从乙的饱和溶液中获得较多的晶体,宜采用的结晶方法是__________结晶。 ③t1 ℃,取等质量的甲、乙两种固体分别配成饱和溶液,需水质量较多的是_______(填“甲”或“乙”)。 11.(5分)为了测得工业纯碱中碳酸钠的质量分数(常含少量NaCl),小明同学设计的实验装置如图甲,准确称取一定量的纯碱样品,从分液漏斗中滴入稀硫酸。已知碱石灰既能吸收水也能吸收二氧化碳。 (1)图甲中仪器a内发生的化学方程式为____________________________________________________。 (2)小红觉得小明的实验装置会导致较大的误差,故设计了图乙的装置,请你写出图乙装置的优势(写出两点即可):________________________________、_____________________________________。 (3)小红用图乙装置进行实验,步骤为:①准确称取盛有碱石灰的干燥管的质量为158.0 g,再准确称取11.0 g纯碱样品并全部放入A中;②组装全部反应装置并检查气密性,关闭d;由e逐滴加入稀硫酸至不再产生气泡为止;③打开d,慢慢鼓入空气10 min;④再称干燥管的总质量为162.4 g。该产品中碳酸钠的质量分数为_______________(结果精确到0.1%)。 12.(7分)现欲探究一固体混合物A的成分,已知其中可能含有CuSO4、CaCO3、NH4NO3、Cu四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。 试根据实验过程和出现的现象做出判断,填写以下空白: (1)气体E的气味是_____________________________。 (2)在混合物A中,共含有_____________种物质。 (3)固体C的化学式为_______________。 (4)溶液G中存在的金属阳离子为(写离子符号)_____________。 (5)写出实验过程②中生成气体E所发生反应的化学方程式:__________________________________。 13.(6分)黄铜是铜锌合金,为测定黄铜中铜的质量分数,小华同学取10 g黄铜,加入足量的稀硫酸,共收集到气体0.2 g。 (1)黄铜属于_________(填“是”或“不是”)金属材料。 (2)则黄铜中铜的质量分数是多少?(写出计算过程) 化学 参考答案 1 2 3 4 5 6 7 8 B C A B D D B D 9.(4分) (1)20(1分) (2) BC(1分) (3) (2分) 10. (4分) (1) 吸附(1分) (2) ①=(1分) ②蒸发(1分) ③甲(1分) 11.(5分) (1) (2)能够防止水蒸气对实验的干扰(1分)能使反应生成的二氧化碳全部被碱石灰吸收(1分) (3)96.4¥(4分) 12.(7分) (1)刺激性气味(1分) (2)4(2分) (3) Cu(1分) (4) Na+ (5)(2分) 13.(6分) (1)是(2分) (2)设置与反应的锌的质量为x。 (1分) 65 2 X 0.2g (1分) 则样品中铜的质量分数为(1分) 答:样品中铜的质量分数为35%查看更多