- 2021-11-11 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019年中考化学试题分类:2具体金属 1铁 5综合
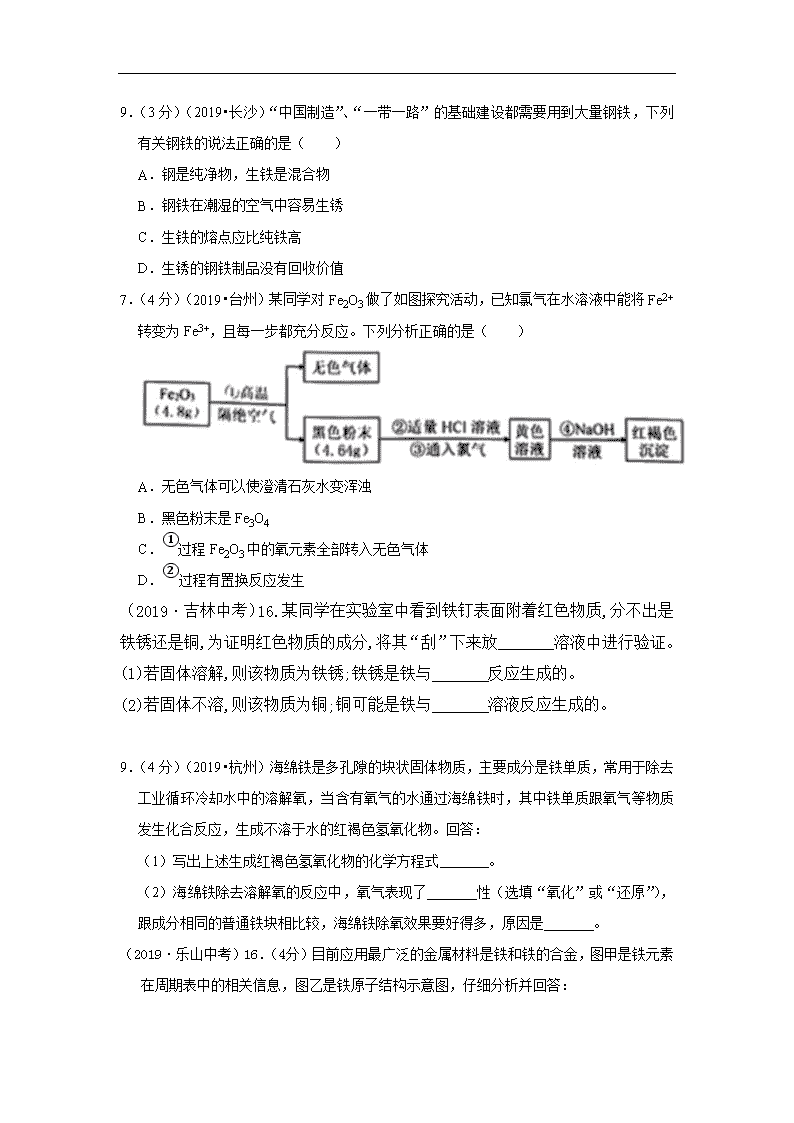
9.(3分)(2019•长沙)“中国制造”、“一带一路”的基础建设都需要用到大量钢铁,下列有关钢铁的说法正确的是( ) A.钢是纯净物,生铁是混合物 B.钢铁在潮湿的空气中容易生锈 C.生铁的熔点应比纯铁高 D.生锈的钢铁制品没有回收价值 7.(4分)(2019•台州)某同学对Fe2O3做了如图探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+,且每一步都充分反应。下列分析正确的是( ) A.无色气体可以使澄清石灰水变浑浊 B.黑色粉末是Fe3O4 C.①过程Fe2O3中的氧元素全部转入无色气体 D.②过程有置换反应发生 (2019·吉林中考)16.某同学在实验室中看到铁钉表面附着红色物质,分不出是铁锈还是铜,为证明红色物质的成分,将其“刮”下来放_______溶液中进行验证。 (1)若固体溶解,则该物质为铁锈;铁锈是铁与 反应生成的。 (2)若固体不溶,则该物质为铜;铜可能是铁与 溶液反应生成的。 9.(4分)(2019•杭州)海绵铁是多孔隙的块状固体物质,主要成分是铁单质,常用于除去工业循环冷却水中的溶解氧,当含有氧气的水通过海绵铁时,其中铁单质跟氧气等物质发生化合反应,生成不溶于水的红褐色氢氧化物。回答: (1)写出上述生成红褐色氢氧化物的化学方程式 。 (2)海绵铁除去溶解氧的反应中,氧气表现了 性(选填“氧化”或“还原”),跟成分相同的普通铁块相比较,海绵铁除氧效果要好得多,原因是 。 (2019·乐山中考)16.(4分)目前应用最广泛的金属材料是铁和铁的合金,图甲是铁元素在周期表中的相关信息,图乙是铁原子结构示意图,仔细分析并回答: (1)地壳中含量居第四位的是铁,人体缺铁容易患贫血病,这里的“铁”是指 (填“分子、原子、离子、元素”); (2)铁元素的原子序数为 ,图乙中x的值为_ _; (3)工业炼铁的原理是:Fe2O3+3CO 高温 2Fe+3CO2,此反应中还原剂是_ 。 【答案】(1)元素(2)26 ; 2 (3)CO(或一氧化碳) 【解析】(1)人体缺铁元素容易患贫血病;(2)根据元素单元格判断铁元素的原子序数为26;根据核电荷数=核外电子数判断x=2;(3)CO(或一氧化碳)具有还原性,可以用作还原剂。 11.(6分)(2019•温州)小明取一包某食品包装袋内的“脱氧剂“,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等,为确定其成分,进行了如下实验: (1)过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有 。 (2)写出用pH试纸测定滤液pH的方法: 。 (3)试剂X的名称是 。 (2019·日照中考)17.(7分)铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验: 步骤1:利用右图所示装置,将干燥的O2从导管a通人U形管(装置气密性良好,药品如 图所示);待U形管内充满O2后,将导管a、b处的止水夹k1-、k2夹紧。 步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。 回答下列问题: (1)步骤1中,检验U-形管内已充满O2的方法是__将带火星的木条放在导管b处,如木条复燃,说明U-形管内已充满O2______。 (2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有_H2O_(填化学式),②处可能观察到的现象是__铁丝生锈_____,③处没有明显变化,说明纯铁的抗腐蚀 能力较_强___(填“强”或“弱”)。 (3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到_导管内液面上升现象,说明该条件下铁制品锈蚀过程消耗了O2。 (4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁):刷漆__。 7.(12分)(2019•宁波)常温下,铁在潮湿的空气中容易生锈,产物主要为Fe2O3•nH2O;铁丝在氧气中燃烧,产物为黑色Fe3O4。 【提出问题】铁在空气中用酒精灯加热时,是否与空气中氧气发生反应?产物是什么? 【查阅资料】①常见的铁的氧化物有三种:FeO、Fe2O3、Fe3O4,其中Fe3O4是磁性物质。 ②FeCl3溶液呈黄色,FeCl2溶液呈浅绿色。 【探究】①按图连接实验装置,检查★。向试管内加入铁粉,针筒活塞停在A刻度。 ②加热铁粉的过程中,活塞发生移动。停止加热后,活塞逐渐向左移动,最终停在B刻度。 ③用细线吊着洁净铁钉靠近加热后的固体粉末,发现没有粉末被铁钉吸上来。 ④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。 ⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同。 【实验结论与反思】 (1)步骤①中“★”处应填: 。 (2)步骤④、⑤中产生的气体是 。 (3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是 。 (4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度,氧气的 等因素影响。 19.(5分)(2019 •广安)中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。 (1)请写出铁与稀硫酸反应的方程式 。 (2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动: 【查阅资料】 ①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。 ②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。 ③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。 【猜想与假设】猜想1:该硫酸亚铁溶液没有变质。 猜想Ⅱ:该硫酸亚铁溶液已经变质。 【设计实验并验证】 实验操作步骤 实验现象 实验结论 取少量样品于试管中,加入2﹣3滴 溶液 试管中溶液变成血红色 【实验拓展1】下列各组物质在溶液中能大量共存,且形成无色溶液的是 。 A.CuSO4、NH4Cl、Ba(OH)2 B.FeSO4、Na2SO4、KCl C.FeCl3、NaOH、HCl D.NaCl、MgSO4、KNO3 【实验拓展2】该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。 17.(11分)(2019•大庆)氢氧化亚铁是白色难溶于水的物质,若接触到空气迅速被氧化,转化成红褐色的氢氧化铁。化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,某化学兴趣小组利用实验室提供的药品:铁屑、稀硫酸、氢氧化钠溶液以及如图装置进行实验,观察到产生了白色的氢氧化亚铁沉淀。请回答下列问题: (1)对于反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,它的化学反应基本类型是 ,其中化合价升高的元素为 。(写元素名称) (2)配制药品的蒸馏水需要加热煮沸,解释原因 。 (3)实验得到氢氧化亚铁涉及到的化学方程式有: ①Fe+H2SO4═FeSO4+H2↑ ② 。(写出化学方程式) (4)试管Ⅰ中加入的药品为 ,试管Ⅱ中加入的药品为 。(均写名称) (5)请将缺少的实验步骤补全:如图连接好仪器→检查装置气密性→装入药品迅速塞紧塞子→打开止水夹→ ,很快观察到白色沉淀在 试管中产生(填“Ⅰ”或“Ⅱ”)。 12.(5分)(2019•永州)铁是一种常见的金属,也是目前世界上年产量最高的金属。下面归纳了初中化学有关铁的知识。 (1)比较生铁和纯铁,其中硬度较大的是 。 (2)焦炭的主要成分是碳,在生铁冶炼过程中,焦炭参与了下列反应: ①C+O2CO2 ②C+CO2 2CO 其中为冶炼生铁提供热量的反应是 (填序号)。 (3)物质甲的阳离子符号是 。 (4)若铁与物质乙反应时,火星四射,则生成物中固体的化学式是 。 (5)若固体为红色单质,则铁与物质乙反应的化学方程式是 (任写一个)。查看更多