- 2021-11-11 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考年化学考点跟踪:第18讲 酸和碱的中和反应
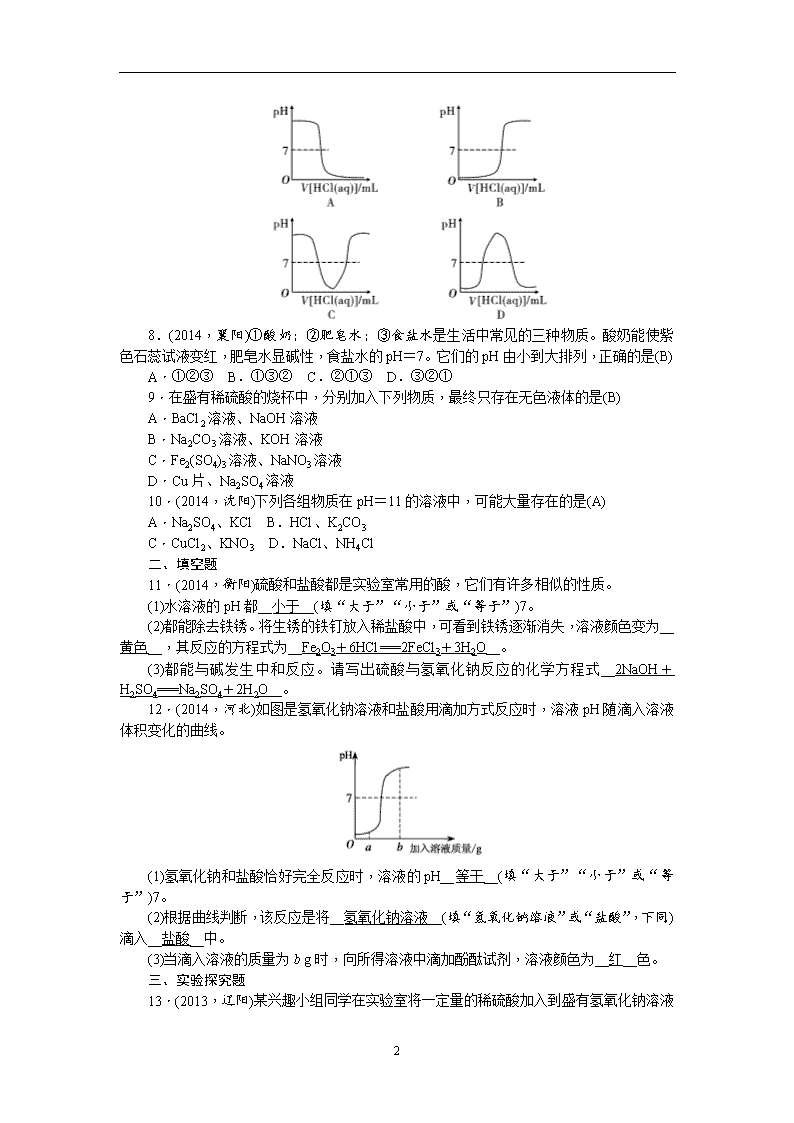
第18讲 酸和碱的中和反应 一、选择题 1.酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是(C) A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多 C.用硫酸除铁锈 D.用NaOH溶液洗涤石油产品中的残余硫酸 2.(2014,广州)向含有酚酞的NaOH溶液中滴加盐酸,溶液红色褪去变为无色,此时溶液pH可能是(A) A.5 B.9 C.12 D.13 3.(2014,佛山)少年儿童按下图时间就餐,口腔残留食物的pH在一天中的变化如下: 已知口腔若经常保持酸性,容易发生蛀牙,如果只从这一点考虑,你认为三次刷牙时间最好安排在(A) A.三次吃点心后 B.早、午、晚餐前 C.早餐、午餐、晚睡前 D.早、午、晚餐后 4.(2014,兰州)为了维持人体正常的生命活动,人体不同器官内的体液具有不同的酸碱性,根据下表可知,在正常情况下(B) 体液 唾液 胆汁 胰液 pH 6.6~7.1 7.1~7.3 7.5~8.0 A.人体的唾液一定呈酸性 B.人体的胆汁一定呈碱性 C.人体的胰液能使紫色石蕊试液变红色 D.酚酞试液可精确测得以上体液的pH 5.(2013,兰州)根据实践经验,你认为下列课外实验不能成功的是(A) A.用润湿的pH试纸测定不同品牌洗发液的酸碱度 B.用酒精浸泡捣烂的紫罗兰花瓣自制酸碱指示剂 C.用柠檬、果汁、白糖、水、小苏打等自制汽水 D.用干电池、灯泡、导线、6B铅笔芯等验证石墨可以导电 6.(2014,重庆)某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是(D) A.用pH试纸直接蘸取待测溶液 B.先用水润湿pH试纸再测定溶液酸碱度 C.用pH试纸测得石灰水的pH=5 D.用pH试纸测得盐酸的pH=1 7.(2013,苏州)向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是(A) 4 8.(2014,襄阳)①酸奶;②肥皂水;③食盐水是生活中常见的三种物质。酸奶能使紫色石蕊试液变红,肥皂水显碱性,食盐水的pH=7。它们的pH由小到大排列,正确的是(B) A.①②③ B.①③② C.②①③ D.③②① 9.在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是(B) A.BaCl2溶液、NaOH溶液 B.Na2CO3溶液、KOH溶液 C.Fe2(SO4)3溶液、NaNO3溶液 D.Cu片、Na2SO4溶液 10.(2014,沈阳)下列各组物质在pH=11的溶液中,可能大量存在的是(A) A.Na2SO4、KCl B.HCl、K2CO3 C.CuCl2、KNO3 D.NaCl、NH4Cl 二、填空题 11.(2014,衡阳)硫酸和盐酸都是实验室常用的酸,它们有许多相似的性质。 (1)水溶液的pH都__小于__(填“大于”“小于”或“等于”)7。 (2)都能除去铁锈。将生锈的铁钉放入稀盐酸中,可看到铁锈逐渐消失,溶液颜色变为__黄色__,其反应的方程式为__Fe2O3+6HCl===2FeCl3+3H2O__。 (3)都能与碱发生中和反应。请写出硫酸与氢氧化钠反应的化学方程式__2NaOH+H2SO4===Na2SO4+2H2O__。 12.(2014,河北)如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。 (1)氢氧化钠和盐酸恰好完全反应时,溶液的pH__等于__(填“大于”“小于”或“等于”)7。 (2)根据曲线判断,该反应是将__氢氧化钠溶液__(填“氢氧化钠溶液”或“盐酸”,下同)滴入__盐酸__中。 (3)当滴入溶液的质量为b g时,向所得溶液中滴加酚酞试剂,溶液颜色为__红__色。 三、实验探究题 13.(2013,辽阳) 4 某兴趣小组同学在实验室将一定量的稀硫酸加入到盛有氢氧化钠溶液的烧杯中,未看到明显的现象。部分同学产生疑问,酸和碱到底能否发生反应? (1)该小组同学又做了如下实验: 实验步骤 实验现象 实验结论及反应方程式 向滴有酚酞溶液的稀氢氧化钠溶液的试管中加入稀硫酸,并振荡 观察到溶液由 __红__ 色变为无色 氢氧化钠和硫酸发生了反应。反应的化学方程式为__H2SO4+2NaOH===Na2SO4+2H2O (2)同学们对(1)实验后溶液中的溶质组成展开探究,作出如下猜想: 小明的猜想是:只有Na2SO4。 小亮的猜想是:有Na2SO4和NaOH。 小丽的猜想是:有Na2SO4和H2SO4。 你认为__小亮__的猜想不合理。理由是__如果有NaOH存在,含有酚酞的溶液不能为无色__。 若要验证余下两种猜想中的一种是正确的,请完成下面的实验方案。 实验步骤 预期实验现象 实验结论 取(1)实验后溶液少量于试管中,加入__锌粒__ __有气泡产生(或没有气泡产生)__ __小丽(或小明)__的猜想正确 14.(2013,贵阳)某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究,请你参与。 甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象。结论:两种物质未发生反应。 乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由__红__色变为无色。结论:两种物质发生了反应。反应的化学方程式为__Ca(OH)2+2HCl===CaCl2+2H2O__。 大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应。并对甲的实验继续探究。 【提出问题】甲实验后的溶液中有什么溶质? 【作出猜想】猜想一:只有CaCl2;猜想二:有CaCl2和Ca(OH)2;猜想三:有CaCl2和HCl。 【实验探究】为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验。 方案编号 方案1 方案2 方案3 实验操作(分别取少量甲实验后的溶液于试管中) 实验现象 对比标准比 色卡:pH<7 产生沉淀 红 实验结论 溶液中 有HCl 溶液中有 CaCl2 Ca(OH)2+2HCI===CaCI2+2H2O 【实验结论】丙认为猜想三正确。 【实验评价】丙的实验操作和方案中有不足之处,其不足之处是__ 4 方案1中使用pH试纸的操作不对;方案2中加AgNO3溶液产生白色沉淀说明溶液中有Cl-,并不能说明溶液中一定有CaCl2__。 大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为__先有气体产生,后有白色沉淀产生__。 【实验拓展】为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表。 要分离 的盐 所用 试剂 主要操作 CaCl2, NaCl Na2CO3, HCl 混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液加热蒸发即得NaCl;将固体加盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 15.(2014,泰安)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色的粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。 【提出问题】该样品中含有哪些物质? 【提出猜想】通过分析,提出如下猜想: 猜想Ⅰ:已完全变质,该样品中只含Na2CO3; 猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。 则反应的化学方程式为__CO2+2NaOH===Na2CO3+H2O__。 【查阅资料】 ①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应; ②CO2在饱和的碳酸氢钠溶液中几乎不溶解。 【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。 实验操作 实验现象 实验结论 (1)取少量样品溶于水,加入__过量CaCl2溶液或BaCl2溶液__ 白色沉 淀产生 该反应的化学方程式:__Na2CO3+CaCl2===2NaCl+CaCO3↓或Na2CO3+BaCl2===2NaCl+BaCO3↓__ (2)将上述反应后的混合液过滤,取滤液加入__酚酞试液__ __溶液变 红色__ 证明猜想Ⅱ成立 4查看更多