- 2021-11-10 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
99.备战中考化学巩固复习-第九单元 溶液(含解析)
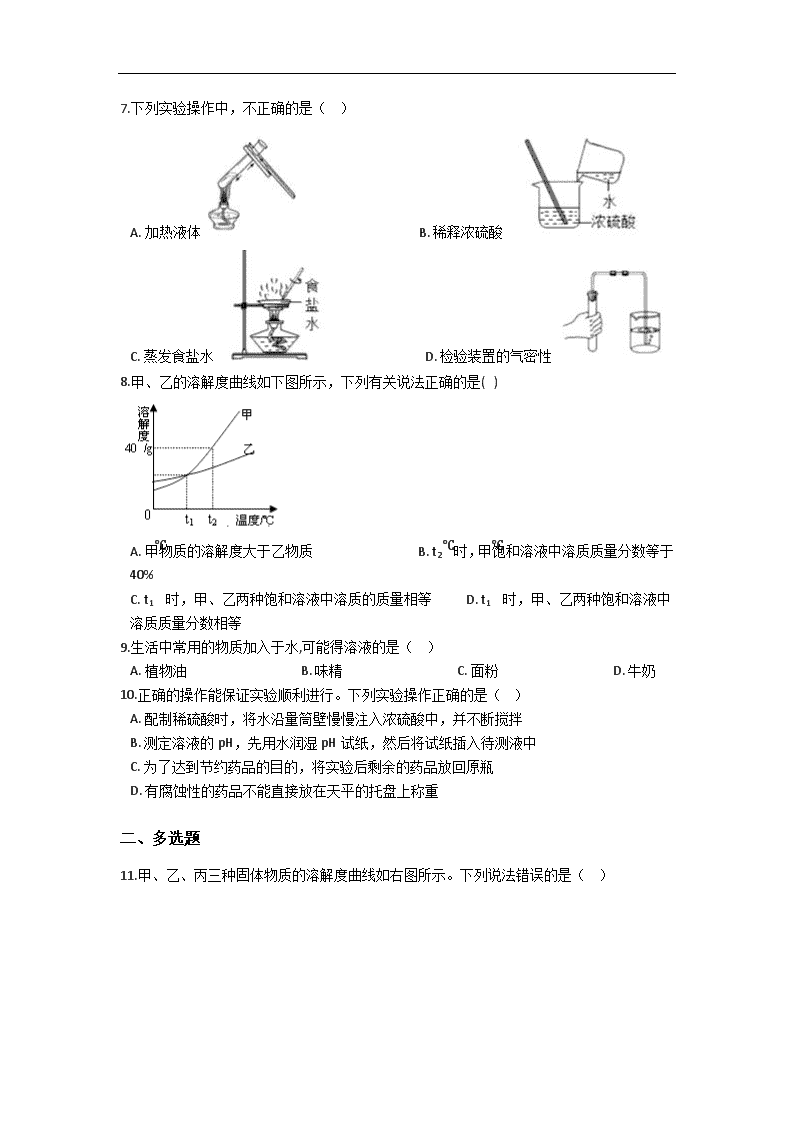
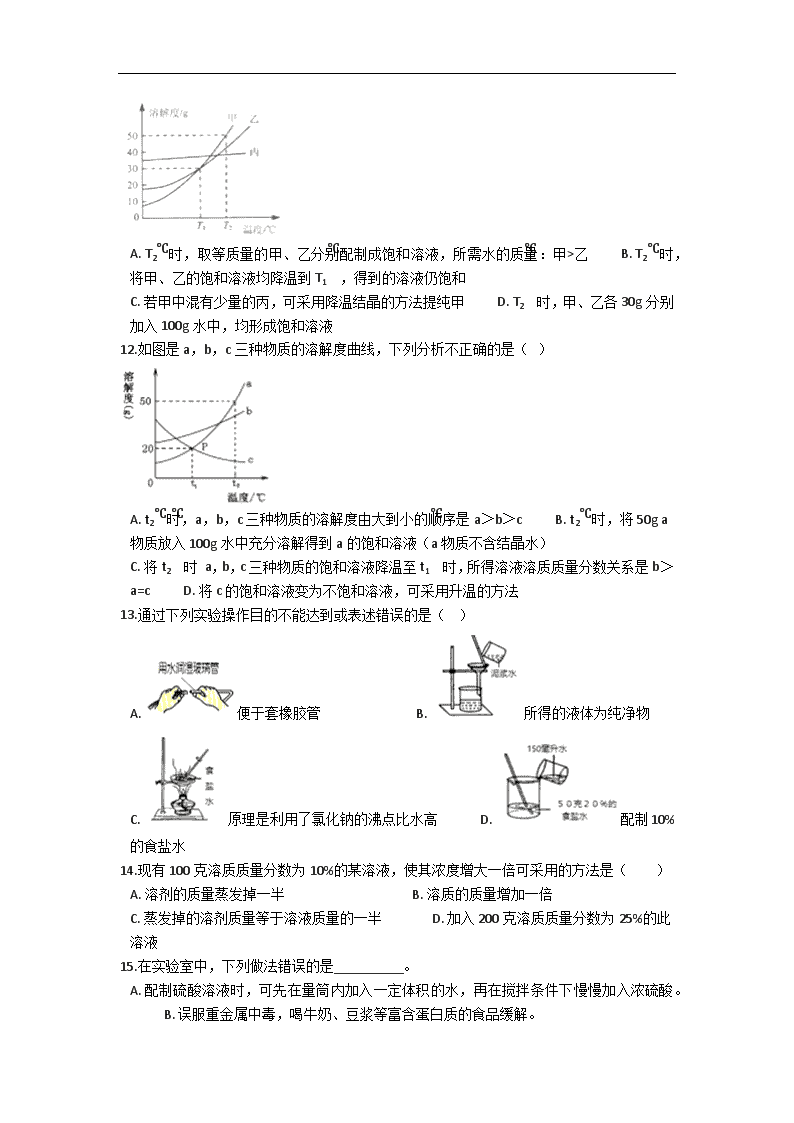
备战中考化学巩固复习-第九单元 溶液(含解析) 一、单选题 1.甲、乙两种物质的溶解度曲线如下图所示。下列说法错误的是( ) A. t1℃时甲乙的溶解度相等 B. t2℃时,甲的饱和溶液中溶质的质量分数为40% C. t2℃时,甲的饱和溶液的质量分数比乙的饱和溶液的质量分数大 D. 将t2℃时甲、乙的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等 2.对下列现象或做法的解释不正确的是 A. 洒到地面上的酒会使房间充满酒味,说明分子在不断运动 B. 消防队员用高压水枪喷水灭火,是因为水能降低可燃物的着火点 C. 用洗洁精洗去餐具上的油污,是因为洗洁精具有乳化作用 D. 膨化食品变得不再松脆,是因为食品可能吸收了空气中的水分 3.溶解适量的固体碘制成消毒液,应该使用( ) A. 蒸馏水 B. 酒精 C. 汽油 D. 生理盐水 4.某同学欲配制50克质量分数为7.0%的食盐溶液,在量取水时,俯视读数,其他各步操作均正确,那么他实际上所配制的食盐水的质量分数( ) A. >7.0% B. <7.0% C. =7.0% D. 无法判断 5.汽车用铅蓄电池中需要质量分数为28%的稀硫酸。若在实验室中用10g质量分数为98%的浓硫酸(密度为1.84 g/cm3)配制28%的稀硫酸,下列做法或说法正确的是(水的密度近似看作1g/cm3) A. 将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌 B. 将10g98%的浓硫酸沿烧杯壁慢慢注入盛有25mL水的烧杯中,并用玻璃棒不断搅拌 C. 若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28% D. 配制该溶液时,若有浓硫酸沾到手上应立即用氢氧化钠溶液中和 6.农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。下列操作不可能配成所需溶液的是( ) A. 一定量氯化钠固体溶于适量水中 B. 一定量24%的氯化钠溶液加适量水稀释 C. 15%的氯化钠溶液与13%的氯化钠溶液按一定比例混合 D. 18%的氯化钠溶液与10%的氯化钠溶液按一定比例混合 7.下列实验操作中,不正确的是( ) A. 加热液体 B. 稀释浓硫酸 C. 蒸发食盐水 D. 检验装置的气密性 8.甲、乙的溶解度曲线如下图所示,下列有关说法正确的是( ) A. 甲物质的溶解度大于乙物质 B. t2℃时,甲饱和溶液中溶质质量分数等于40% C. t1℃时,甲、乙两种饱和溶液中溶质的质量相等 D. t1℃时,甲、乙两种饱和溶液中溶质质量分数相等 9.生活中常用的物质加入于水,可能得溶液的是( ) A. 植物油 B. 味精 C. 面粉 D. 牛奶 10.正确的操作能保证实验顺利进行。下列实验操作正确的是( ) A. 配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌 B. 测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中 C. 为了达到节约药品的目的,将实验后剩余的药品放回原瓶 D. 有腐蚀性的药品不能直接放在天平的托盘上称重 二、多选题 11.甲、乙、丙三种固体物质的溶解度曲线如右图所示。下列说法错误的是( ) A. T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙 B. T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和 C. 若甲中混有少量的丙,可采用降温结晶的方法提纯甲 D. T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液 12.如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是( ) A. t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c B. t2℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液(a物质不含结晶水) C. 将t2℃时 a,b,c三种物质的饱和溶液降温至t1℃时,所得溶液溶质质量分数关系是b>a=c D. 将c的饱和溶液变为不饱和溶液,可采用升温的方法 13.通过下列实验操作目的不能达到或表述错误的是( ) A. 便于套橡胶管 B. 所得的液体为纯净物 C. 原理是利用了氯化钠的沸点比水高 D. 配制10%的食盐水 14.现有100克溶质质量分数为10%的某溶液,使其浓度增大一倍可采用的方法是( ) A. 溶剂的质量蒸发掉一半 B. 溶质的质量增加一倍 C. 蒸发掉的溶剂质量等于溶液质量的一半 D. 加入200克溶质质量分数为25%的此溶液 15.在实验室中,下列做法错误的是__________。 A. 配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸。 B. 误服重金属中毒,喝牛奶、豆浆等富含蛋白质的食品缓解。 C. 过滤时为加快过滤速度,应在漏斗内用玻璃棒不断搅拌。 D. 小明用PH试纸测得某Na2CO3 溶液的PH为10.6 E. 实验室制取气体时,应先检查装置的气密性后再装药品 三、填空题 16.(2分)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:①水的质量;②溶液中溶质KNO3的质量;③KNO3的质量分数;④溶液的质量。用序号填空: Ⅰ.在该不饱和溶液中加少量硝酸钾至饱和,不变的量有________ ; Ⅱ.将该不饱和溶液恒温蒸发至饱和 ,不变的量有________ 。 17.配制一瓶如图的溶液需氯化钠________g;配制50g 6%的氯化钠溶液,量筒量取水时仰视读数(其他操作正确),所得溶液的质量分数________6%(填“>”、“<”或“=”). 18.生理盐水是医疗上常用的一种溶液,合格的生理盐水是无色透明的.一瓶合格的生理盐水密封放置一段时间后,________(填“会”或“不会”)出现浑浊现象,其理由是溶液具有________.食盐在20℃时的溶解度为36g,这说明在20℃时,36g食盐溶解在________ g水中,恰好可以形成________溶液. 19.在通常情况下,我们把一种物质的________或________均匀________到另一种物质中的过程,叫做溶解. 20.某小组同学利用下图溶解度曲线和下图进行实验,并完成下列问题 ①20℃时,氯化钠的溶解度为 ________。 ②40℃时,硝酸钾的溶解度________氯化钠的溶解度(用“>”“<”“=”填空) ③A中溶液为60℃硝酸钾的________溶液(填“饱和”或“不饱和”) ④B中溶液的质量为________克 ⑤将D过滤,下列有关所得晶体和溶液说法正确的是________(填字母)。 Ⅰ.析出的晶体中可能含有氯化钠 Ⅱ.所得溶液中一定含有硝酸钾和氯化钠 Ⅲ .C→D过程可以完全分离硝酸钾和氯化钠 Ⅳ.所得溶液一定是硝酸钾的饱和溶液 四、计算题 21.已知20°C时硝酸钾的溶解度为31.6克,在20°C时要配制263.2克硝酸钾饱和溶液,需硝酸钾多少克? 22.请回答并完成下列计算。 (1)实验室要配制50g溶质质量分数为8%的氢氧化钠溶液,需称取________g氢氧化钠固体。 (2)向上述配制好的溶液中加入50g稀硫酸,恰好完全反应,求反应后所得溶液中溶质的质量分数为多少。(反应的化学方程式:2NaOH + H2SO4=Na2SO4 + 2H2O) 五、解答题 23.一定质量的NaOH溶液与8gSO3恰好完全反应,得到Na2SO4溶液1000g,求所得硫酸钠溶液中溶质的质量分数(计算结果精确到0.01%).(提示:2NaOH+SO3═Na2SO4+H2O) 24.乙醇俗名叫酒精,常温下是一种无色有特殊气味的透明液体,为了探究“乙醇能否溶于水”的问题,某化学兴趣小组进行了如下实验: [操作步骤]①在盛有2mL水的试管中滴入2~3滴红墨水,振荡.然后加入2mL乙醇,不要振荡,发现乙醇与水分层;②振荡试管,观察现象:③问题讨论 (1)在水中滴入红墨水的目的是什么? (2)在操作步骤①中,为了确保乙醇与水有明显的分层现象,实验操作时应注意什么? (3)要证明乙醇能溶于水,还应进行操作步骤③.请写出实验操作及现象. 六、实验探究题 25.根据题意填空 (1)实验室需100g10%的氢氧化钠溶液,需氢氧化钠的质量是________,现在下列仪器: (2)要完成该实验,还缺少的仪器是________,________; (3)在称取氢氧化钠时,发现天平的指针向左偏转,你认为下列做法正确的是( ) A. 加砝码 B. 减砝码 C. 加氢氧化钠 D. 减氢氧化钠 (4)同学们应该选用________ ml的量筒(10ml、50ml、100ml、200ml)所需的水; (5)某同学配制的氢氧化钠溶液中氢氧化钠的质量分数小于10%,其可能原因是( ) A. 氢氧化钠已变质 B. 称量物与砝码放反了 C. 有少量氢氧化钠洒落在外面 D. 量水时仰视读数 E. 量水时俯视读数 七、综合题 26.请根据硝酸钾、氯化铵两种固体物质的溶解度曲线回答下列问题: (1)t℃时两种物质的溶解度为________; (2)70℃时,氯化铵的溶解度为________g; (3)30℃时,将等质量的两种物质的饱和溶液障到10℃时,析出晶体的质量是硝酸钾________氯化铵(填“>”、“=”或“<”)。 27.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂. (1)常用的医用消毒剂双氧水的溶质质量分数是5%,5%的含义是每100g________中含________ 5g. (2)明配制了5%的双氧水600g,600g溶液中溶质为________克,溶剂为________克. (3)明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为________. 28.某同学配制100g溶质质量分数为8.5%的氯化钠时有如下操作,按要求回答问题: (1)需要氯化钠固体的质量为________g;水的体积为________mL(水的密度为:1g/cm3); (2)用托盘天平称出所需氯化钠固体后倒入烧杯,那么称量时砝码应放在天平的________盘(填“左”或“右”) (3)在溶解过程中,为了加快物质的溶解,需用________搅拌. (4)若想得到质量分数为4.25%的氯化钠溶液,那么需加水________g. 答案解析部分 一、单选题 1.【答案】B 【考点】固体溶解度曲线及其作用 【解析】【解答】A、根据溶解度曲线的意义可以知道在t1℃时,甲乙溶解度相等,故说法不符合题意; B、t2℃时,甲的饱和溶液中溶质的质量分数为: ×100%=28.6%,故说法符合题意; C、t2℃时,甲物质的溶解度比乙物质的溶解度大,则甲的饱和溶液的质量分数比乙的饱和溶液的质量分数大,故说法不符合题意; D、t1℃时甲、乙的溶解度相等,其饱和溶液溶质质量分数也相等,因此将t1℃时甲、乙的饱和溶液分别升温至t2℃,两溶液的溶质质量分数相等,该选项说法不符合题意。 故答案为:B。 【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。 2.【答案】B 【考点】乳化现象与乳化作用 【解析】A、白酒的主要成分是乙醇,是一种具有特殊气味的物质,当它洒落到地面时会不断地运动,导致整个房间都充满酒味,故解释正解; B、消防队员用高压水枪喷水灭火,是因为水能吸收热量,使温度降低到着火点以下,故解释不正确; C、用洗洁精洗去餐具上的油污,是因为洗洁精具有乳化作用,解释正确; D、松脆的膨化食品暴露在空气中会吸收空气中的水蒸气而变潮,故解释也正确. 故选B 3.【答案】B 【考点】溶解现象与溶解原理 【解析】【解答】解:A、蒸馏水是纯水不具有杀菌消毒作用; B、点易溶于酒精,且酒精具有杀菌消毒作用,所以说该答案正确; C、汽油虽然能溶解碘但是用作消毒不合适,不符合题意; D、生理盐水不能很好的溶解碘,不适合溶解适量的固体碘制成消毒液. 故选B. 【分析】根据碘不易溶于水而易溶于酒精,还要考虑所用溶剂是否具有消毒作用来回答本题. 4.【答案】A 【解析】【解答】该同学其他操作正确,在量取水时,俯视量筒读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,溶剂质量减少,溶质质量不变,所以会使溶质质量分数偏大,即他所配制的食盐水溶质质量分数大于7%. 故选:A. 【分析】根据该同学其他操作正确,在量取水时,俯视量筒读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,溶质质量不变进行分析. 5.【答案】B 【解析】【分析】A、量筒是用于量取一定体积液体的仪器,不可在量筒内进行溶液的配制; B、利用溶洞质的质量分数的计算公式,计算所得溶液的溶质质量分数是否为28%; C、俯视读数时,所读的体积数大于实际液体的体积,因此,量取水的体积小于25mL; D、氢氧化钠有极强的腐蚀性,同样会对手造成腐蚀,处理方法不正确. 【解答】A、将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌,在量筒内进行溶解操作是操作要求所不允许的;故A不正确; B、所得溶液的溶质质量分数=×100%=28%;故B正确; C、俯视读数时所量取的水的体积小于25mL,溶剂量偏小所得溶液的溶质质量分数则偏大;故C不正确; D、浓硫酸沾到手上应用布擦拭后再用大量水冲洗,不可用腐蚀性同样极强的氢氧化钠进行中和处理;故D不正确; 故选B. 【点评】量筒只能用于量取一定体积的液体,不可用作反应容器;在使用量筒量取液体读数时就平视,视线与凹液面最低处保持在同一水平面上. 6.【答案】C 【解析】【分析】本题主要考查根据溶质质量分数的概念及溶液稀释来计算. 【解答】欲配制16%的氯化钠溶液,可用一定量氯化钠固体溶于适量水中来完成,因此A选项正确; 也可以将一定量24%的氯化钠溶液加适量水稀释到16%来完成,因此B选项正确; 也可以用两种溶液混合来配制的方法,若配制16%的氯化钠溶液,必须有一种溶液的溶质质量分数大于16%,另一种小于16%才能完成,同时大于或同时小于16%的两种溶液均不可能配制成16%的溶液,因此C选项不正确,D选项正确. 故选:C 【点评】有关溶质质量分数概念的计算重点考查同学们对概念的理解及运算的基本功,解答此类题的关键是掌握溶质的质量分数计算公式并能熟练进行变形应用. 7.【答案】B 【解析】【解答】A、加热液体,先均匀预热,后固定集中加热,图中操作正确,故A正确;A不符合题意; B、稀释浓硫酸时,将水沿容器内壁缓缓注入浓硫酸中,会沸腾溅出,可能伤人.图中操作错误,故B错误;B符合题意; C、蒸发溶液时,要用玻璃棒不断地搅拌,图中操作正确,故C正确;C不符合题意; D、在检验装置的气密性时,利用的是装置内气体的压强改变,有气泡冒出时,说明装置气密性良好,否则气密性不好,图中操作正确,故D正确;D不符合题意. 故答案为:B. 【分析】A、加热液体时,要先均匀预热,然后再后固定集中加热; B、稀释浓硫酸时,要将浓沿着烧杯壁缓缓加入水中,且要边加边搅拌; C、蒸发溶液时,为了防止液体飞溅,要用玻璃棒不断地搅拌; D、在检查装置的气密性时,先将导管放入水槽中,然后用手握住试管外壁. 8.【答案】D 【考点】饱和溶液和不饱和溶液相互转变的方法,固体溶解度曲线及其作用,晶体和结晶的概念与现象 【解析】【解答】A. 比较物质溶解度的大小,必须指明温度,错误;A不符合题意; B. t2℃时,甲的溶解度是40g,甲饱和溶液中溶质质量分数为: ≠40%,错误;B不符合题意; C. t1℃时,甲、乙两种物质的溶解度相等,甲、乙的饱和溶液中溶质的质量分数相等,错误;C不符合题意; D. t1℃时,甲、乙两种物质的溶解度相等,故t1℃时,甲、乙两种物质的饱和溶液中溶质质量分数相等,正确。D符合题意; 故答案为:D。【分析】在描述溶解度的概念时必须指明温度;没有温度的溶解度没有实际意义;溶解度规定溶剂的质量是100g;饱和溶液的溶质质量分数可以使用溶解度来计算,饱和溶液的溶质质量分数= 9.【答案】B 【考点】常见的溶剂 【解析】【解答】味精能够溶于水中,形成均一稳定的混合物,能够形成溶液 故答案为:B【分析】根据溶液的特征:均一的、稳定的混合物解答 10.【答案】D 【解析】A.稀释浓硫酸时,应将将浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌。故A错误; B.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中,会使测试结果不准;应用玻璃棒蘸取待测液,涂在试纸上,故此选项错误; C.实验后剩余的药品放回原瓶,会污染原试剂,应放入指定容器中。故C错误; D.有腐蚀性的药品不能直接放在天平的托盘上称重,应放入烧杯等玻璃器皿中称量。故答案正确。 所以答案为D。 二、多选题 11.【答案】A,D 【考点】固体溶解度曲线及其作用 【解析】【解答】根据所学知识和题中信息知,A、T2 时,甲溶解度大于乙,取等质量的甲、乙分别配置成饱和溶液,所需水的质量:乙>甲。故A符合题意,B、甲和乙溶解度均是岁温度的升高而增大,T2 时,将甲、乙的饱和度降温到T1 时,得到的溶液仍饱和,故B不符合题意; C、甲溶解度岁温度的升高而增大,丙溶解度随温度的升高而变化不大,若甲中混有少量的丙,可采用降温结晶的方法提纯甲,故C符合题意, D、T2 时,甲和乙溶解度均大于30g,甲、乙各30g分别加入100g水中,均形成不饱和溶液。故D符合题意。 故答案为:AD 【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。 12.【答案】C,D 【考点】饱和溶液和不饱和溶液相互转变的方法,固体溶解度曲线及其作用,溶质的质量分数 【解析】【解答】A、根据溶解度曲线,t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c,A不符合题意, B、根据溶解度曲线, t2℃时,a物质的溶解度为50g,故将50g a物质放入100g水中充分溶解得到a的饱和溶液,B不符合题意, C、根据溶解度曲线,物质a、b的溶解度都随温度的升高而增大,故将t20C时a、b两种物质的饱和溶液分别降温到t10C时,都有晶体析出,成为t10C时的饱和溶液,而在t10C 时:b的溶解度大于a,故溶质质量分数b也大于a,而对于c而言,溶解度随温度的升高而降低,故t20C降温到t10C,由饱和溶液变为不饱和溶液,溶液中的溶质、溶剂质量都不变,故溶质质量分数也不变,而在t20C时,物质c的溶解度要小于t10C时a的溶解度,故c的溶质质量分数最小,故若将t20C三种物质的饱和溶液分别升温到t10C时,则三种溶液中溶质的质量分数大小关系是:b>a>c,C符合题意 D,根据溶解度曲线,c的溶解度随温度的升高而降低,将c的饱和溶液变为不饱和溶液,可采用降温的方法,D符合题意 故答案为:CD【分析】A根据物质的溶解度曲线可以得出某一温度是物质的溶解度大小 B根据物质的溶质质量分数、溶质质量、溶剂质量可以判断溶液是否饱和 C饱和溶液的溶质质量分数等于溶解度/(溶解度+100) D依据饱和和不饱和之间的转化关系解答 13.【答案】B,D 【解析】【解答】A、玻璃导管口用水润湿,便于套橡胶管,A不符合题意; B、过滤仅能除去不溶性杂质,所得液体中还含有可溶性杂质,不是纯净物,B符合题意; C、对食盐水进行蒸馏,利用了氯化钠的沸点比水高,C不符合题意; D、设配制10%的食盐水后溶液的质量为x。50g×20%=x×10%,x=100g;需要加水的质量=100g-50g=50g,约50mL,D符合题意。 故答案为:BD。 【分析】过滤只能除去不溶性杂质,因此过滤之后得到的人人是混合物,溶质质量分数等于溶质质量与溶液质量之比。 14.【答案】C,D 【考点】溶质的质量分数 【解析】【解答】100 g溶质的质量分数为10%的某物质溶质的质量是:100g×10%=10g,溶剂的质量是:100g﹣10g=90g;溶液中溶质的质量分数增大一倍后的质量分数是20%. A、溶剂的质量蒸发掉一半,溶液的溶质的质量分数是:×100%≈18%,不符合题意;故不正确; B、溶质的质量增加一倍,溶液的溶质的质量分数是:×100%≈18%,不符合题意;故不正确; C、蒸发50g水后,溶液的溶质的质量分数是:×100%=20%;故正确; D、加入200g25%的此溶液,═20%;故正确; 故选CD. 【分析】溶质的质量分数=×100%①,溶质的质量=溶液的质量×溶质的质量分数②,把题中的已知条件代入公式①或②,求解即可. 15.【答案】A,C,D,F 【解析】【解答】A、配制硫酸溶液时,不可先在量筒内加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸,量筒只能用于量取液体的体积,不可作为反应容器使用,A符合题意; B、误服重金属中毒,喝牛奶、豆浆等富含蛋白质的食品缓解,重金属有毒,牛奶、豆浆等富含蛋白质,可以缓解病情,B不符合题意; C、过滤时为加快过滤速度,不应在漏斗内用玻璃棒不断搅拌,以免弄破滤纸,C符合题意; D、小明用PH试纸不可测得某Na2CO3 溶液的PH为10.6,pH从0到14,故D错误; E、实验室制取气体时,应先检查装置的气密性后再装药品,D不符合题意; F、不可各放一张质量相同的纸于天平的左右托盘上,将氢氧化钠固体放在左盘的纸上称量,用于玻璃器皿,氢氧化钠具有腐蚀性,符合题意; G、与滴瓶配套的胶头滴管用完后不洗涤就可直接插入原滴瓶,滴瓶滴管不应洗,G不符合题意; H、沉淀、过滤不能除去钙镁离子,无法降低水的硬度,H不符合题意。 故答案为:ACDF。 【分析】本题主要考察实验室实验用品以及注意事项,需要掌握常见实验的操作和仪器的正确使用方法。 三、填空题 16.【答案】①;② 【考点】常见的溶剂,饱和溶液和不饱和溶液相互转变的方法 【解析】【解答】Ⅰ.在该不饱和溶液中加溶质硝酸钾,硝酸钾会继续溶解至饱和,此时所得饱和溶液中溶质质量增加,溶液的质量也随之增加,但由于溶液中溶剂水的质量不变,故导致溶液的溶质质量分数都变大。故选①。 Ⅱ.将该不饱和溶液恒温蒸发至饱和,即蒸发溶剂水至饱和,所以溶剂水减少,溶液的质量也随之减小,但由于溶液中溶质硝酸钾的质量不变,故溶液的溶质质量分数变大。故选② 【分析】本题难度不大,掌握不饱和溶液与饱和溶液之间的转化方法并能灵活运用是正确解答本题的关键。 17.【答案】4.5;< 【解析】【解答】解:500mL=500cm3 , 溶质质量=溶液质量×溶质的质量分数,配制一瓶如图的溶液需氯化钠的质量为1.0g/cm3×500cm3×0.9%=4.5g. 配制50g6%的氯化钠溶液,用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小. 故答案为:4.5;<. 【分析】根据溶质质量=溶液质量×溶质的质量分数,用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,进行分析解答. 18.【答案】不会;稳定性;100;饱和 【考点】常见的溶剂,固体溶解度的概念 【解析】【解答】解:溶液具有稳定性,故常温下一瓶合格的生理盐水密封放置一段时间,不会出现浑浊的现象;氯化钠在20℃时的溶解度为36克,即20℃时在100g水中溶解36g氯化钠,溶液达到饱和状态,形成136g饱和氯化钠溶液. 故答案为:不会;稳定性;100;饱和. 【分析】根据溶液的性质:均一性、稳定性以及溶解度的概念来分析此题. 19.【答案】分子;离子;分散 【考点】溶解现象与溶解原理 【解析】【解答】解:根据溶解概念,一种物质的分子或离子均匀分散到另一种物质中的过程,叫做溶解. 故答案:分子 离子 分散. 【分析】根据溶解的概念即可作答. 20.【答案】36g;>;不饱和;21;Ⅱ、Ⅳ 【考点】固体溶解度曲线及其作用,晶体和结晶的概念与现象 【解析】【解答】①由溶解度曲线可知,20℃时,氯化钠的溶解度为36.0g; ②由溶解度曲线可知,40℃时,硝酸钾的溶解度大于氯化钠的溶解度; ③60℃硝酸钾的溶解度为110g,故该温度下10g的水中可溶解11g 的硝酸钾,故A中溶液为60℃硝酸钾的不饱和溶液; ④由③可知,60℃时,再加入6g的硝酸钾,不能完全溶解,可以溶解11g 的硝酸钾,故B中溶液的质量为21克; ⑤Ⅰ.20℃时,氯化钠的溶解度为36.0g,故10g的水中可溶解3.6g 的氯化钠,故析出的晶体中不可能含有氯化钠,不符合题意; Ⅱ. 所得溶液中一定含有硝酸钾和氯化钠,符合题意; Ⅲ. C→D过程的过程中氯化钠和硝酸钾都没有完全结晶,不符合题意; Ⅳ.整个过程中共加入12g的硝酸钾,而20℃时,硝酸钾的溶解度为110g,故10g的水中最多能溶解11g的硝酸钾,故该溶液一定是硝酸钾的饱和溶液;符合题意. 故答案为:36;>;不饱和;21;Ⅱ、Ⅳ. 【分析】①根据溶解度曲线可知20℃时氯化钠的溶解度; ②40℃时,硝酸钾的溶解度大于氯化钠的溶解度; ③60℃时硝酸钾的溶解度是110g; ④B中溶液的质量=10g+6g+5g; ⑤Ⅰ.20℃时,氯化钠的溶解度为36.0g,据此可判断析出的晶体中是否含有氯化钠; Ⅲ. C→D过程的过程中氯化钠和硝酸钾都没有完全结晶; Ⅱ.所得溶液中一定含有硝酸钾和氯化钠; Ⅳ.20℃时,硝酸钾的溶解度为110g,据此可判断所得溶液是否是硝酸钾的饱和溶液. 四、计算题 21.【答案】设20°C时263.2克硝酸钾饱和溶液中含硝酸钾的质量为x 根据溶解度的概念和计算公式可以知道: 解得x=63.2g 所以答案为:20°C时263.2克硝酸钾饱和溶液中含硝酸钾63.2克. 【考点】固体溶解度的概念 【解析】解答:设20°C时263.2克硝酸钾饱和溶液中含硝酸钾的质量为x 根据溶解度的概念和计算公式可以知道: 解得x=63.2g 所以答案为:20°C时263.2克硝酸钾饱和溶液中含硝酸钾63.2克. 分析:解答本题关键是要熟悉计算公式: 22.【答案】(1)4 (2)解:设反应生成硫酸钠的质量为x。 2NaOH + H2SO4= Na2SO4 + 2H2O 80 142 4 x x=7.1g 反应后所得溶液中溶质的质量分数= ×100%=7.1% 答:反应后所得溶液中溶质的质量分数为7.1% 【考点】溶质的质量分数 【解析】【解答】 (1) 需称取氢氧化钠固体的质量=50g×8%=4g;(2)答:(1) 需称取氢氧化钠固体的质量为4g; 【分析】(1)用溶液质量与溶质质量分数的积即为溶质质量, (2)列出化学反应方程式,根据质量守恒定律进行计算。 五、解答题 23.【答案】解:设硫酸钠的质量为x 2NaOH+SO3═ Na2SO4+H2O 80 142 8g x x=14.2g 所得硫酸钠溶液中溶质的质量分数= 100%=1.42% 答案:所得硫酸钠溶液中溶质的质量分数为1.42% 【考点】溶质的质量分数 【解析】【分析】根据SO3的质量结合反应的化学方程式可以计算出硫酸钠的质量,进而求算出所得硫酸钠溶液中溶质的质量分数. 24.【答案】(1)为了便于观察乙醇与水是否有分层 (2)应该用胶头滴管将乙醇轻轻滴入水中,防止有震荡而直接混合 (3)震荡试管后静置一会儿,发现上面无色液体变红,分层现象消失. 【考点】溶解现象与溶解原理 【解析】【解答】(1)直接将酒精溶解在水中没有明显的现象,因为两者都是无色透明的液体,滴入红墨水震荡后,液体呈红色,而乙醇是无色的液体.所以答案为:是为了便于观察乙醇与水是否有分层;(2)为了确保乙醇与水有明显的分层现象,加入乙醇时一定不要震荡.所以答案为:应该用胶头滴管将乙醇轻轻滴入水中,防止有震荡而直接混合;(3)乙醇在红色水的上面,要想证明乙醇溶于水,需要震荡.所以答案为:震荡试管后静置一会儿,发现上面无色液体变红,分层现象消失. 【分析】此题要了解课本实验操作的步骤和原理,了解操作的目的和意思。 六、实验探究题 25.【答案】(1)10 (2)玻璃棒;药匙 (3)D (4)100 (5)A,C,D 【解析】【解答】解:(1)100g×10%=10g,故需氢氧化钠:10g;(2)配制溶液需要的仪器包括:托盘天平、烧杯、量筒、胶头滴管、玻璃棒和药匙,故答案:玻璃棒、药匙;(3)天平指针左边偏转说明取用的氢氧化钠的质量大于10g了所以要减少氢氧化钠,故答案:D (4)选用量筒要一次能量取所需的液体并且量程要略大于或等于所要量取的液体的体积最好,故答案:100;(5)A、氢氧化钠变质后称取的10g氢氧化钠中氢氧化钠和杂质的质量是10g,所以所取的氢氧化钠的质量就小于10g,溶质质量分数小于10%,故正确; B、放反了只要砝码减游码的质量等于10g也能称量出10g氢氧化钠,配制的溶液溶质质量分数等于10%. C、氢氧化钠洒落外面造成溶液中氢氧化钠的质量小于10g,配制的溶液溶质质量分数小于10%. D、量水时仰视量取的水小于所用水的量,配制的溶液溶质质量分数大于10%. E、溶液是均匀稳定,配制好后溶液洒落前后溶质质量分数不变. 故答案选:A、C、D 【分析】运用溶液质量乘以溶质质量分数就得出溶质质量解答.(1)运用配制溶液需要的仪器包括:托盘天平、烧杯、量筒、胶头滴管、玻璃棒和药匙解答.(2)运用天平指针左边偏转说明取用的氢氧化钠的质量大于10g了所以要减少氢氧化钠解答.(3)运用选用量筒要一次能量取所需的液体并且量程要略大于或等于所要量取的液体的体积最好解答.(4)A、运用氢氧化钠变质后称取的10g氢氧化钠中氢氧化钠和杂质的质量是10g,所以所取的氢氧化钠的质量就小于10g解答; B、运用放反了只要砝码减游码的质量等于10g也能称量出10g氢氧化钠解答. C、运用氢氧化钠洒落外面造成溶液中氢氧化钠的质量小于10g解答. D、运用量水时仰视量取的水多于所用的谁的量解答. E、运用溶液是均匀稳定的性质解答. 七、综合题 26.【答案】(1)40g (2)60 (3)> 【考点】固体溶解度曲线及其作用,晶体和结晶的概念与现象 【解析】【解答】(1)t℃两条曲线相交,此时两物质的溶解度相等.所以查出的40g即为两物质的溶解度; (2)根据氯化铵的曲线,找到70℃,不难查出此时溶解度为60g.题目已预写了单位“g”,只需写上数值即可; (3)30℃两物质溶解度相等均为40g,而降温至10℃时氯化铵溶解度大于硝酸钾,所以,30℃等质量的两物质的饱和溶液降温至10℃时,硝酸钾晶体析出量会大于氯化铵; 故答案为:(1)40g;(2)60;(3)>.【分析】(1)根据溶解度曲线即可得知t℃时两种物质的溶解度; (2)找出70℃时氯化铵的溶解度曲线对应的纵坐标即可; (3)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多. 27.【答案】(1)双氧水;H2O2 (2)30;570 (3)5% 【考点】溶质的质量分数 【解析】【解答】解:(1)常用的医用消毒剂双氧水的溶质质量分数是5%,5%的含义是每100g双氧水中含H2O25g. 故填:双氧水;H2O2;(2)溶质质量=600g×5%=30g;溶剂质量600g﹣30g=570g. 故填:30;570;(3)溶液具有均一性,所以剩下的溶液中的溶质质量分数不变,仍然是5%. 故填:5%. 【分析】(1)根据溶质质量分数的概念填空;(2)溶质=溶液的质量×溶液中溶质的质量分数,溶液是由溶质和溶剂组成的所以溶剂质量=溶液的质量﹣溶质的质量;(3)溶液具有均一稳定的特点,所以不管溶液用去多少,剩余的溶液中的溶质的质量分数都不会变. 28.【答案】(1)8.5;91.5 (2)右 (3)玻璃棒 (4)100 【解析】【解答】解:(1)溶质质量=溶液质量×溶质的质量分数=100g×8.5%=8.5g,溶剂质量=溶液质量﹣溶质质量,则所需蒸馏水的质量=100g﹣8.5g=91.5g,体积为91.5g÷1g/cm3=91.5mL; 故填:8.5; 91.5;(2)托盘天平的使用要遵循“左物右码”的原则,因此称量时砝码应放在天平的右盘;故填:右;(3)在溶解过程中,为了加快物质的溶解,需用玻璃棒搅拌,故填:玻璃棒;(4)设需加水的质量为x,稀释前后溶质的质量不变,则 100g×8.5%=(100g+x)×4.25%,解得x=100g 故填:100. 【分析】(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量﹣溶质质量即可求得水的质量;(2)托盘天平的使用要遵循“左物右码”的原则分析;(3)在溶解过程中,为了加快物质的溶解,需用玻璃棒搅拌.(4)根据稀释前后溶质的质量不变分析.查看更多