- 2021-11-10 发布 |
- 37.5 KB |
- 24页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 2020中考化学真题 考点34 工艺流程
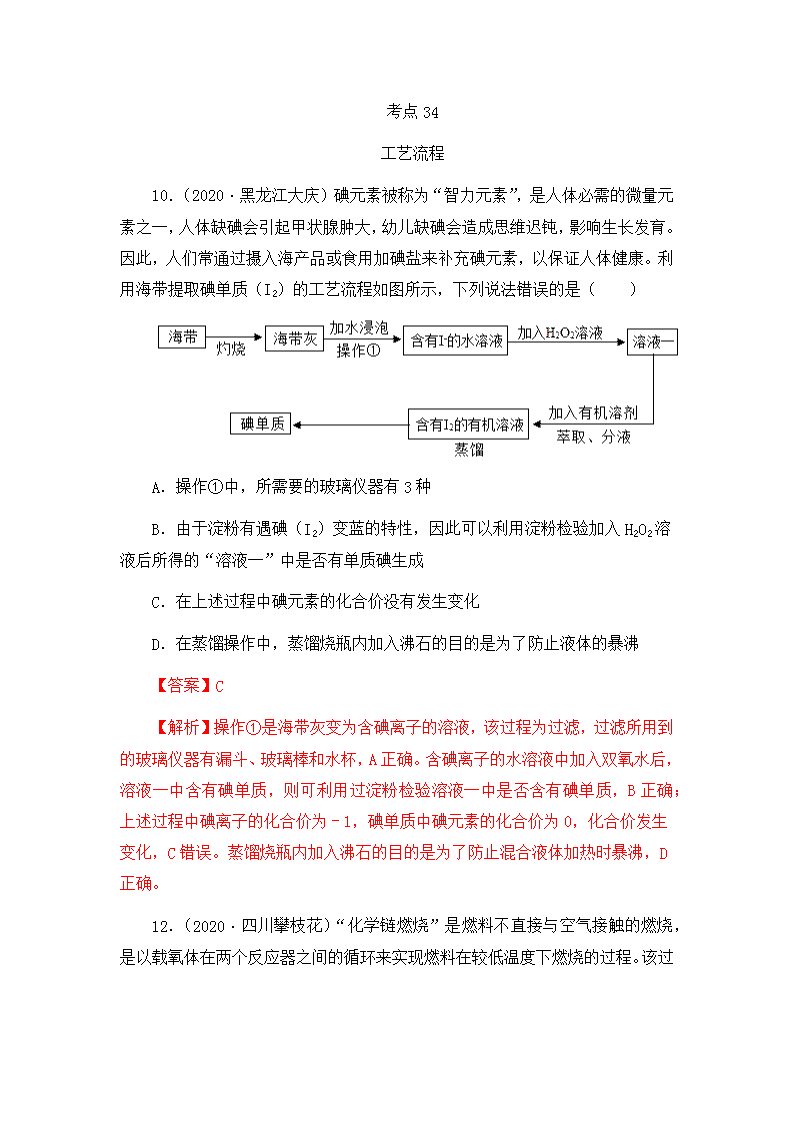
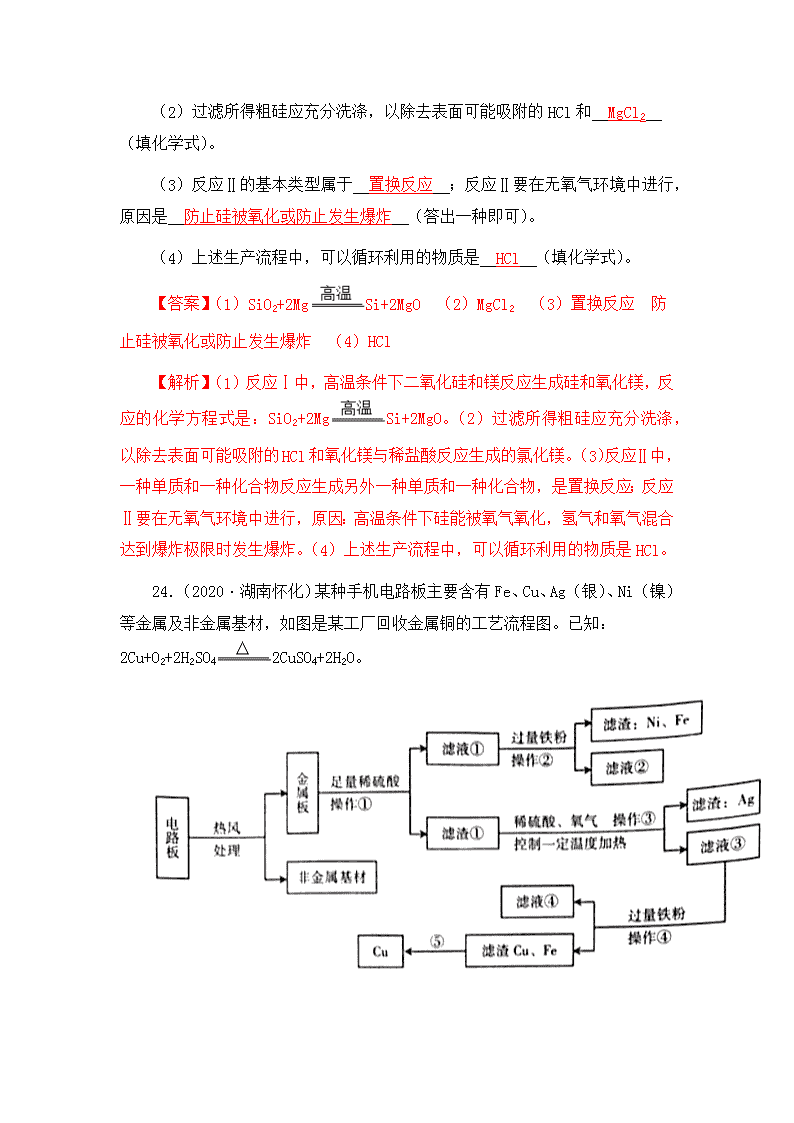
考点 34 工艺流程 10.(2020·黑龙江大庆)碘元素被称为“智力元素”,是人体必需的微量元 素之一,人体缺碘会引起甲状腺肿大,幼儿缺碘会造成思维迟钝,影响生长发育。 因此,人们常通过摄入海产品或食用加碘盐来补充碘元素,以保证人体健康。利 用海带提取碘单质(I2)的工艺流程如图所示,下列说法错误的是( ) A.操作①中,所需要的玻璃仪器有 3 种 B.由于淀粉有遇碘(I2)变蓝的特性,因此可以利用淀粉检验加入 H2O2 溶 液后所得的“溶液一”中是否有单质碘生成 C.在上述过程中碘元素的化合价没有发生变化 D.在蒸馏操作中,蒸馏烧瓶内加入沸石的目的是为了防止液体的暴沸 【答案】C 【解析】操作①是海带灰变为含碘离子的溶液,该过程为过滤,过滤所用到 的玻璃仪器有漏斗、玻璃棒和水杯,A 正确。含碘离子的水溶液中加入双氧水后, 溶液一中含有碘单质,则可利用过淀粉检验溶液一中是否含有碘单质,B 正确; 上述过程中碘离子的化合价为﹣1,碘单质中碘元素的化合价为 0,化合价发生 变化,C 错误。蒸馏烧瓶内加入沸石的目的是为了防止混合液体加热时暴沸,D 正确。 12.(2020·四川攀枝花)“化学链燃烧”是燃料不直接与空气接触的燃烧, 是以载氧体在两个反应器之间的循环来实现燃料在较低温度下燃烧的过程。该过 程具有无火焰、低污染、高效率等特点。氧化镍(NiO)作载氧体的“化学链燃 烧”过程如图。与直接燃烧甲烷相比,对该技术的评价错误的是( ) A.反应更充分、能源利用率高 B.较安全,减少爆炸风险 C.消耗等质量甲烷,参加反应氧气较少 D.有利于分离和回收较纯净的二氧化碳 【答案】C 【解析】燃料不直接与空气接触燃烧,而是以载氧体在两个反应器之间的循 环来实现燃料燃烧,可以使反应更充分、能源利用率高,A 正确;较低温度下燃 烧可以减少爆炸的危险,较为安全,B 正确;消耗等质量甲烷,参加反应氧气不 会改变,C 错误;此操作装置的改变有利于分离和回收较纯净的二氧化碳,D 正 确。 23.(2020·四川攀枝花)制造芯片的基材主要是高纯硅。如图是制备高纯 硅的一种工艺流程: 回答下列问题: (1)反应Ⅰ的化学方程式是 SiO2+2Mg Si+2MgO 。 (2)过滤所得粗硅应充分洗涤,以除去表面可能吸附的 HCl 和 MgCl2 (填 化学式)。 (3)反应Ⅱ的基本类型属于 置换反应 ;反应Ⅱ要在无氧气环境中进行, 原因是 防止硅被氧化或防止发生爆炸 (答出一种即可)。 (4)上述生产流程中,可以循环利用的物质是 HCl (填化学式)。 【答案】(1)SiO2+2Mg Si+2MgO (2)MgCl2 (3)置换反应 防止 硅被氧化或防止发生爆炸 (4)HCl 【解析】(1)反应Ⅰ中,高温条件下二氧化硅和镁反应生成硅和氧化镁,反 应的化学方程式是:SiO2+2Mg Si+2MgO。(2)过滤所得粗硅应充分洗涤, 以除去表面可能吸附的 HCl 和氧化镁与稀盐酸反应生成的氯化镁。(3)反应Ⅱ中, 一种单质和一种化合物反应生成另外一种单质和一种化合物,是置换反应;反应 Ⅱ要在无氧气环境中进行,原因:高温条件下硅能被氧气氧化,氢气和氧气混合 达到爆炸极限时发生爆炸。(4)上述生产流程中,可以循环利用的物质是 HCl。 24.(2020·湖南怀化)某种手机电路板主要含有 Fe、Cu、Ag(银)、Ni(镍) 等金属及非金属基材,如图是某工厂回收金属铜的工艺流程图。已知: 2Cu+O2+2H2SO4 2CuSO4+2H2O。 (1)电路板不直接焚烧而采取热风处理的主要目的是 防止金属和氧气反 应生成金属氧化物 。 (2)操作①的名称是 过滤 。 (3)写出滤液③与铁粉反应的化学方程式 Fe+CuSO4=FeSO4+Cu 。 (4)Fe、Cu、Ag、Ni 在溶液中的金属活动性顺序由强到弱依次为 Fe>Ni >Cu>Ag 。 (5)写出⑤得到纯铜的一种方法 在滤渣中加入一定量的稀硫酸后,过 滤 。 【答案】(1)防止金属和氧气反应生成金属氧化物 (2)过滤 (3)Fe+CuSO4 =FeSO4+Cu (4)Fe>Ni>Cu>Ag (5)在滤渣中加入一定量的稀硫酸后,过 滤 【解析】金属板加入足量的稀硫酸中,较活泼的金属能与酸反应,通过过滤 得到滤渣①和滤液①;滤液中加入足量的铁得到了铁和镍,说明了镍能与稀硫酸 发生反应;滤渣①中加入稀硫酸、氧气控制温度加热,铜能与稀硫酸氧气发生了 反应生成了硫酸铜,过滤滤渣中含有银,滤液③中含有硫酸铜和稀硫酸,加入铁 粉会生成滤渣 Cu、Fe,所以滤液④中含有硫酸亚铁。(1)电路板不直接焚烧而 采取热风处理的主要目的是:防止金属和氧气反应生成金属氧化物;(2)操作① 的名称是过滤;(3)滤液③与铁粉的反应是铁和硫酸铜反应生成硫酸亚铁和铜, 化学方程式为:Fe+CuSO4=FeSO4+Cu;(4)滤液①中加入足量的铁得到了镍,铁 比镍活泼,铜、银不会与稀硫酸反应,所以铜、银的金属活动性排在氢的后面, 铜、氧气、硫酸加热会生成硫酸铜和水,银不会与氧气、硫酸反应,铜的金属活 动性比银强,所以 Fe、Cu、Ag、Ni 在溶液中的金属活动性顺序由强到弱依次为: Fe>Ni>Cu>Ag;(5)铜的金属活动性排在氢的后面,所以⑤得到纯铜的一种方 法是:在滤渣中加入一定量的稀硫酸后,过滤。 24.(2020·湖南益阳)以镁矿石(主要成分 MgCO3、SiO2)为原料生产 MgO 的主要工艺流程如图: 已知:SiO2 难溶于水和常见的酸;“沉镁”过程中有 Mg(OH)2 生成。 (1)操作Ⅰ、Ⅱ的名称是 过滤 。 (2)滤渣 a 的主要成分是 SiO2 (填化学式)。 (3)“酸浸”时稀硫酸与镁矿石主要成分发生反应的化学方程式是 MgCO3+H2SO4=MgSO4+H2O+CO2↑ 。 (4)“加热”过程中发生 分解 反应(填基本反应类型)。 【答案】(1)过滤 (2)SiO2 (3)MgCO3+H2SO4=MgSO4+H2O+CO2↑ (4) 分解 【解析】(1)操作Ⅰ和Ⅱ都是实现了固液分离,常用方法为过滤;(2)矿石 主要为碳酸镁和二氧化硅,碳酸镁可与硫酸反应,二氧化硅但是不与硫酸反应, 所以过滤得到滤渣 a 为二氧化硅。(3)碳酸镁与硫酸反应生成硫酸镁、水和二氧 化碳,化学方程式为 MgCO3+H2SO4=MgSO4+H2O+CO2↑。(4)滤渣为氢氧化镁,经过 加热分解生成氧化镁和水,符合一变多的特点,所以为分解反应。 28.(2020·湖南株洲)覆铜板是制作印刷线路板的基本材料。覆铜板中的 金属 Sn 占 2﹣10%,Cu 占 90﹣98%.简易工艺流程如图: (1)将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固 体)和铜锡粉。根据化学常识回答,此工艺利用的是 的性质(填字母代 号)。 a.溶解性不同 b.密度不同 c.沸点不同 (2)步骤④中涉及的分离操作是 (填操作名称)。 (3)通过步骤⑤和⑥所得洗涤液的 pH 7(填“>”、“<”、“=”)。 (4)设计步骤⑦的主要目的是 。 (5)步骤⑨中涉及的主要化学方程式为 。 28. (1)b (2)过滤 (3)< (4)节约原料,循环利用 (5)Sn(OH) 4 SnO2+2 H2O 【解析】(1)有机树脂材料的密度比水小,铜锡粉的密度比水大。(2)经过 步骤④后得到的是固体和液体,所以操作为过滤。(3)步骤⑤是酸洗,则洗涤液 中一定含有酸,所以洗涤液的 pH 小于 7。(4)洗涤液中含有酸,仍可以浸出铜 锡粉。(5)反应物是 Sn(OH)4,生成物是 SnO2,条件是焙烧,根据质量守恒定 律,反应还有水生成,化学方程式为:Sn(OH)4 SnO2+2 H2O。 25.(2020·云南昆明)工业上利用氟碳铈矿(主要成分为 CeFCO3)提取 CeCl3 的一种工艺流程如图: (1)流程中 Ce(BF4)3 转化成 KBF4 的基本反应类型是 复分解反应 。 (2)在足量氧气中高温焙烧 CeFCO3,化学方程式为 4CeFCO3+O2 3CeO2+CeF4+4CO2 。 (3)流程涉及的化合物中,铈元素的化合价为 +3、+4 价。 (4)酸浸过程中,CeO2 与盐酸反应有刺激性气味的气体单质生成,且化学 方程式中 CeO2 与盐酸的化学计量数之比为 1:4,则化学方程式为 2CeO2+8HCl =2CeCl3+Cl2↑+4H2O 。 【答案】(1)复分解反应 (2)4CeFCO3+O2 3CeO2+CeF4+4CO2 (3) +4、+3 (4)2CeO2+8HCl=2CeCl3+Cl2↑+4H2O 【解析】(1)Ce(BF4)3 和氯化钾反应生成 KBF4 沉淀和 CeCl3,该反应是两 种化合物反应生成了两种化合物,属于复分解反应;(2)在足量氧气中高温焙烧 CeFCO3 生成了 CeO2 和 CeF4 和 CO2,化学方程式为: 4CeFCO3+O2 3CeO2+CeF4+4CO2;(3)在化合物中,化合价代数和为零,在 CeO2 中氧元素显﹣2,所以铈的化合价为+4,在 CeCl3 中,氯元素的化合价为﹣1,所 以铈的化合价为+3;(4)酸浸过程中,CeO2 与盐酸反应有刺激性气味的气体单质 生成,且化学方程式中 CeO2 与盐酸的化学计量数之比为 1:4,生成了氯气,化 学方程式为:2CeO2+8HCl=2CeCl3+Cl2↑+4H2O。 18.(2020·北京)从氯碱工业产生的盐泥中回收 BaSO4,其主要工艺流程如 图。 已知:①盐泥的主要成分为 BaSO4、NaCl、Mg(OH)2 和 CaCO3。 ②BaSO4 难溶于水,不与盐酸反应。 (1)除去 NaCl,利用的性质是 氯化钠易溶于水 。 (2)酸溶槽中发生中和反应的化学方程式为 Mg(OH)2+2HCl= MgCl2+2H2O 。 (3)过滤器中分离出来的固体是 硫酸钡 。 【答案】(1)氯化钠易溶于水 (2)Mg(OH)2+2HCl=MgCl2+2H2O (3) 硫酸钡 【解析】((1)除去 NaCl,可以通过溶解、过滤进行,利用的性质是氯化钠 易溶于水。(2)酸溶槽中稀盐酸和氢氧化镁反应生成氯化镁和水,发生的是中和 反应,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O。(3)过滤器中分离 出来的固体是硫酸钡,是因为硫酸钡不能和稀盐酸反应。 20.(2020•广东)某废酸液主要含 H2SO4 和 FeSO4,研究人员利用 CaCO3 消耗部分酸,再加入廉价的电石渣(主要成分为 CaO),通过一系列操作可得到 磁性铁,成本较低且有利于保护环境。工艺流程如下: (1)该废酸液的 pH______7(填“<”或“>”)。操作Ⅰ的名称为__________。 (2)电石渣转化为石灰乳的过程会___________(填“吸收”或“放出”) 热量。 (3)“沉铁”过程中,溶液中的 FeSO4 和石灰乳中的 Ca(OH)2 发生复分解反 应,生成的 产物是___________和___________(填化学式)。 (4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 _________________。 (5)研究发现,“沉铁”后,溶液的 pH 对磁性铁产率的影响如下表。欲获 得高的产率,最适宜的 pH 为 。pH 较低时产率较低的主要原因 是 。 溶液 的 pH 6.0 6.5 7.0 7.5 8.0 9.0 产物 颜色 黄 褐色 黄 褐色 较黑 很黑 很黑 灰黑 色 产率 (%) 43.9 50.6 86.2 93.0 92.3 91.6 【答案】(1)< 过滤 (2)放出 (3)CaSO4 Fe(OH)2(两化学式的顺 序可互换)(4)Fe3O4 (5)7.5 pH 较低时,Fe(OH)2 不易生成 【解析】(1)废酸液中含有硫酸,所以废酸液的 pH 小于 7;操作Ⅰ得到滤 渣和溶液,即该操作将溶液和没有溶解或不溶性的固体分离开来,因此该操作为 过滤。(2)电石渣中含有氧化钙,氧化钙与水反应放出热量,所以电石渣转化为 石灰乳时会放出热量。(3)“沉铁”过程中是硫酸亚铁与氢氧化钙反应,使铁以 沉淀形式析出,即生成氢氧化亚铁,所以该反应的生成物为硫酸钙和氢氧化亚铁, 化学式为 Fe(OH)2、CaSO4。(4)磁铁磷的主要成分是四氧化三铁,其化学式为 Fe3O4。(5)由表中内容可知,磁性铁产率最高时溶液 pH 为 7.5,pH 较低时,氢 氧化亚铁不易生成,所以磁性铁的产率较低。 19. (2020•江西)2019 年诺贝尔化学奖授予对锂离子电池研究作出贡献的 三位科学家。下图是从钴酸锂废极片[主要成分为钴酸锂(LiCoO2)]中回收得到 Co2O3 和 Li2CO3 的一种工艺流程。 (1)操作 1 中,粉碎废极片的目的是 ; (2)实验室完成操作 2 时,需用到的玻璃仪器是 (填一种即可); (3)操作 4 中,在高温条件下,CoC2O4 在空气中反应生成 Co2O3 和二氧化 碳,化学方程式为 ; (4)操作 5 中,Li2CO3 晶体用热水洗涤比用冷水洗涤损耗更少,说明 Li2CO3 的溶解度随温度升高而 。 【答案】(1)增大反应物间的接触面积,使反应更快、更充分 (2)玻璃棒 (或烧杯,漏斗) (3)4CoC2O4+3O2 2Co2O3+8CO2 (4)减小 【解析】(1)粉碎废极片,可增大与硫酸、过氧化氢溶液的接触面积,使反 应理快、更充分。(2)操作 2 得到滤渣和溶液,所以操作 2 是过滤,实验室进行 过滤操作时,需用到的玻璃仪器有烧杯、漏斗和玻璃棒。(3)根据题意高温条件 下,CoC2O4 在空气中反应生成 Co2O3 和二氧化碳,根据质量守恒定律,空气中 氧气参加了反应,所以反应的化学方程式为 4CoC2O4+3O2 2Co2O3+8CO2。 (4)碳酸锂晶体用热水洗涤比用冷水洗涤损耗更少,说明碳酸锂在热水中的溶 解度较冷水中小,所以碳酸锂的溶解度随温度升高而减小。 17.(2020·北京)CuO 是某种无机胶黏剂的组分之一,制备的部分流程如 图。 已知:CuO 难溶于水。 (1)反应釜中发生的反应有: ①2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ ②Cu(OH)2 CuO+H2O 其中,属于复分解反应的是 ① (填“①”或“②”)。 (2)过滤器分离出的滤液中一定含有的溶质是 Na2SO4 。 【答案】(1)① (2)Na2SO4 【解析】(1)氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,是两种化 合物相互交换成分生成两种新的化合物,是复分解反应。(2)过滤器分离出的滤 液中一定含有的溶质是氢氧化钠和硫酸铜反应生成的 Na2SO4。 8.(2020·浙江宁波)铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补 血剂。某硫酸厂产生的炉渣中除了有 Fe2O3、FeO,还有一定量的 SiO2。兴趣小组 利用炉渣尝试制备 FeCO3,其流程如下: 【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2 不溶于水,也不与稀硫酸反应】 (1)操作 1 的名称是___________。 ( 2 ) 溶 液 A 中 的 溶 质 除 H2SO4 外 , 还 存 在 _____________________________________________。 上述流程中生成固体 c 的化学方程式 ______________________________________________。 【答案】(1)过滤 (2)Fe2(SO4)3、FeSO4 (3)Na2CO3+FeSO4= Na2SO4+FeCO3 ↓ 【解析】(1)操作 1 后得到的是固体和液体,所以操作 1 的名称是过滤。(2) Fe2O3、FeO 和稀硫酸反应分别生成 Fe2(SO4)3、FeSO4,稀硫酸过量,所以溶液 A 中的溶质除 H2SO4 外,还存在 Fe2(SO4)3、FeSO4。操作 2 中过量的铁能和稀硫酸反 应生成硫酸亚铁,能和 Fe2(SO4)3 反应生成 FeSO4,所以溶液 B 中的溶质是 FeSO4; 操作 4 为洗涤、干燥,得到 FeCO3 说明固体 C 为 FeCO3,则操作 3 中的反应为硫 酸亚铁和碳酸钠发生复分解反应生成 Na2SO4 和 FeCO3,化学方程式为: Na2CO3+FeSO4= Na2SO4+FeCO3↓。 11.(2020·贵州黔西南)农谚“雷雨发庄稼”的化学原理是:雷电时雨水 里含有微量硝酸。硝酸的形成过程如图: 回答下列问题: (1)单质 X 是一种常见气体,其化学式是 O2 。 (2)反应②属于基本反应类型中的 化合 反应。 (3)反应③在常温下即可发生,该反应的化学方程式是 3NO2+H2O= 2HNO3+NO 。 (4)为了提高氮原子的利用率,可循环利用的物质是 NO (填化学式)。 (5)在实验室通常采用以下方法制取 NO:4□+5O2 4NO+6H2O,“□” 中物质的化学式为 NH3 、因为在化学反应前后原子的 种类和个数 没有改 变。 【答案】(1)O2 (2)化合 (3)3NO2+H2O=2HNO3+NO (4)NO (5)NH3 种类和个数 【解析】(1)根据质量守恒定律,反应前后元素的种类不变,氮气和单质 X 反应生成一氧化氮,故 X 是氧气。(2)反应②是一氧化氮和氧气反应生成二氧化 氮,属于化合反应。(3)反应③是二氧化氮和水反应生成硝酸和一氧化氮,化学 方程式为:3NO2+H2O=2HNO3+NO。(4)根据图示可以看出,可以循环利用的物质 是一氧化氮。(5)化学反应前后原子的种类和个数不变,则反应前“4□”中含 有 4 个 N 原子,12 个 H 原子,故“□”中含有 1 个 N 原子,3 个 H 原子,其化学 式为:NH3。 23.(4 分) (2020·浙江杭州)医用消毒酒精为 75%的乙醇溶液,化工生产中 可用 A(主要成分的化学式为 C8H18)作原料,经以下流程制取乙醇: (1)步骤①的转化属于________(选填“化学”或“物理”变化)。 (2)步骤②是乙烯和含两种元素的化合物 B 发生化合反应,则 B 中所含元素是 ________。 【答案】化学 氢、氧 【解析】(1)步骤①是 A(主要成分是 C8H18)生成新物质乙烯,属于化学变 化。(2)根据质量守恒定律可知反应前后元素种类不变,乙烯和 B 发生化合反应 生成乙醇,乙醇中含有 C、H、O 三种元素,反应物乙烯中含 C、H,则 B 中一定 含有 O 元素;由于该反应属于化合反应,生成的乙醇分子中 C、H 原子的个数比 为 1:3,反应物中乙烯分子中 C、H 原子个数比为 1:2,则化合物 B 中一定含有 H。 29.(8 分) (2020·浙江杭州)一种制备氢氧化镁的生产流程如图所示,MgCl2 和 NaOH 按恰好完全反应的比例加料。 (1)写出步骤 c 中发生反应的化学方程式:____________________。 (2)x=_________。 (3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是 _________________。 (4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是___________。 ①盐酸 ②氯化钙 ③氨水 ④碗酸镁 【答案】(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl (2)280 (3)NaCl (4)③ 【解析】(1)步骤 c 中是氢氧化钠和氯化镁之间的反应,化学方程式为:MgCl2 +2NaOH ===2NaCl+ Mg(OH)2↓。(2)设在时间为 t 时氢氧化钠溶液与氯化镁溶液 恰好完全反应,则有:MgCl2 + 2NaOH=Mg(OH)2↓+2NaCl 95 80 0.1g/min×t×332.5g/L 0.1g/min×t×xg/L 85:80=0.1g/min×t×332.5g/L:0.1g/min×t×xg/L 解得 x=280 (3)恰好完全反应后溶液中的溶质是氯化钠,所以洗涤的目的是除去表面 的氯化钠杂质。(4)氯化镁溶液只有和碱溶液反应才能得到氢氧化镁沉淀,盐酸 属于酸,氯化钙和硫酸镁属于盐,只有氨水中含有氢氧根离子,能和氯化镁反应 生成氢氧化镁沉淀。 31.(2020·浙江湖州)一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4·H2O, 是一种高效、安全的杀菌剂。它在乙醇——水混合溶剂中的溶解度随乙醇体积分 数的变化曲线如图甲所示。小明在实验室以氧化铜为主要原料合成该物质,他设 计的合成路线如图乙所示: (1)溶液 A 中一定存在的溶质为 (2)溶液 B 中含硫酸四氨合铜,“一系列操作”是指向溶液 B 中加入适 量 、过滤、洗涤、干燥等。 【答案】(1)CuSO4 (2)乙醇 【解析】⑴氧化铜和稀硫酸反应的化学方程式为:CuO+H2SO4==CuSO4+H2O,则 溶液中一定有 CuSO4。⑵从图甲可知,乙醇的体积分数越大,硫酸四氨合铜的溶 解度越小,则该操作是扩大乙醇的体积分数(不停加乙醇),促使晶体的析出。 14.(2020·新疆)从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜 溶液。其工艺流程如图所示: (1)图中“操作”的名称是 过滤 。 (2)写出所得贵重金属中任意一种成分的化学式 Au 。 (3)写出①中发生的化学反应方程式 Fe+H2SO4=FeSO4+H2↑或 2Al+3H2SO4 ═Al2(SO4)3+3H2↑ (任写一种);该反应的基本类型为 置换反应 。 (4)写出②中发生的化学反应方程式 2Cu+2H2SO4+O2 2CuSO4+2H2O 。 【答案】(1)过滤 (2)Au(或 Pt)(3)①Fe+H2SO4=FeSO4+H2↑ 或 2Al+3H2SO4 ═Al2(SO4)3+3H2↑ 置换反应 (4)②2Cu+2H2SO4+O2 2CuSO4+2H2O 【解析】(1)图中“操作”的名称是过滤,通过过滤能够除去不溶于水的物 质。(2)所得贵重金属是金、铂,化学式分别是 Au、Pt。(3)①中稀硫酸和铁 反应生成硫酸亚铁和氢气,和铝反应生成硫酸铝和氢气,发生的化学反应方程式: Fe+H2SO4=FeSO4+H2↑、2Al+3H2SO4═Al2(SO4)3+3H2↑,都是置换反应。(4)②中 加热条件下稀硫酸和铜、氧气反应生成硫酸铜和水,发生的化学反应方程式: 2Cu+2H2SO4+O2 2CuSO4+2H2O。 11.(2020·贵州黔南州)高氯酸钾(KClO4)是一种性能稳定的物质,主要 用作发烟剂、引火剂、氧化剂和化学分析试剂,工业生产上生产的高氯酸钾的工 艺流程如图: 回答下列问题: (1)为加快氯酸钾的溶解,可采取的措施为 搅拌 。 (2)流程中的分离操作相当于实验室中的 过滤 。 (3)反应釜中发生的化学反应方程式为 KClO3+NaClO4=NaClO3+KClO4↓ , 该反应属于基本反应类型中的 复分解 反应。 (4)电解 NaClO3 溶液时,除产生 NaClO4 外,还得到一种清洁的高能燃料, 该反应的化学方程式为 NaClO3+H2O NaClO4+H2↑ 。 【答案】(1)搅拌 (2)过滤 (3)KClO3+NaClO4=NaClO3+KClO4↓ 复分 解 (4)NaClO3+H2O NaClO4+H2↑ 【解析】(1)为加快氯酸钾的溶解,可采取的措施为搅拌、加热等。(2)流 程中的分离操作能将固液分离,该操作相当于实验室中的过滤。(3)由流程中物 质的变化可知,反应釜中发生的化学反应方程式为:KClO3+NaClO4=NaClO3+KClO4 ↓,该反应由两种化合物相互交换成分生成了两种新的化合物,属于基本反应类 型中的复分解反应。(4)电解 NaClO3 溶液时,除产生 NaClO4 外,还得到一种清 洁的高能燃料,由质量守恒定律可知,该气体是氢气,反应的化学方程式为: NaClO3+H2O NaClO4+H2↑。 26. (2020·江苏苏州)硝酸钙可用于无土栽培等。一种利用石灰石制备硝 酸钙晶体的流程如下: 已知:硝酸会挥发、受热会分解。 (1)气体 X 为 (填化学式)。 (2)“制浆”所得的混合物属于________________(填字母)。 a.溶液 b.悬浊液 c.乳浊液 (3)写出“中和”步骤主要反应的化学方程式:________________。 (4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合 物基本变澄清和________________。 (5)“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入 水量太多会导致________________。 (6)若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低、同时会 产生污染气体 NOx。产生 NOx 的原因是________________。 26. (1)CO2 (2)b (3)Ca(OH)2+2HNO3=Ca(NO3)2+ 2H2O (4)溶液 的 pH 等于 7(或溶液的 pH 略小于 7) (5)结晶步骤能耗过多 (6)CaO 与 HNO3 反应放出大量热,HNO3 受热分解产生 NO2 【解析】(1)石灰石煅烧生成氧化钙和二氧化碳,则气体 X 为 CO2。(2)氧 化钙和水反应生成氢氧化钙,氢氧化钙微溶于水,所得混合物属于悬浊液。(3) “中和”步骤中是氢氧化钙和硝酸反应,化学方程式为:Ca(OH)2+2HNO3=Ca(NO3) 2+ 2H2O。(4)中和反应完全发生时,溶液的 pH 值为 7。(5)加入水太多时,所 得溶液中硝酸钙的浓度会偏低,会导致结晶步骤能耗过多。(6)硝酸不稳定,受 热易分解,硝酸和氧化钙反应时会放热,导致硝酸分解产生 NOx,污染环境,利 用率降低。 12.(2020·贵州黔东南)某兴趣小组查阅资料得知:氯酸钾(KClO3) 在 加热和二氧化锰做催化剂的条件下生成氯化钾和氧气。他们利用该原理制取氧气, 并回收提纯氯化钾和二氧化锰,按以下流程图进行实验,按要求完成下列问题: (1)步骤Ⅰ中发生反应的化学方程式为 2KClO3 2KCl+3O2↑ 。 (2)步骤Ⅳ中操作 y 的名称是 蒸发 。 (3)步骤Ⅲ中“洗涤”操作 2 次后,收集第 3 次的洗涤液并进行检验。取 少量洗涤液于试管中,滴加 硝酸银 溶液,有白色沉淀生成,说明还没有洗涤 干净。 (4)实验结束后,理论上能够回收得到 6 克二氧化锰。 【答案】(1)2KClO3 2KCl+3O2↑ (2)蒸发 (3)硝酸银 (4)6 【解析】(1)在二氧化锰的催化作用下、加热氯酸钾分解为氯化钾和氧气, 化学方程式为:2KClO3 2KCl+3O2↑。(2)从氯化钾溶液中获得氯化钾固体 的方法是蒸发。(3)检验是否洗净就是检验是否存在氯化钾,因为氯化钾溶液能 与硝酸银溶液反应生成氯化银白色沉淀,所以取少量洗涤液于试管中,滴加硝酸 银溶液,有白色沉淀生成,说明还没有洗涤干净。(4)由催化剂的特点可知,催 化剂的质量在化学反应前后保持不变,所以实验结束后,理论上能够回收得到 6 克二氧化锰。 15. (2020·安徽)硫酸亚铁晶体是重要的化学试剂。传统制备方法是用铁 屑与稀硫酸反应,因铁屑中含有硫、磷等杂质,与稀硫酸反应会产生刺鼻、呛人 的有毒气体。某科技小组改用铁屑与硫酸铜溶液反应制备硫酸亚铁晶体,流程如 下: (1)步骤①中反应的化学方程式为 。 (2)操作Ⅰ的名称是 。步骤②涉及到蒸发,蒸发时 必需的仪器有铁架台(含铁圈)、酒精灯、玻璃棒、 。 (3)用硫酸铜溶液代替稀硫酸制备硫酸亚铁晶体,优点是 。 【答案】⑴Fe+CuSO4==FeSO4+Cu ⑵过滤 蒸发皿 ⑶不产生有毒气体,安 全环保 【解析】⑴铁与硫酸铜发生置换反应生成铜和硫酸亚铁。⑵操作 I 得到固体 和液体,所以是过滤。蒸发时一定会用到蒸发皿。⑶铁屑中含有硫、磷等杂质, 与稀硫酸反应会产生刺鼻、呛人的有毒气体,而铁屑与硫酸铜溶液反应就不会产 生有毒气体,更环保一些。 29.(2020·浙江温州)小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁, 实验流程如下: 资料:①Fe2(SO4)3+Fe=3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。 (1)配制 50g 溶质质量分数为 19.6%的稀硫酸,需溶质质量分数为 98%的浓 硫酸 g。 (2)写出该实验中的一条化学方程式(除资料①中的反应外) 。 (3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的 是 。 【答案】(1)10 (2)Fe+H2SO4=FeSO4+H2↑[或 Fe2O3 + 3H2SO4==Fe2(SO4)3 + 3H2O] (3)使生成的硫酸铁完全转化为硫酸亚铁,防止生成的硫酸亚铁被氧化 【解析】⑴50g×19.6%÷98%=10g。⑵生锈的铁屑,有铁和铁锈(氧化铁), 它们都能与硫酸反应,对应的化学方程式分别为 Fe+H2SO4=FeSO4+H2↑和 Fe2O3+3H2SO4== Fe2(SO4)3+3H2O。⑶从资料可以知道,硫酸亚铁容易转化成硫酸铁, 铁能与硫酸铁反应生成硫酸亚铁,所以如果铁有剩余,则硫酸铁不能存在,只存 在硫酸亚铁。故铁有剩余就能保证产品硫酸亚铁的纯度。 17.(2020•四川德阳)金属钛常被用于航天、化工、医疗领域,工业上常用 钛铁矿制取钛,并获得副产品氧化钛,其工艺流程的部分步骤如图所示: (1)TiO2 中钛元素的化合价为 。 (2)在下列反应中,属于分解反应的有 (填标号)。 A.反应① B.反应② C.反应③ D.反应④ (3)反应⑤的化学方程式为:2FeSO4 Fe2O3 + SO3↑+X↑,则 X 的化 学式为 。 【答案】(1)+4 (2)AD (3)SO2 【解析】(1)二氧化钛中氧元素显-2 价,根据化合物中正负化合价的代数和 为零,可知钛的化合价为+4。(2)反应①的反应物只有一种,生成物有水和二氧 化钛,属于分解反应;反应②反应物有三种,不属于分解反应;反应③反应物有 两种,不属于分解反应;反应④是氯化镁在通电条件下生成镁和氯气,反应属于 分解反应。(3)根据化学反应前后原子的种类和数目不变,可知一个 X 微粒由 一个硫原子和二个氧原子构成,即 X 为二氧化硫。 23.(2020·山东泰安)无水氯化钙在工业上有广泛的用途。以石灰石矿粉 (含有 SiO2、Fe2O3、MgSO4 等杂质)为原料,生产无水氯化钙的流程如下图: 回答下列问题: (1)从流程图中推知:SiO2 具有的化学性质是 。 (2)氧化铁与盐酸反应的化学方程式为 。 (3)滤渣 3 中除有 Ca(OH)2 外,还有 (填化学式,下同)。 (4)产品中的杂质除极少量 H2O 外,最有可能含的是 。 【答案】(1)不能与盐酸反应 (2)6HCl+Fe2O 3=2FeCl3 + 3H2O (3) Mg(OH)2、Fe(OH)3 (4)BaCl2 【解析】(1)石灰石矿粉加入盐酸后过滤能够得到二氧化硅的固体,则能够 推知二氧化硅不能够和盐酸反应的化学性质。(2)氧化铁与盐酸反应的化学方程 式为:6HCl+Fe2O 3=2FeCl3 + 3H2O。(3)石灰乳中含有氢氧化钙,氢氧化钙能够 和加盐酸后生成的氯化铁、加氯化钡后生成的氯化镁反应分别生成氢氧化铁、氢 氧化镁沉淀,所以滤渣 3 中除有 Ca(OH)2 外、还有氢氧化镁和氢氧化铁(Mg (OH)2、Fe(OH)3)。(4)从整个过程看如果加入氯化钡量较多,经过一系列 操作后并没有能够对它进行去除,所以产品中还可能含有氯化钡(BaCl2)。 15. (2020·四川雅安)高锰酸钾是一种重要的化工产品,在化学、生产、 生活等场境中都有重要的用途。某工厂生产高锰酸钾的流程如下图所示。 请回答下列问题: (1)写出高锰酸钾的一种用途___________。 (2)“I 混合加热”发生的主要是___________(填“物理”或“化学”) 变化。 (3)请将“Ⅱ氧化反应”发生反应的化学方程式补充完整(在横线上填化 学式)。 _______+2MnO2+4KOH 加热 2K2MnO4+2____。 (4)“Ⅲ电解”反应中,反应前后化合价发生变化的元素有____________ (写元素符号)。 (5)生产流程中可循环利用的物质是___________(写化学式)。 【答案】(1)实验室制氧气(或医疗上可用作消毒、杀菌剂等) (2)物理 (3)O2 H2O (4) Mn、H (6)KOH 【解析】(1)高锰酸钾可用作消毒、杀菌剂,实验室制氧气等。(2)“I 混 合加热”开始时是 MnO2、KOH 的固体混合物,加热后是 MnO2、KOH 的融化的混合 物,没有新物质产生,发生的主要是物理变化。(3)根据“Ⅱ氧化反应”反应物 是 MnO2、KOH 和通入的空气,从图知道最后排出的气体是氮气等,生成了 K2MnO4 和 H2O,所以参加反应的还有 O2;反应物中有 Mn、O、K、H 四种元素,而生成物 只有 Mn、O、K 三种元素,所以生成物中还有含有 H 元素的物质,反应前后 Mn、 K 原子的数目相等,反应前有 4 个 H 原子,反应后也有 4 个 H 原子,含在 2 个未 知分子中,所以每个未知分子含有 2 个 H 原子,O 原子反应前有 10 个,反应后 2 个 K2MnO4 中含有 8 个氧原子,还有 2 个氧原子含在 2 个未知分子中,所以每个未 知分子含有 1 个氧原子,则生成物补充 H2O。(4)“Ⅲ电解”反应中,反应物是 K2MnO4 和 H2O,各元素的化合价是 K:+1 价,Mn:+6 价,O:-2 价,H:+1 价;生 成物是 KMnO4、KOH 和 H2,各元素的化合价是 K:+1 价,Mn:+7 价,O:-2 价, KOH 中的 H:+1 价,H2 中的 H:0 价;反应前后化合价发生变化的元素有 Mn、H。 (5)根据生产高锰酸钾的流程图,流程中可循环利用的物质是 KOH。 15.(2020·四川泸州)菱镁矿中主要含 MgCO3、FeCO3 和 SiO2,以菱镁矿为 原料制取镁的工艺流程如图。 回答下列问题: (1)菱镁矿属于 混合物 (选填“纯净物”或“混合物”)。 (2)流程中滤渣 a 主要成分是 SiO2 。 (3)写出菱镁矿中 MgCO3 与稀 HCl 反应的化学方程式 MgCO3+2HCl= MgCl2+H2O+CO2↑ 。 (4)溶液 b→溶液 c 反应的化学方程式为:4FeCl2+ O2 +4HCl=4FeCl3+2H2O (补充完方程式) (5)溶液 c 调 pH 使 Fe3+完全沉淀为 Fe(OH)3 从而与 Mg2+分离,则调 pH 的 范围应为 2.8﹣ 8.9 。 已知:物质沉淀的 pH 见下表: 物质 Mg(OH)2 Fe(OH)3 开始沉淀的 pH 8.9 1.5 完全沉淀的 pH 10.9 2.8 (6)结合流程中的数据计算。 ①菱铁矿中镁元素的质量分数为 24% (不考虑整个流程转化中的损失)。 ②MgCl2 通电制得的气体的质量(写出计算过程)。 【答案】(1)混合物 (2)SiO2 (3)MgCO3+2HCl=MgCl2+H2O+CO2↑ (4) O2 (5)8.9 (6)①24% ②设制得气体的质量为 x MgCl2 Mg+Cl2↑ 24 71 7.2t x x=21.3t 答:MgCl2 通电制得的气体的质量为 21.3t。 【解析】(1)菱镁矿中主要含 MgCO3、FeCO3 和 SiO2,所以菱镁矿属于混合物。 (2)菱镁矿中主要含 MgCO3 和 FeCO3 都能与盐酸反应,而 SiO2 与稀盐酸不反应, 所以流程中滤渣 a 主要成分是 SiO2。(3)菱镁矿中 MgCO3 与稀 HCl 反应生成氯化 镁、水和二氧化碳,化学方程式为:MgCO3+2HCl=MgCl2+H2O+CO2↑。(4)由质量 守恒定律可知,化学反应前后原子的种类与数目保持不变,则空格处应填写 O2。 (5)由表格中的数据可知,溶液 c 调 pH 使 Fe3+完全沉淀为 Fe(OH)3 从而与 Mg2+ 分离,则调 pH 的范围应为 2.8~8.9。(6)①菱铁矿中镁元素的质量分数为 。②根据镁的质量,结合化学方程式可求出氯气的质量。 27. (2020·山东临沂)工业上处理黄铜渣(Cu、Zn、ZnO、CuO 和杂质) 废料时,通常将其转化为硫酸锌和铜等有价产品。其主要流程如图所示(杂质不 溶于水也不参与反应): 资料: 2 4 2 4 22Cu 2H SO O 2CuSO 2H O 加热 ; 2 4 4 2ZnO H SO ZnSO H O ; 2 4 4 2CuO H SO CuSO H O (1)物质 B 的化学式是 。 (2)过程Ⅱ中分离操作的名称是 ,该操作用到的玻璃仪器 有烧杯、玻璃棒和 (填仪器名称)。 (3)过程Ⅲ中有气体产生,该反应的化学方程式是 。 27. (1)Zn (2)过滤 漏斗 (3)Zn+H2SO4=ZnSO4+ H2↑ 【解析】黄铜渣中的锌、氧化铜、氧化锌都会与稀硫酸反应,铜不会与稀硫 酸反应,所以步骤 I 后所得杂质中含有铜,所得溶液 A 中含有硫酸锌、硫酸铜和 过量的硫酸。根据题意可知,溶液 E 中的溶质为硫酸锌,步骤 II 中加入过量 B 的目的是将硫酸铜和硫酸转化为硫酸锌,所以过量的 B 为 Zn。过程Ⅱ后得到的 为固体和液体,则操作为过滤。过滤还需要的仪器是漏斗。固体 C 中含有过量的 锌和置换出的铜,可加入适量的稀硫酸除去锌,得到铜,化学方程式为: Zn+H2SO4=ZnSO4+ H2↑。 21.(2020·重庆 B)孔雀石的主要成分是 CuCO3·Cu(OH)2 及少量不溶性杂 质(杂质不与酸反应),某同学按下列实验步骤制取了少量氧化铜。 (1)白色沉淀的化学式为 。 (2)写出步骤③中发生反应的化学方程式 、 。 (3)蓝色沉淀受热分解生成另一种氧化物的化学式是 。 (4)若向溶液 A 中逐滴加入 NaOH 溶液,其过程中溶质种数会发生变化,最多 时可达 种。 【答案】⑴CaCO3 ⑵①2NaOH +H2SO4=Na2SO4 +2H2O ②CuSO4+2NaOH=Cu(OH)2 ↓+Na2SO4 ⑶H2O⑷3 【解析】孔雀石的主要成分是 CuCO3·Cu(OH)2,在化学反应中,我们可以看 成是 CuCO3 和 Cu(OH)2 的混合物(杂质不溶于水且不与酸反应,则为步骤①中所 得的滤渣),它们与硫酸反应的化学方程式为 CuCO3+H2SO4= CuSO4+H2O+CO2↑、 Cu(OH)2+H2SO4=CuSO4 +2H2O。⑴CO2 能与澄清石灰水反应:Ca(OH)2+CO2= CaCO3↓+H2O, 白色沉淀为 CaCO3。⑵滤液中是 CuSO4 和过量的 H2SO4,它们与氢氧化钠反应的化 学方程式为:2NaOH +H2SO4= Na2SO4 +2H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。⑶蓝 色沉淀 Cu(OH)2 含铜、氢、氧三种元素,氧化铜含铜、氧元素,则受热分解生成 另一种氧化物一定含氢元素,即为 H2O。⑷当加入的 NaOH 溶液很少时,溶液中 H2SO4 和 CuSO4 均有剩余,且反应生成了 Na2SO4,此时溶质有 3 种;加入的 NaOH 溶液刚好将 H2SO4 反应完全时,此时溶质有 Na2SO4 和 CuSO4 共 2 种(硫酸不反应完 全,沉淀无法长期存在);继续加入 NaOH 溶液直到 CuSO4 反应完全,此时溶质只 有 Na2SO4 共 1 种;继续加入 NaOH 溶液,此时溶质只有 NaOH 和 Na2SO4 共 2 种,故 最多有 3 种。 14.(2020·黑龙江大庆)以黄铁矿(主要成分是 FeS2)为原料,生产硫酸 的简要流程图如图: (1)将黄铁矿粉碎,目的是 增大反应物的接触面积,加快反应速度 。 (2)沸腾炉中发生反应的化学方程式是 4FeS2+11O2 2Fe2O3+8SO2 。 (3)若硫酸厂产生的废气未经处理就排放到空气中,可能形成酸兩,我们 把 pH< 5.6 的降雨称为酸雨。 (4)炉渣 Fe2O3 可回收冶炼成铁,生活中防止铁生锈的常见方法 表面刷漆、 涂油或镀上其他金属等 (答出一条即可)。 【答案】(1)增大反应物的接触面积,加快反应速度 (2) 4FeS2+11O2 2Fe2O3+8SO2 (3)5.6 (4)表面刷漆、涂油或镀上其他金 属等 【解析】(1)反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物 的接触面积,加快反应速度。(2)黄铁矿在沸腾炉里与氧气反应生成氧化铁和二 氧化硫,化学方程式为:4FeS2+11O2 2Fe2O3+8SO2。(3)某些工厂排放的酸 性气体未经处理直接排放到空气中,可能导致降雨的酸性增强,我们通常把 pH <5.6 的雨水称作酸雨。(4)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水 共同作用的结果;人们常采用在其表面刷漆、涂油或镀上其他金属等覆盖保护膜 的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水。查看更多