- 2021-11-10 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【精品课件】人教版九年级化学下册第八单元复习课件 金属和金属材料
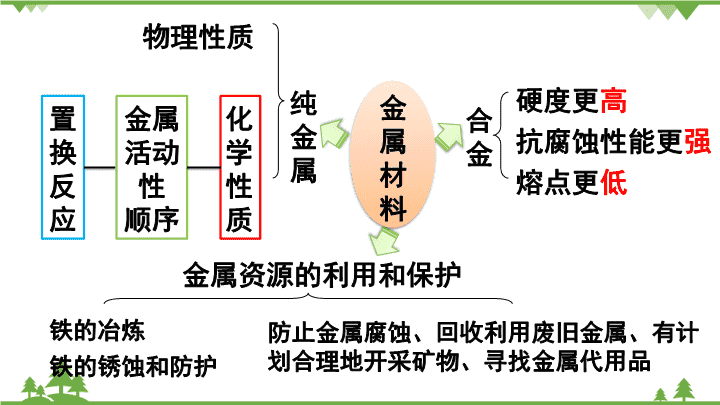
纯 金 属 物理性质 化 学 性 质 金属 活动 性 顺序 合 金 硬度更高 抗腐蚀性能更强 熔点更低 金属资源的利用和保护 铁的冶炼 防止金属腐蚀、回收利用废旧金属、有 计划合理地开采矿物、寻找金属代用品 金 属 材 料 置 换 反 应 铁的锈蚀和防护 考点一 金属材料及其用途 1.金属材料包括:__________和________。 2.合金 (1)定义:在金属中加热熔合某些金属或非金属形成的具有 ____________的物质。 (2)性能:合金的____________比组成它们的纯金属高, _____低,抗腐蚀性能________。 纯金属 合金 金属特征 强度和硬度 熔点 强 合金在物质分类中属于混合物,且至少含一种金属, 合金的用途比纯金属广泛。 注 意 (3)常见的两种铁的合金 ________:含碳量2%~4.3%的铁合金,硬度大、韧性小。 ________:含碳量0.03%~2%的铁合金,较硬,韧性佳。其 中__________中含有铬、镍,不易生锈,抗腐蚀性能好,常 用于制造医疗器械。 生铁 钢 不锈钢 金属的性质在很大程度上决定了金属的用途,但这不是唯一决 定的因素,还需考虑价格、资源、是否美观、使用是否便利, 以及废料是否易于回收和对环境的影响等多种因素。 3.金属的用途 共性 个性 常温下一般是固态 汞-液态 大多呈银白色金属光泽铜-紫红、金-黄、铁粉-黑 一般密度较大,熔点较高 一般具有良好的导电性、导热性、延展性 考点二 金属的物理性质 【练习1】(2018湖南湘西州中考)下列有关“金属之最”的 描述中,属于金属物理性质的是( ) A.钙是人体中含量最多的金属元素 B.铁是世界年产量最高的金属 C.铝是地壳中含量最多的金属 D.银是导电导热性最好的金属 【练习2】(2018辽宁本溪中考)关于金属及合金的说法错误 的是( ) A.合金中至少含有两种金属元素 B.生铁和钢是常见的铁合金 C.黄铜的硬度比纯铜的硬度大 D.焊锡的熔点比纯锡的熔点低 A D 1.金属活动性顺序 K Ca Na Fe Sn Pb (H) Pt Au Mg Al Zn Cu Hg Ag 金属活动性由强到弱 (1)在金属活动性顺序里,金属的位置越靠前,它的活动性 就越强,越容易与氧气发生反应; (2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、 稀硫酸中的氢; (3)在金属活动性顺序里,位于前面的金属能把位于后面的 金属从它们化合物的溶液里置换出来。 考点三 金属的化学性质 氢前可换氢 前金换后金 许多金属都能与氧气反应,但反应的难易和剧烈程度不同。 (1)镁、铝在常温下就能与氧气反应; (2)铁、铜在常温下几乎不与氧气反应,但在 点燃或加热时能与氧气反应; (3)金在高温下也不与氧气反应(真金不怕火炼)。 2.金属与氧气反应 4Al + 3O2 === 2Al2O3 2Cu + O2 === 2CuO △ 3Fe + 2O2 === Fe3O4 点燃 3.金属与盐酸、稀硫酸的反应(氢前可换氢) Mg + H2SO4 ===MgSO4 + H2↑ Zn + H2SO4 === ZnSO4 + H2↑ Fe + H2SO4 === FeSO4 + H2↑ Mg + 2HCl ====MgCl2 + H2↑ Zn + 2HCl === ZnCl2 + H2↑ Fe + 2HCl === FeCl2 + H2↑ 一种单质与一种化合物反应,生成另一 种单质与另一种化合物的反应。 置换反应: 表达式:A+BC==B+AC 特征:一换一 4.金属与其他金属化合物溶液的反应(前金换后金) Cu+2AgNO3===2Ag+Cu(NO3)2 2Al+3CuSO4===3Cu+Al2(SO4)3 (1)在初中阶段,金属活动性顺序的应用 不涉及K、Ca、Na (2)Fe在这两类置换反应中,都变成亚铁离子(Fe2+) Fe + CuSO4 === FeSO4 + Cu 注 意 【例1】(2018广东中考)利用盐酸和硝酸银探究铁、 铜、银的金属活动性顺序,下列实验可以不需要进 行的是( ) A.铁+稀盐酸 B.铜+稀盐酸 C.银+稀盐酸 D.铜+硝酸银溶液 解题思路:由金属活动性顺序的应用,验证试验的设 计思路为:根据三种金属与盐酸反应的情况,可验证 铁的活动性比铜、银强;然后利用铜和硝酸银的置换 结果,验证铜的活动性比银强。对比四个实验,不做 实验C也不影响三种金属活动性的判断。故选C C 【练习3】(2018新疆中考)如图是探究铁和铜金属 活动性的实验,关于此实验说法 错误的是( ) A.铁丝需要砂纸打磨 B.溶液由蓝色变为无色 C.金属活动性强弱:Fe>Cu D.化学反应方程式为Fe+CuSO4 =Cu+FeSO4 B 【例2】(2018湖北宜昌中考)取一定量的Mg放入Cu(NO3)2和 AgNO3 的混合溶液中,充分反应后过滤,得到固体和滤液。下列 说法错误的是( ) A.固体中只有Ag时,滤液一定呈蓝色 B.固体中有Cu和Ag时,滤液一定呈无色 C.固体中一定有Ag,滤液中可能有AgNO3 D.固体中可能有Cu,滤液中一定有Mg( NO3) 2 解题思路:镁比铜活泼,铜比银活泼,将一定量的镁粉加入AgNO3 和Cu(NO3)2的混合溶液中,镁先和AgNO3反应,后和Cu(NO3)2反应。 固体中一定有Ag,可能有Cu;滤液中一定有Mg(NO3)2,可能有 Cu(NO3)2或Cu(NO3)2、AgNO3。对于选项B,固体中有Cu和Ag时, 可能是镁置换了部分Cu(NO3)2,滤液可能呈蓝色,故B错误 B 【例3】某不纯的铁5.6g与足量的稀硫酸充分反应,生 成0.21g氢气,则铁中混有的金属可能是( ) A.Zn B.Cu C.Mg D.Ag 解题思路:本题主要考查对 “有关化学反应方程式计算” 等考 点的理解和运用。5.6g铁与足量稀硫酸充分反应生成氢气0.2g, 因此铁中混有的金属不可能是铜或银;5.6g锌、镁与足量稀硫 酸充分反应生成氢气分别是0.17g、0.47g。由此可知,不纯的 铁中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则 生成的氢气大于0.2g。 C 考点四 铁的冶炼 1.一氧化碳还原氧化铁 (1)实验装置(如图) (2)实验步骤 一氧化碳 酒精喷灯 早出 早退迟到 晚归 (3)实验现象:红棕色粉末逐渐变为______色,澄清石灰水变 ________,尾气燃烧产生_______火焰。 黑 浑浊 蓝色 Fe2O3 + 3CO ==== 2Fe + 3CO2 高温 防爆炸 防氧化 防倒吸 点燃或收集 【注意】①先通CO(早出) ②实验完毕后要先撤掉酒精喷灯, 继续通入CO(晚归) ③CO有毒,要进行尾气处理 (1)原料: 铁矿石 (2)原理: 在高温下,利用焦炭与氧气反应生成的一氧 化碳把铁从铁矿石中还原出来。 (3)主要设备:炼铁高炉 2.工业炼铁 石灰石焦炭 空气 Fe2O3 + 3CO ==== 2Fe + 3CO2 高温 焦炭: ①燃烧提供热量 ②产生一氧化碳 石灰石: 将铁矿石中的 SiO2转变为炉渣 C + O2=== CO2 C + CO2 === 2CO 点燃 高温 考点五 金属资源的保护 1.金属的锈蚀与保护 (1)铝在空气中耐腐蚀的原因: _________________________________________________ ______________________________。 (2)铁生锈的条件:铁与空气中的________和________反 应生成铁锈(主要成分是Fe2O3)。铁锈疏松易吸水,若不 及时除去,会加快铁制品的锈蚀速度。 铝在空气中与氧气反应,其表面会生成一层致密的氧化铝 薄膜,阻止内部的铝进一步氧化 氧气 水蒸气 问题:如何防止铁生锈呢? (3)防锈措施:①________________________,如菜刀用完后擦 干挂起来。 ②__________________________,如:刷漆、涂油、电镀等。 ③还可以通过添加其他金属或非金属制成合金,如不锈钢。 2.保护金属的有效途径 (1)______________________。 (2)______________________。 (3)有计划合理地开采矿物。 (4)寻找金属的代用品。 保持金属表面洁净、干燥 金属表面涂上一层保护膜 防止金属腐蚀 回收利用废旧金属 考点六 涉及杂质问题的计算 1.化学方程式所表示的物质间的质量关系是 __________间的关系。 2.当参加反应的物质或生成的物质含有杂质时,要 换算成纯物质的质量,再进行计算。 3.各物质间的关系 ______________=含杂质物质的质量×纯度(或含量) 纯净物 纯物质的质量 【练习4】(2018四川巴中中考)用“W”形管进行微 型实验,如下图所示。下列说法错误的是( ) A.a处红棕色粉末变为黑色 B.a处实验结束时先停止通入CO,后停止加热 C.b处澄清石灰水变浑浊证明有二氧化碳生成 D.可利用点燃的方法进行尾气处理 【练习5】(湖南株洲中考) 用1000 t含有氧化铁80%的赤铁 矿石,理论上可以炼出含铁 97%的生铁的质量约是______。 B 577.3t 易错点归纳 1.铁与盐酸、稀硫酸以及某些金属化合物溶液发生置换反应 时,生成的是亚铁离子(Fe2+),而不是铁离子(Fe3+)。 2.金属与其他金属化合物溶液发生反应: ①在金属活动性顺序里,排在前面的金属才能置换出排在后 面的金属;②金属化合物必须能溶于水;③金属不能是特别 活泼的钾、钙、钠;④描述实验现象时,既要描述金属颜色 的变化,还要描述溶液颜色的变化。 化学方程式网络构建 1.有关铁的反应 A的化学式__________ Fe2O3 请写出图中所涉及的化学方程式 ①__________________________ ②__________________________ __________________________ ③__________________________ ④____________________________ 2.有关锌、铜的反应 请写出图中所涉及的化学方程式 ①__________________________ ②__________________________ __________________________③ ④ ⑤ __________________________ __________________________ __________________,___________________ _________________________ ⑥ Zn + H2SO4 === ZnSO4 + H2↑ Zn + 2HCl === ZnCl2 + H2↑ Cu+2AgNO3===2Ag+Cu(NO3)2 Zn + CuSO4 ===ZnSO4 + Cu 2Cu + O2 === 2CuO △ CuO + H2 === Cu + H2O 2CuO + C === 2Cu + CO2 高温 △ CuO + CO === Cu + CO △查看更多