- 2021-11-10 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
九年级化学下册 课题1 生活中常见的盐 新版新人教版
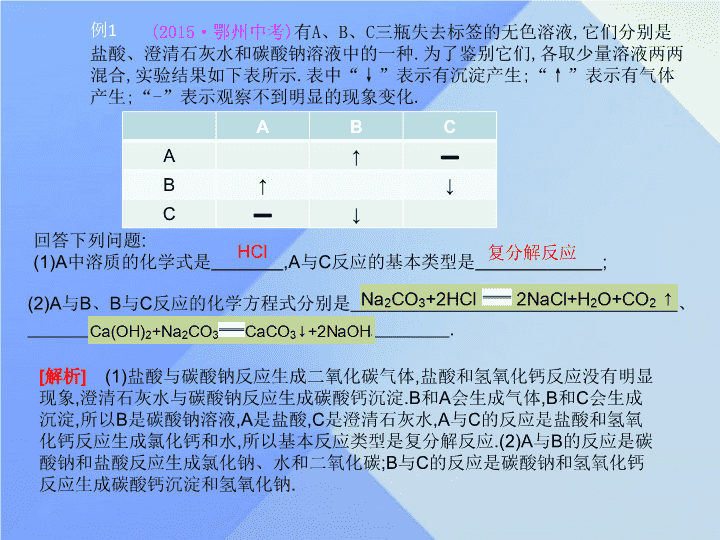
第十一单元 盐 化肥 课题 1 生活中常见的盐 常见盐的化学性质与鉴别 ( 规律方法 ) 1. 熟记碳酸钠的有关化学性质及现象 (1) 能与酸碱指示剂作用 : 能使酚酞溶液变红 . (2) 能与酸反应 : 生成能使澄清石灰水变浑浊的气体 . (3) 能与某些碱反应 : 如与氢氧化钙溶液反应生成白色沉淀 . (4) 能与某些盐反应 : 如与氯化钙 ( 或氯化钡 ) 溶液反应生成白色沉淀 . 2. 盐的鉴别 例 1 (2015· 鄂州中考 ) 有 A 、 B 、 C 三瓶失去标签的无色溶液 , 它们分别是盐酸、澄清石灰水和碳酸钠溶液中的一种 . 为了鉴别它们 , 各取少量溶液两两混合 , 实验结果如下表所示 . 表中“↓”表示有沉淀产生 ;“↑” 表示有气体产生 ;“-” 表示观察不到明显的现象变化 . 回答下列问题 : (1)A 中溶质的化学式是 ,A 与 C 反应的基本类型是 ; HCl 复分解反应 (2)A 与 B 、 B 与 C 反应的化学方程式分别是 、 . [ 解析 ] (1) 盐酸与碳酸钠反应生成二氧化碳气体 , 盐酸和氢氧化钙反应没有明显现象 , 澄清石灰水与碳酸钠反应生成碳酸钙沉淀 .B 和 A 会生成气体 ,B 和 C 会生成沉淀 , 所以 B 是碳酸钠溶液 ,A 是盐酸 ,C 是澄清石灰水 ,A 与 C 的反应是盐酸和氢氧化钙反应生成氯化钙和水 , 所以基本反应类型是复分解反应 .(2)A 与 B 的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳 ;B 与 C 的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠 . A B C A ↑ ▬ B ↑ ↓ C ▬ ↓ 1 . 有甲、乙、丙、丁四种无色溶液 , 它们分别是 HCl 、 H 2 SO 4 、 BaCl 2 、 Na 2 CO 3 溶液中的一种 . 为区别这四种溶液 , 现将它们两两混合并得到下面现象 : 根据对上述现象的分析 , 可推知甲、乙、丙、丁四种溶液的顺序依次是 ( ) A.HCl 、 BaCl 2 、 H 2 SO 4 、 Na 2 CO 3 B.H 2 SO 4 、 HCl 、 BaCl 2 、 Na 2 CO 3 C.HCl 、 H 2 SO 4 、 BaCl 2 、 Na 2 CO 3 D.H 2 SO 4 、 Na 2 CO 3 、 HCl 、 BaCl 2 提示 : 题中四种物质间 , 盐酸与硫酸、氯化钡混合无现象 , 盐酸与碳酸钠反应产生气体 , 硫酸与碳酸钠反应产生气体 , 氯化钡与硫酸、碳酸钠反应均出现沉淀 . C 1. 解答有关复分解反应能否发生的问题 , 需“三看” (1) 一看成分 : 一般有相同离子成分则反应不能发生 , 反之则可能发生 , 例如 HCl 与 NaCl 都含有 Cl - , 不能反应 . (2) 二看生成物 : 看生成物中是否有沉淀、气体或水 . 只要有其中的一种反 应就能发生 , 反之则不能 . 例如 Na 2 CO 3 +2HCl 2NaCl+H 2 O+CO 2 ↑ , Ca(OH) 2 +Na 2 CO 3 CaCO 3 ↓ +2NaOH. (3) 三看溶解性 : 盐与碱反应须均可溶 , 盐与酸反应 , 盐可不溶但酸必须溶 . 复分解反应发生的条件及其应用 ( 易错点 ) 复分解反应发生的条件及其应用 ( 易错点 ) ( 2015 · 内江中考 ) 下表是部分物质的溶解性表 ( 室温 ), 利用表中提供的信息回答下列问题 : ( 1 ) 酸、碱、盐之间发生的复分解反应 , 其实质是它们的溶液中离子之间相互结合生成沉淀或气体或水 , 否则反应就不能发生 , 则 BaCl 2 溶液和 NaNO 3 溶液混合后 , ( 填“能”或“不能” ) 发生复分解反应 . ( 2 ) 写出一个有 BaSO 4 生成的中和反应的化学方程式 : . 例 2 不能 〔解析〕 (1) 复分解反应是两种化合物相互交换成分 , 生成另外两种化合物的反应 , 像 BaCl 2 与 NaNO 3 两种盐交换成分后对应的是硝酸钡和氯化钠 , 而硝酸盐和钠盐均是可溶性盐 , 反应不能发生 .(2) 中和反应是指酸和碱反应生成盐和水的反应 , 生成物为硫酸钡和水 , 据此可逆推酸为硫酸 , 碱为氢氧化钡 . 2 .(2016 ·兰州中考 ) 下列物质之间的转化 , 经过一步反应不能实现的是 ( ) 提示 :A. 氯化铜与氢氧化钾溶液反应生成氢氧化铜沉淀和氯化钾 , 通过一 步反应能实现 , 故选项错误 ;B. 由 KNO 3 转化为 K 2 SO 4 , 假设能实现 , 生成的 是硝酸盐和钾盐 , 而硝酸盐和钾盐均是可溶性盐 , 不符合复分解反应的条 件 , 通过一步反应不能实现 , 故选项正确 ;C. 氢氧化铁与硫酸反应生成硫 酸铁和水 , 通过一步反应能实现 , 故选项错误 ;D. 氯化钡与碳酸钠溶液反 应生成碳酸钡沉淀和氯化钠 , 通过一步反应能实现 , 故选项错误 . B 混合物的分离与提纯 ( 拓展点 ) 物质分离和提纯的方法 : (1) 物理方法 ① 过滤法 , 适用于不溶于液体的固体与液体分离 . ② 结晶法 , 适用于分离可溶性混合物或除去可溶性杂质 , 有蒸发结晶和降温结晶 . (2) 化学方法 ① 吸收法 , 常用于除去气体中的杂质 , 选择适当的试剂与气体中 的杂质反应 . ② 置换法 , 用活泼的金属置换出不活泼的金属 . ③ 转化法 , 通过反应将杂质转化成被提纯的物质 , 或把杂质转化 成气体、沉淀等除去 . (2015 ·广州中考 ) 下列除去少量杂质的方法正确的是 ( ) A.Zn 粉中含少量的 ZnO: 加入足量稀 H 2 SO 4 充分反应后过滤 B.Cu(NO 3 ) 2 溶液中含少量 AgNO 3 : 加入足量的 Cu 屑充分反应后过滤 C.Na 2 SO 4 溶液中含少量 H 2 SO 4 : 加入足量的 Ba(OH) 2 充分反应后过滤 D.CaCO 3 固体中含少量 Na 2 CO 3 : 加入足量的稀 HCl 充分反应后过滤 例 3 B 3 .(2015 ·聊城中考 ) 除去下列物质中的少量杂质 , 所选用的试剂及操作方法均正确的是 ( ) 提示 : 碳酸钠与氢氧化钙溶液反应生成氢氧化钠 , 引入新杂质 ,A 错误 ; 由于氯化钠是杂质 , 含量较少 , 不能通过蒸发、过滤操作除去 ,B 错误 ; 氧气能与铜粉在加热的条件下生成氧化铜固体 ,C 正确 ; 杂质稀盐酸不与氯化钡反应 , 而稀硫酸能与氯化钡反应 ,D 错误 . C [ 实验探究题 ](2016 ·遂宁中考 ) 某化学兴趣小组的同学在实验室发现以前用的一瓶氢氧化钠溶液忘记了盖瓶塞 , 他们取这种氢氧化钠溶液少量于试管中 , 再逐滴加入稀盐酸 , 观察到有气泡产生 . 小组中有同学断定 , 这瓶氢氧化钠溶液已经变质 . 辅导老师肯定了该同学的看法 , 又有同学提出 : 所用氢氧化钠溶液是否完全变质 ? 兴趣小组的同学在辅导老师的鼓励下又进行了如下的实验探究 : 【提出问题】氢氧化钠溶液是否完全变质 ? 【进行猜想】 (1) 该氢氧化钠溶液部分变质 ;(2) 该氢氧化钠溶液全部变质 . 【查阅资料】氯化钡溶液呈中性 . 例 1 【设计并进行实验】 【结论】该小组同学所用氢氧化钠溶液是 ( 填“部分”或者“全部” ) 变质 . 【反思】氢氧化钠溶液露置于空气中容易变质 , 反应的化学方程式为 : . 白色沉淀 氢氧化钠 部分 [ 解析 ] 碳酸根离子和钡离子会生成碳酸钡沉淀 , 氢氧化钠能使酚酞试液变红色 , 所以取少量该瓶氢氧化钠溶液于试管中 , 向溶液中滴加过量的 BaCl 2 溶液 , 并不断振荡 , 有白色沉淀产生 , 说明原溶液中一定有碳酸钠 ; 取步骤 (1) 试管中的少量上层清液 , 向其中滴加酚酞试液 , 发现溶液变为红色 , 说明原溶液中一定有氢氧化钠 . 该小组同学所用氢氧化钠溶液是部分变质 ; 氢氧化钠变质是由于与空气中的二氧化碳反应生成了碳酸钠和水 . [ 解题归纳 ] 科学探究题以实际情景、后续学习内容、工农业生产、生活或社会热点问题等为背景 , 以重视基础、关注探究、联系实际、促进发展为原则命题 , 考查阅读理解能力、猜想能力、获取与处理信息能力、实验方案的设计与评价能力、对实验现象和数据的分析与对比能力及分类、概括等科学方法的运用能力等 . 对猜想、验证类探究题要仔细分析题目 , 可从不同的角度提出问题 , 并进行猜想和假设 . 提出的假设要严密、合理 , 有科学的理论依据 . 例 2 (2016 ·绥化中考 ) 有一包白色固体 , 可能含有碳酸钾、硫酸 钠、氯化钠、硝酸钡、氢氧化钾中的一种或几种 . 某化学兴趣小 组为探究其成分 , 进行如下实验 : (1) 取少量固体于烧杯中 , 逐渐加水并不断搅拌 , 待烧杯中的物质充 分反应后过滤 , 得到白色沉淀和滤液 . (2) 取少量滤液于试管中 , 滴加酚酞溶液 , 酚酞溶液不变色 . (3) 向白色沉淀中滴加过量稀硝酸并不断搅拌 , 沉淀部分溶解 . 请根据上述实验过程和发生的现象 , 回答问题 : 原白色固体中一定含有 , 一定不含有 , 可能含有 . 硫酸钠、碳酸钾、硝酸钡 氢氧化钾 氯化钠 〔解析〕 取少量固体于烧杯中 , 逐渐加水并不断搅拌 , 待烧杯中的物质充分反应后过滤 , 得到白色沉淀和滤液 , 混合物中一定含有硝酸钡 , 可能含有硫酸钠、碳酸钾中的一种或两种 ; 取少量滤液于试管中 , 滴加酚酞溶液 , 酚酞溶液不变色 , 混合物中一定不含氢氧化钾 ; 向白色沉淀中滴加过量稀硝酸并不断搅拌 , 沉淀部分溶解 , 混合物中一定含有碳酸钾、硫酸钠 , 所以原白色固体中一定含有硫酸钠、碳酸钾、硝酸钡 , 一定不含有氢氧化钾 , 可能含有氯化钠 . 【解题归纳】 物质的推断是根据物质的特征性质 , 利用已知实验现象或相互关系进行判断推理 , 确定物质的名称或成分 . 推断的一般方法有 :(1) 一点击破 , 顺逆推断 . 抓住“突破口” , 直接得出结论 , 然后用顺向或逆向或由两边向中间推断 , 逐一导出其他结论 ;(2) 相遇结合 , 对比推断 . 采用类似数学中的“相遇”方法用图中列出的各物质反应次数 , 再由各物质性质及反应规律列出各物质反应次数 , 然后对号入座推出各物质 ;(3) 提出假设 , 讨论推断 . 在分析题目所给条件的基础上 , 提出假设后进行反复验证 , 逐步缩小范围 , 排除不合题意的结论 . 例 3 ( 天原杯初中化学素质和实验能力竞赛 ) 若从 H 2 SO 4 、 Na 2 CO 3 、 Na 2 SO 4 、 NaCl 、 NaNO 3 、 Cu(NO 3 ) 2 、 HNO 3 七种溶液中取出其中的两种 , 进行混合及有关实验 , 所观察到的现象记录如下表 . 试根据各步实验和现象先进行分步推断 , 再推断所取的两种溶液的可能组合 . 〔解析〕 (1) 硫酸和硝酸能与碳酸钠反应生成二氧化碳气体 , 现在两种溶液混合后无明显现象 , 一定不是硫酸与碳酸钠或硝酸与碳酸钠混合 ;(2) 测定溶液的 pH=2, 说明溶液呈酸性 , 所以溶液中一定含有氢离子 ;(3) 能与硝酸钡反应生成白色沉淀 , 说明溶液中含有硫酸根离子 ;(4) 向所得滤液中加入硝酸银无明显现象 , 说明滤液中不含有氯化钠 . 根据实验现象可知混合物中一定不含有硫酸铜和氯化钠 , 一定含有酸和含有硫酸根的物质 , 所以可能的组合有 :①H 2 SO 4 、 NaNO 3 ;②H 2 SO 4 、 Na 2 SO 4 ;③H 2 SO 4 、 HNO 3 ;④HNO 3 、 Na 2 SO 4 .查看更多