- 2022-04-01 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2014年中考化学专题训练:图、表、线类试题(含2013试题,含详解)
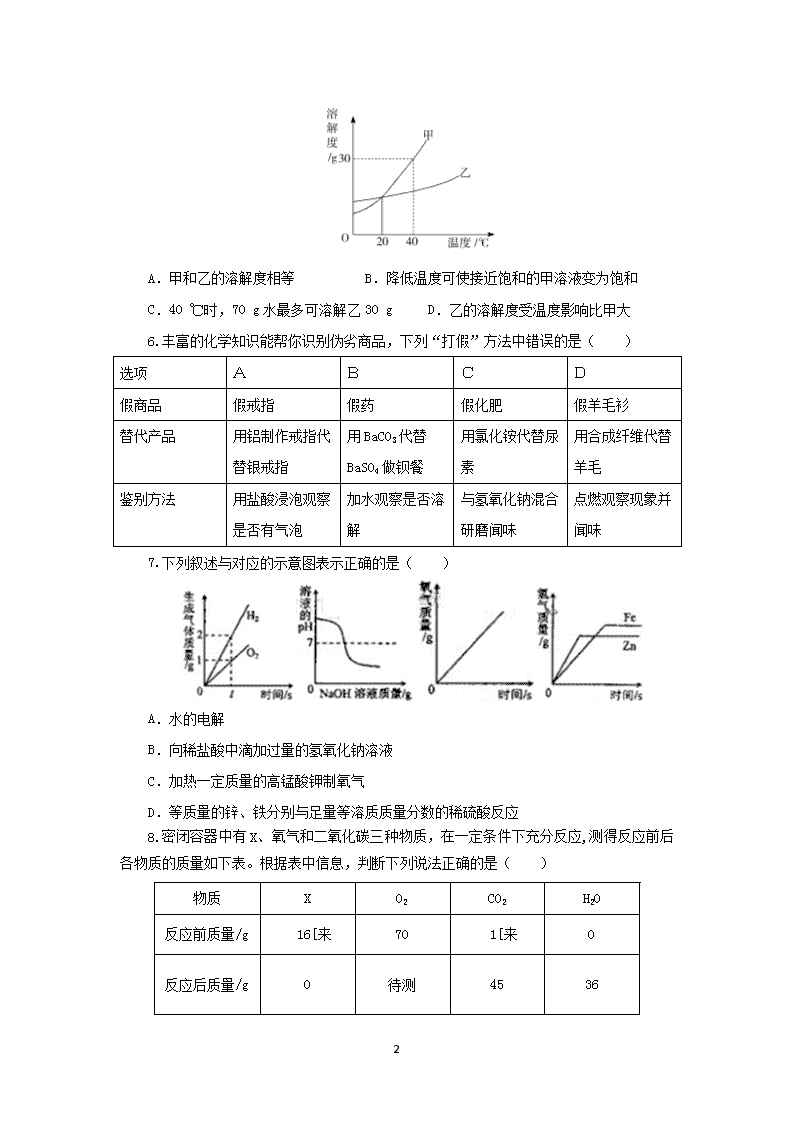
图、表、线类试题1.(2013天津一模)下列标志不正确的是( )A.当心爆炸B.回收标志C.节水标志D.禁止吸烟2.硼酸常用于治疗小儿湿疹。右图是硼元素在元素周期表中的相关信息。下列关于硼元素的说法中不正确的是A.元素符号为BB.是非金属元素C.原子核外有5个电子D.相对原子质量为10.81g3.下列数轴表示正确的是( )A.B.C.D.4.下列数轴表示正确的是5.下图是甲、乙两种物质的溶解度曲线图。下列说法正确的是()9 A.甲和乙的溶解度相等B.降低温度可使接近饱和的甲溶液变为饱和C.40℃时,70g水最多可溶解乙30gD.乙的溶解度受温度影响比甲大6.丰富的化学知识能帮你识别伪劣商品,下列“打假”方法中错误的是()选项ABCD假商品假戒指假药假化肥假羊毛衫替代产品用铝制作戒指代替银戒指用BaCO3代替BaSO4做钡餐用氯化铵代替尿素用合成纤维代替羊毛鉴别方法用盐酸浸泡观察是否有气泡加水观察是否溶解与氢氧化钠混合研磨闻味点燃观察现象并闻味7.下列叙述与对应的示意图表示正确的是( )A.水的电解B.向稀盐酸中滴加过量的氢氧化钠溶液C.加热一定质量的高锰酸钾制氧气D.等质量的锌、铁分别与足量等溶质质量分数的稀硫酸反应8.密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是( )物质XO2CO2H2O反应前质量/g16[来701[来0反应后质量/g0待测45369 A.该反应为置换反应B.X中一定含有碳、氢两种元素C.表中“待测”值为5D.反应生成的CO2和H2O的质量比为45:369.对于图示的理解错误的是()A.原子可以构成物质B.分子可以构成物质C.离子不能构成物质D.可用○+○→○○表示氧分子的形成过程10.如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )A.t℃时,甲乙两物质的溶解度相等B.甲物质的溶解度比乙的溶解度大C.升高温度可使甲物质的不饱和溶液变为饱和溶液D.t℃时,将乙物质的饱和溶液降温至20℃,溶液中溶质的质量分数增大11.某补钙商品说明书的部分信息如图所示.小明为了检验该产品是否合格,取10片补钙品放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:(1)质量减少了2.2g,是因为生成了 _________ 气体;(2)10片钙片中CaCO3的质量为 _________ g;(3)10片钙片中实际含钙量为 _________ g;(4)该补钙品含钙量 _________ (填“合格”或“不合格”).9 12.将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题.(1)写出锌与稀硫酸反应的化学方程式 .该反应的基本类型为 反应;对于该图象的理解,下列说法正确的是 (填序号).①A表示锌和稀硫酸的反应曲线②反应结束后两种金属一定都有剩余③反应结束后稀硫酸都没有剩余④反应结束后消耗两种金属的质量相等⑤反应结束后所得溶液质量相等.13.构建知识网络能帮助我们理解知识间的内在联系。下面分别是物质构成和盐酸化学性质的知识网络图,请你填写图中空白。14.20C时,将等质量的甲、乙两种固体物质,分别加人到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50C时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:(1)图1中一定为饱和溶液的是。(2)图2中甲、乙两溶液中溶质质量分数的大小关系为。(3)图3中表示乙的溶解度曲线是;P点表示的含义是。15.(1)下图所示a、b、c、d四个点,表示可燃物容易着火的点是9 点(填字母序号)。(2)请根据下列反应的微观示意图分析:参加反应的化合物A与化合物B的分子个数比为,生成物中单质分子与化合物分子的个数比为。(3)将一定质量的氯酸钾(不含催化剂)置于试管中加热一段时间,冷却后测得所得固体中氯元素的质量分数为35.5%,则反应中已分解的氯酸钾的质量分数为%。(4)请根据下列图示回答问题:①甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径:a.、b.;c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等(填“是”或“否”)。②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别向50gM、80gN固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是(填序号,多选、少选、错选均不给分)。a.只有N析出晶体;b.M、N两种溶液的溶质质量分数相等;c.只有M析出晶体:d.M、N均有晶体析出:e.M、N两种物质的溶解度相同。9 参考答案1.B解析:B图中所示标志是塑料制品回收标志。2.D解析:硼的相对原子质量是10.81,单位是1,不是克。3.B解析:根据地壳中含量前几种元素,应该是由左向右含量依次增加;白磷着火点最低,红磷次之,木炭最高,并且由左向右着火点依次增加;生铁含碳量为2%~4.3%,钢的含碳量为0.03%~2%;肥皂pH值大于7,食盐pH值等于7。4.C解析:氧气和二氧化碳的密度比空气大,氢气的密度比空气小;纯碱溶液呈碱性,pH大于7,食盐溶液呈中性,pH等于7,食醋呈酸性,pH小于7;根据化合价规则即可求得化合物中某元素的化合价,则氨气中氮元素的化合价为﹣3价,氮气为单质,单质中氮元素的化合价为0,二氧化氮中氮元素的化合价为+4,硝酸中氮元素的化合价为+5,排列正确,故C正确;CH4的相对分子质量为:12+1×4=16,CO的相对分子质量为:12+16=28,C2H2的相对分子质量为:12×2+1×2=26,CO2的相对分子质量为:12+16×2=44。5.B解析:此题是关于溶解度曲线的意义的考查,根据溶解度曲线可以看出,甲和乙的溶解度在20℃时相等,其余情况下不相等。甲、乙两种物质的溶液度都随着温度的升高而增大,所以降低温度可使接近饱和的甲变为饱和。40℃时,甲的溶解度为30g,既100g水中最多溶解30g甲物质。由曲线的走势可以看出甲的溶解度受温度的影响比甲大。6.B解析:由于碳酸钡和硫酸钡都难溶解于水,所以无法区别。7.D解析:电解水时生成的氢气和氧气的质量比是1:8,不是2:1,故A错误;盐酸的pH小于7,氢氧化钠溶液的pH大于7,向稀盐酸中滴加过量的氢氧化钠溶液,开始时溶液的pH应该是小于7,不是大于7,故B错误;加热一定质量的高锰酸钾制氧气,当高锰酸钾完全分解,生成氧气的质量不再改变,故C错误;等质量的锌和铁与足量的硫酸反应,锌反应的速率大,在坐标中斜线陡,铁的反应速率小,在坐标中的斜线缓,锌反应生成氢气的质量小于铁生成的氢气的质量,故D正确。9 8.B解析:由表可知,X为反应物,参加反应的物质质量为16g;CO2反应前为1g,反应后为45g,所以是生成物,生成的质量为44g;同理,H2O为生成物,生成的质量为36g;根据质量守恒定律,氧气应为反应物,反应的质量为64g,故待测值为6,C不正确;根据质量守恒定律,元素种类守恒,X中一定含有碳、氢两种元素,B正确;反应生成的CO2和H2O的质量比为44:36,D不正确。9.C解析:有些物质是由离子构成的.例如,氯化钠是由钠离子和氯离子构成的,故C错误。10.A解析:曲线中交点表示该温度时两种物质的溶解度相等,所以t℃时,甲乙两物质的溶解度相等,A正确;比较溶解度大小必须规定好温度,否则不能比较大小,B错;由于甲的溶解度随温度升高而增大,所以升高温度后甲物质的溶解度变大,溶液更不饱和了,C错;t℃时,将乙物质的饱和溶液降温至20℃,溶解度变大,变为不饱和,溶质质量分数不变,D错。11.(1)CO2(或二氧化碳);(2)5;(3)2;(4)合格解析:(1)补钙品中的碳酸钙与盐酸反应生成二氧化碳气体,二氧化碳的放出造成反应后剩余固体和液体的总质量比反应前减少了2.2g,故生成二氧化碳气体的质量为2.2g.(2)设10片钙片中CaCO3的质量为x,CaCO3+2HCl═CaCl2+H2O+CO2↑1007344x2.2gx=5g(3)10片钙片中实际含钙量为5g×100%=2g.(4)根据题意,100片钙片的质量为100g,故每片钙片的质量为1g,则10片钙片的质量为10g,该补钙品含钙量为100%=20%因为20%>18%,故该补钙品含钙量合格.12.(1)Zn+H2SO4═ZnSO4+H2↑;置换(2)①③⑤9 解析:(1)锌与硫酸反应生成硫酸锌和氢气,方程式是:Zn+H2SO4═ZnSO4+H2↑;该反应由一种单质和化合物反应生成另一种单质和化合物,符合置换反应的特点,属于置换反应;(2)①锌的活动性比铁的活动性强,所以等质量的金属,锌反应的时间短;②由图示可知:生成的氢气的质量相等,所以硫酸均反应完;Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,由方程式分析可知:如果锌恰好反应,则铁有剩余;③置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸均反应完;④根据化学方程式Fe+H2SO4═FeSO4+H2↑,可知每56g铁生成2g氢气,根据化学方程式Zn+H2SO4═ZnSO4+H2↑,可知每65g锌反应生成2g氢气;所以若是相等质量的铁和锌与硫酸反应,铁生成氢气多,而不会相等;⑤因为“等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”,所以反应物的总质量相等;依据质量守恒定律,反应后溶液的质量=反应前的总质量﹣气体的质量,图示中生成氢气的质量相等,故所得溶液质量相等。13.原子电子金属盐解析:构成物质的基本微粒有分子、原子、离子,所以空中填原子,原子分为原子核和核外电子;酸的化学性质有:与酸碱指示剂反应,与金属反应,与金属氧化物反应,与碱反应,与盐反应。14.(1)甲(2)相等或甲=乙(3)N30℃时,甲、乙两种固体物质的溶解度相等解析:甲中有未溶解固体存在,故甲一定是饱和溶液,升温后,两杯中均无晶体存在,水均为100g,所加甲、乙固体的质量相等,所以质量分数相等;20℃时,甲中有未溶解的固体,说明20℃时,甲的溶解度小于乙的溶解度,故表示乙溶解度曲线的是N,P点为两线的交点,表示30℃时,甲、乙两种固体的溶解度相等。15.(1)a、b、d(2)1:41:4(3)46.9%(4)①a.从40℃降温至20℃析出晶体,再过滤除去晶体,将滤液升高温度至60℃。b.恒温蒸发溶剂析出晶体,减少的溶剂质量为(S1-S2)/100g,过滤除去晶体,再将滤液升高温度至60℃。c.相等②ae解析:(1)根据燃烧的条件(燃烧需要同时满足三个条件:①可燃物②氧气或空气③达到燃烧所需的最低温度即着火点)解答本题.(2)根据图示为反应式配平.9 (3)根据氯酸钾和氯化钾中钾元素和氯元素的质量比都为39:35.5,反应后氯元素的质量分数为35.5%,钾元素的质量分数为39%,所以氧元素的质量分数为1-35.5%-39%=25.5%,设原来这一定质量的氯酸钾为100g,分解的质量为x,列方程计算即可.(4)①饱和溶液与不饱和溶液可通过改变温度、增减溶剂或溶质的方法实现互相转化,溶液状态的变化就使得曲线图中的点做相应地移动.②根据题意,加水150克,加热溶解,同时蒸发掉50克水,冷却至T℃,这一系列变化后,相当于在T℃时用150g-50g=100g水分别去溶解50克M和80克N固体,判断此时的溶解情况;因此可根据饱和溶液的溶质质量分数随温度变化的曲线,算出T℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,从而对所做的判断进行评价.9查看更多