- 2021-11-06 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
物质构成的奥秘(二)教案
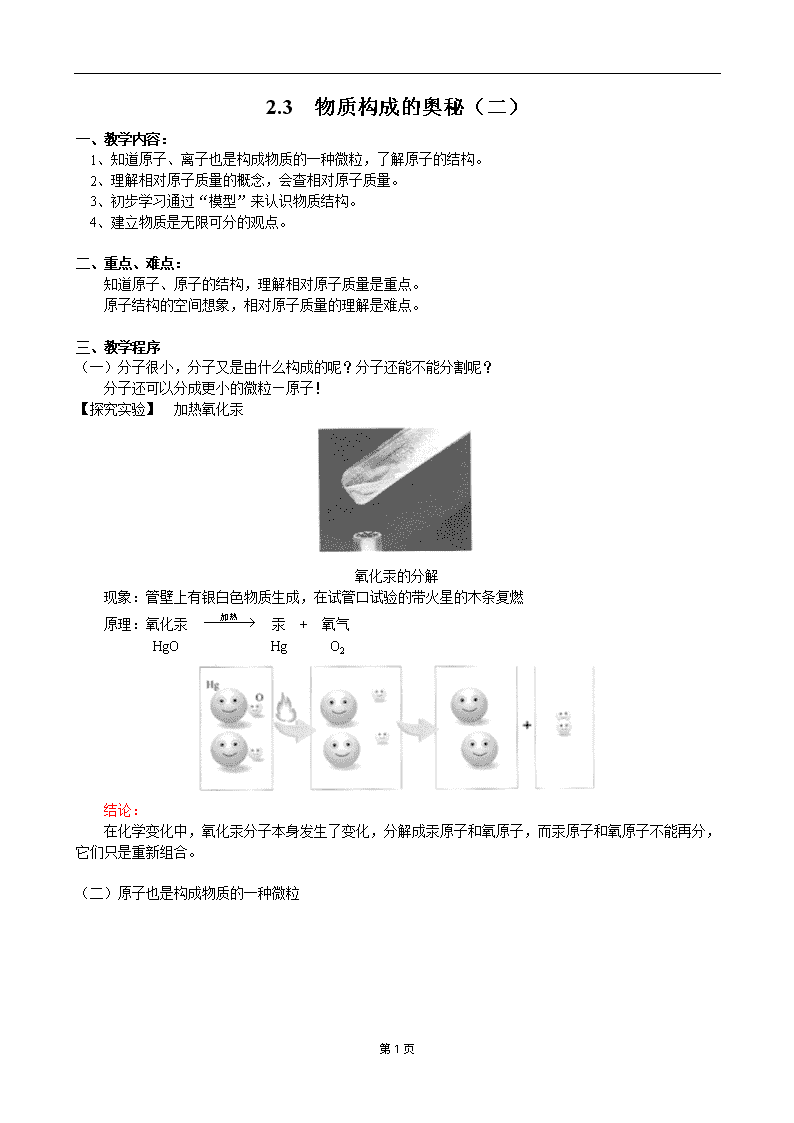
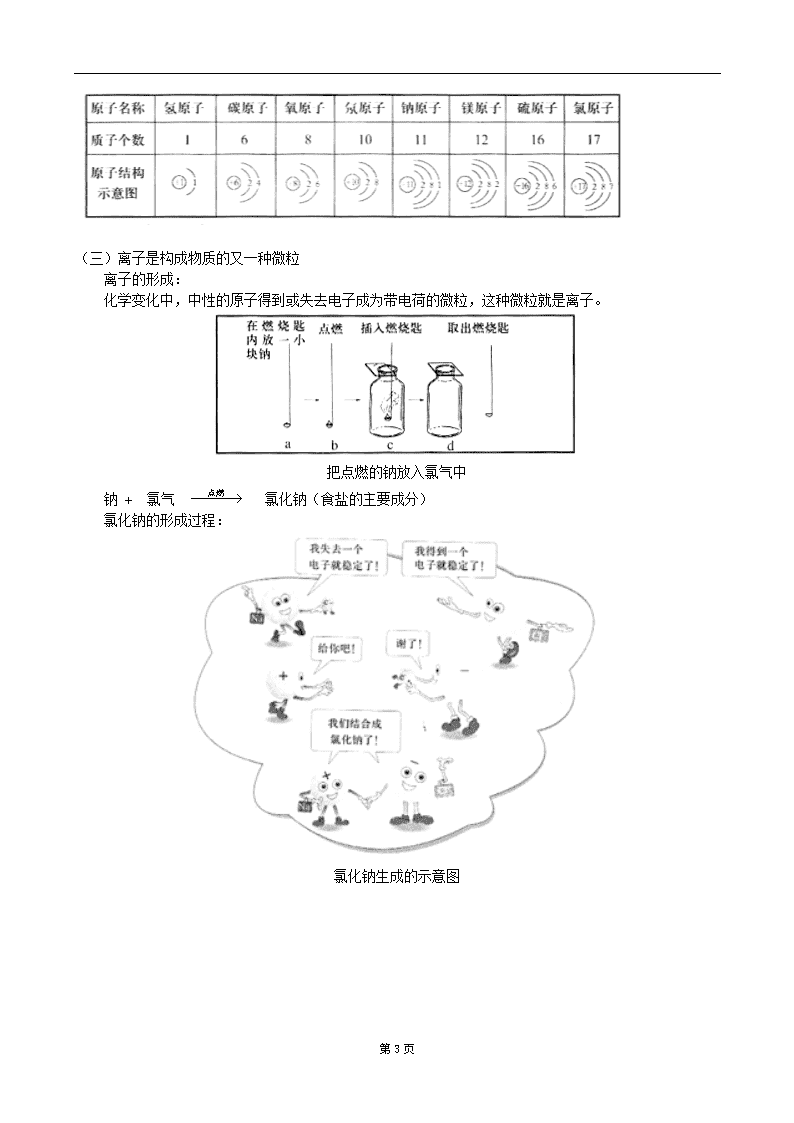
2.3 物质构成的奥秘(二) 一、教学内容: 1、知道原子、离子也是构成物质的一种微粒,了解原子的结构。 2、理解相对原子质量的概念,会查相对原子质量。 3、初步学习通过“模型”来认识物质结构。 4、建立物质是无限可分的观点。 二、重点、难点: 知道原子、原子的结构,理解相对原子质量是重点。 原子结构的空间想象,相对原子质量的理解是难点。 三、教学程序 (一)分子很小,分子又是由什么构成的呢?分子还能不能分割呢? 分子还可以分成更小的微粒—原子! 【探究实验】 加热氧化汞 氧化汞的分解 现象:管壁上有银白色物质生成,在试管口试验的带火星的木条复燃 原理:氧化汞 汞 + 氧气 HgO Hg O2 结论: 在化学变化中,氧化汞分子本身发生了变化,分解成汞原子和氧原子,而汞原子和氧原子不能再分,它们只是重新组合。 (二)原子也是构成物质的一种微粒 第5页 1、原子也是构成物质的一种微粒 金属、稀有气体(氦气He等)、金刚石、硅等是由原子构成的 2、原子的质量—相对原子质量 原子的质量很小,使用很不方便,如氢原子:1.674×kg 氧原子: 相对原子质量= 用以上方法,代入具体数据,就可算出各种原子的相对原子质量,如: H的相对原子质量=(近似值) O的相对原子质量==16 其它常见元素的相对原子质量的计算结果见课本P89表中(近似值) 注意:相对原子质量 = 质子数 + 中子数 3、原子的构成 4、原子内部的特点 原子的核内质子数=核外电子数=核电荷数=原子序数 5、原子结构示意图 第5页 (三)离子是构成物质的又一种微粒 离子的形成: 化学变化中,中性的原子得到或失去电子成为带电荷的微粒,这种微粒就是离子。 把点燃的钠放入氯气中 钠 + 氯气 氯化钠(食盐的主要成分) 氯化钠的形成过程: 氯化钠生成的示意图 第5页 氯化钠由离子构成 本课总结: 具体实例: 铜 水 食盐 二氧化碳 这些物质是怎样由微粒构成的呢? 铜原子会聚在一起形成铜 水分子中氢、氧原子的个数比为2:1 氯化钠中的钠离子、氯离子的个数比为1:1 二氧化碳分子中碳、氧原子的个数比是1:2 【典型例题】 例1、火车道上的钢轨,钢轨与钢轨之间留有一条“缝隙”,这是为什么? 解析:这是一道生活题,灵活运用所学知识,那就是物质的热胀冷缩现象。 答案:钢轨是由铁原子构成的物质。铁原子之间有间隔,这种间隔受热膨胀,遇冷缩小。夏季气温高,铁原子的间隔受热膨胀,铁轨变长,为防止钢轨变长后“凸起”变形而破坏铁路,所以安装铁轨时,铁轨之间一定要留有一定的“缝隙”。 例2、下列是对原子的叙述:①原子是最小的微粒;②原子核都是由质子和中子构成的;③原子不显电性;④原子都在不停地运动着,正确的是( )。 A、① B、③ C、② D、③和④ 解析:此题是考查我们对原子和原子结构的知识是否真正理解。① 第5页 说法中原子并不是最小的微粒,质子、中子、电子比原子还要小得多。由于原子核和核外电子所带电量相等,但电性相反,故整个原子不显电性。因此③正确。原子核内一定含有质子,但不是任何原子都含有中子。如有一种氢原子的核内只有一个质子,而不含中子。原子和分子一样,不是静止不动的。 答案:D 【模拟试题】(答题时间:10分钟) 一、原子及其基本性质 1、下列物质由原子构成的是( ) A、纯净物 B、混合物 C、蒸馏水 D、铁丝 2、关于原子的说法正确的是( ) A、原子不显电性,说明原子内的质子数等于中子数 B、同种原子内的质子数相同 C、含有相同中子数的原子,一定是同一类的原子 D、原子是最小的粒子 二、原子结构 3、下列关于原子核的说法正确的是( ) A、任何原子核都由质子和中子构成 B、原子的核电荷数一定等于核内质子数 C、原子的质量主要集中在原子核上 D、原子核的体积占整个原子的大部分 4、据中央电视台6月30日对云南抚仙湖底古城考古的现场报道,科学家曾通过测定古生物遗骸中的碳—14含量来推断古城年代,碳--14原子核电荷数为6,相对原子质量为14,下列关于碳—14原子的说法中,错误的是( ) A、中子数为6 B、质子数为6 C、电子数为6 D、质子数和中子数之和为14 【试题答案】 1、D 2、B 3、B C 4、A 第5页查看更多