- 2021-08-24 发布 |
- 37.5 KB |
- 47页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习专题二物质的量课件(47张PPT)
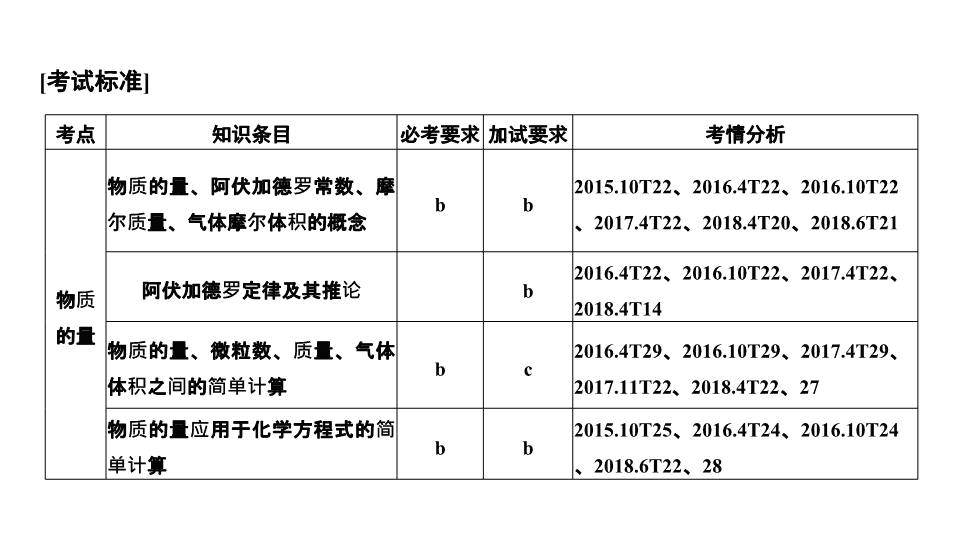
专题二 物质的量 第 1 课时 物质的量 [ 考试标准 ] 考点 知识条目 必考要求 加试要求 考情分析 物质的量 物质的量、阿伏加德罗常数、摩尔质量、气体摩尔体积的概念 b b 2015.10T22 、 2016.4T22 、 2016.10T22 、 2017.4T22 、 2018.4T20 、 2018.6T21 阿伏加德罗定律及其推论 b 2016.4T22 、 2016.10T22 、 2017.4T22 、 2018.4T14 物质的量、微粒数、质量、气体体积之间的简单计算 b c 2016.4T29 、 2016.10T29 、 2017.4T29 、 2017.11T22 、 2018.4T22 、 27 物质的量应用于化学方程式的简单计算 b b 2015.10T25 、 2016.4T24 、 2016.10T24 、 2018.6T22 、 28 考点一:阿伏加德罗常数判断 1. ( 2018· 浙江嘉兴一中) 设 N A 代表阿伏加德罗常数的值,下列叙述正确的是( ) A.1 mol C 3 H 8 O 分子中 O—H 键数目一定为 N A B.500 ℃ 时, 32 g SO 2 和 32 g O 2 在密闭容器中充分反应生成 SO 3 的分子数为 0.5 N A C.H 2 O 2 + Cl 2 ===2HCl + O 2 反应中,每生成 32 g O 2 ,转移电子数为 2 N A D. 将 10 mL 0.1 mol/L FeCl 3 溶液制成的 Fe ( OH ) 3 胶体,胶体粒子数目为 0.001 N A 解析 A.C 3 H 8 O 可能为醚,如果是醚,分子中没有 O—H 键,故 A 错误; B. 二氧化硫和氧气的反应为可逆反应,不能进行彻底,生成 SO 3 分子数小于 0.5 N A ,故 B 错误; C. 在 H 2 O 2 + Cl 2 ===2HCl + O 2 反应中, 32 g 氧气的物质的量为 1 mol ,生成 1 mol 氧气转移了 2 mol 电子,则转移 2 N A 个电子,故 C 正确; D. 氢氧化铁胶体是氢氧化铁的集合体, 10 mL 0.1 mol/L FeCl 3 溶液完全水解得 Fe ( OH ) 3 胶体粒子数目小于 0.001 N A ,故 D 错误;故选 C 。 答案 C 考点二:转移电子数计算 2. 判断下列说法是否正确(设 N A 为阿伏加德罗常数的值)。 ( 5 ) 1 mol Na 2 O 2 与足量 CO 2 充分反应转移的电子数为 2 N A ( ) ( 6 )标准状况下 22.4 L Cl 2 溶于水充分反应转移电子数为 N A ( ) ( 7 ) 50 mL 18.4 mol/L 浓 H 2 SO 4 与足量铜微热反应,转移电子数目为 0.92 N A ( ) ( 8 )某密闭容器盛有 0.1 mol N 2 和 0.3 mol H 2 ,在一定条件下充分反应,转移的电子数目为 0.6 N A ( ) 答案 ( 1 ) √ ( 2 ) × ( 3 ) × ( 4 ) √ ( 5 ) × ( 6 ) × ( 7 ) × ( 8 ) × 考点三:阿伏加德罗定律及推论(加试) 3. ( 2016· 温州市 3 月选考模拟) 三种气体 X 、 Y 、 Z 的相对分子质量关系为 M r ( X )< M r ( Y )= 0.5 M r ( Z ),下列说法正确的是( ) A. 三种气体密度最小的是 X B. 分子数目相等的三种气体,质量最大的是 Y C. 若一定条件下,三种气体体积均为 2.24 L ,则它们的物质的量一定均为 0.1 mol D.20 ℃ 时,若 2 mol Y 与 1 mol Z 体积相等,则 Y 、 Z 气体所承受的压强比为 2 ∶ 1 解析 根据题意三种气体 X 、 Y 、 Z 的相对分子质量关系为 M r ( X )< M r ( Y )= 0.5 M r ( Z ),即 M r ( X )< M r ( Y )< M r ( Z ), A 项,相同条件下,密度和相对分子质量成正比,由于温度压强不定,则密度无法判断, A 错误; B 项,分子数目相等的三种气体,质量最大的是相对分子质量最大的 Z , B 错误; C 项, V m 和外界条件有关, V m 不一定等于 22.4 L/mol ,所以它们的物质的量不一定均为 0.1 mol , C 错误; D 项,根据同温同体积的气体物质的量之比等于压强之比, D 正确。 答案 D 考点四:以物质的量为中心的化学计算 4. ( 2018· 浙江绍兴适应性测试) 将 19.20 g Cu 和 Fe 2 O 3 的混合物完全溶解在 400 mL 稀硫酸中, 然后向溶液中加铁粉, 剩余固体质量与加入铁粉质量的关系如图。 ( 1 )混合物中 n ( Cu ) ∶ n ( Fe 2 O 3 )为 。 ( 2 )稀硫酸的浓度为 。 解析 根据 Cu 和 Fe 2 O 3 的混合物完全溶解在 400 mL 稀硫酸中,发生的反应 Fe 2 O 3 与 H + 生成 Fe 3 + , Fe 3 + 再与 Cu 反应,然后加入铁粉,先和 Fe 3 + 反应,再和 Cu 2 + 反应。所以由图像知混合物中铜的质量 3.2 g ,物质的量为 0.05 mol ; Fe 2 O 3 的质量为 19.20 - 3.2 = 16.00 g ,物质的量为 0.1 mol ,所以混合物中 n ( Cu ) ∶ n ( Fe 2 O 3 )为 1 ∶ 2 。 ( 2 )最后溶液为硫酸亚铁溶液 FeSO 4 ,加入的 n ( Fe )= 0.2 mol , Fe 2 O 3 的物质的量为 0.1 mol ,铁为 0.2 mol ,所以总的铁为 n ( Fe )= 0.4 mol , n ( FeSO 4 )= 0.4 mol , 稀硫酸的浓度为 1.00 mol·L - 1 。 答案 ( 1 ) 1 ∶ 2 ( 2 ) 1.00 mol·L - 1 5. ( 2017· 台州高一联考) 向两份 30 mL 同一浓度的 NaOH 溶液中通入 CO 2 气体,因 CO 2 通入量的不同,溶液的组成也不同,得到溶液 M 、 N 。若向 M 、 N 溶液中逐滴加入浓度为 0.25 mol·L - 1 的盐酸,产生的气体体积 V ( CO 2 )与加入盐酸的体积 V ( HCl )的关系分别为如图所示两种情况 A 和 B 。 请回答下列问题: ( 1 ) NaOH 溶液的物质的量浓度为 。 ( 2 ) M 、 N 两溶液中相同组分溶质的物质的量之比为 。 答案 ( 1 ) 0.25 mol/L ( 2 ) 3 ∶ 5 易错点一 物质的量、气体摩尔体积等概念的易错点 1. 使用 mol 作单位时,易忽略指出微粒的名称或写出化学式。例如: “ 1 mol H 2 ” 、 “ 1 mol H + ” 不能写成 “ 1 mol 氢 ” 。 2. 看到 22.4 L 即误认为是 1 mol ,忽略 “ 22.4 L/mol ” 的使用条件和物质状态要求。例如:标准状况指的是 0 ℃ 、 1.01 × 10 5 Pa ,题目中常以常温常压( 25 ℃ 、 1.01 × 10 5 Pa )、标准状况下为非气态物质(如 SO 3 、苯等)设置陷阱。 3. ( 1 )在运用物质的量、阿伏加德罗常数、摩尔质量进行相关计算时,要注意区别它们的单位,依次为 mol 、 mol - 1 、 g·mol - 1 ,在书写时,一定要带着单位,否则就会出错。 ( 2 )摩尔质量只有当以 g·mol - 1 为单位时,在数值上才会与相对分子质量或相对原子质量相等。 [ 易错训练 1] ( 2018· 浙江绍兴适应性测试) N A 表示阿伏加德罗常数的值。下列说法正确的是( ) A.1 L 1.0 mol/L 盐酸与 0.1 mol MnO 2 共热后,生成 Cl 2 分子的数目为 0.1 N A B.0.1 mol/L K 2 SO 4 溶液中含有 K + 数目为 0.2 N A C. 标准状况下 22.4 L CO 、 CO 2 混合气体所含碳原子数约为 N A D. 常温常压下,铁与盐酸反应生成 22.4 L H 2 时转移的电子数为 2 N A 解析 A.1.0 mol/L 盐酸为稀盐酸,不与 MnO 2 反应, A 错误; B. 不知道 K 2 SO 4 溶液的体积,无法计算 K 2 SO 4 的物质的量, B 错误; C. 标准状况下, 22.4 L CO 、 CO 2 混合气体为 1 mol ,所含碳原子数约为 N A , C 正确; D. 常温常压下, 22.4 L H 2 的物质的量不是 1 mol ,故转移的电子数不是 2 N A , D 错误。 答案 C [ 易错训练 2] ( 2017· 温州十校模拟) 用 N A 表示阿伏加德罗常数的值,下列叙述中正确的是( ) 答案 C 第 2 课时 物质的量浓度 [ 考试标准 ] 考点 知识条目 必考要求 加试要求 考情分析 物质的量浓度、相关计算及溶液配制 物质的量浓度的概念 b b 2015.10T29 、 2016.4T29 、 2016.4T22 、 2018.4 、 6T18 配制一定物质的量浓度的溶液 b b 2016.10T28 、 2017.11T32 物质的量浓度的相关计算 c c 2016.4T29 、 2016.10T28 、 2017.4T29 、 2018.6T30 考点一:考查物质的量、溶质的质量分数、物质的量浓度之间的换算 1. ( 2018· 温州十五校联合体) 下列关于溶液物质的量浓度的说法正确的是( ) A. 常温下, 1 L 水中溶解 58.5 g NaCl ,该溶液的物质的量浓度为 1 mol·L - 1 B. 标准状况下,将 22.4 L HCl 溶于 1 L 水,可配成 1 mol·L - 1 的稀盐酸 C. 将 4.0 g NaOH 倒入 100 mL 容量瓶中,加水至刻度线,即可配成 1 mol·L - 1 的 NaOH 溶液 D.10 g 98% 的硫酸(密度为 1.84 g·cm - 3 )与 10 mL 18.4 mol·L - 1 的硫酸的浓度相同 答案 D 考点二:溶液的稀释和混合 2. ( 2018· 嘉兴一中) 质量分数为 a % ,物质的量浓度为 c mol·L - 1 的 NaCl 溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为 2 c mol·L - 1 ,则质量分数变为(蒸发过程中没有晶体析出,且 NaCl 溶液的密度大于 1 g/mL )( ) A. 小于 2 a % B. 大于 2 a % C. 等于 2 a % D. 无法确定 答案 A 考点三:一定物质的量浓度溶液的配制 3. ( 2018· 桐乡一中高一模拟) 云南鲁甸发生 6.5 级地震,造成大量人员伤亡和财产损失。灾区的水需用杀菌消毒剂处理后才能确保饮水安全。救灾物资中的一瓶 “ 84 消毒液 ” 的包装说明上有如下信息: 含 25%NaClO (次氯酸钠)、 1 000 mL 、密度 1.19 g/cm 3 ,稀释 100 倍(体积比)后使用。 请回答下列问题: ( 1 )上述 “ 84 消毒液 ” 的物质的量浓度为 mol/L 。 ( 2 )该同学取 100 mL 上述 “ 84 消毒液 ” ,稀释后用于消毒,稀释 100 倍后的溶液中 c ( Na + )= mol/L (假设稀释后溶液密度为 1.0 g/cm 3 ),该消毒液长时间放置在空气中能吸收标准状况下 CO 2 的体积为 L 。 ( 3 )灾区志愿者根据上述 “ 84 消毒液 ” 的包装说明,欲用 NaClO 固体( NaClO 易吸收空气中的 H 2 O 、 CO 2 )配制 480 mL 含 25%NaClO 的消毒液。下列说法正确的是 。 A. 如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 B. 容量瓶用蒸馏水洗净后,要烘干才能用于溶液的配制 C. 利用购买的商品 NaClO 来配制可能会导致结果偏低 D. 需要 NaClO 固体的质量为 143 g ( 4 ) ClO 2 对污水中 Fe 2 + 、 Mn 2 + 、 S 2 - 和 CN - 等有明显的去除效果。某工厂污水中含 CN - b mg/L ,现用 ClO 2 将 CN - 氧化,只生成两种无毒气体,其离子反应方程式为 ___________________________________________________________ ___________________________________________________________ , 处理 100 m 3 这种污水,至少需要 ClO 2 mol 。 考点四:考查溶液配制过程中的误差分析 4. ( 2018· 湖州三县联考) 实验室用密度为 1.25 g·mL - 1 ,质量分数为 36.5% 的浓盐酸配制 480 mL 0.2 mol·L - 1 的盐酸,请回答下列问题: ( 1 )浓盐酸的物质的量浓度为 。 ( 2 )配制 480 mL 0.2 mol·L - 1 的盐酸应量取浓盐酸体积 mL 。 ( 3 )配制该溶液时除了使用烧杯、玻璃棒、量筒,还需要的玻璃仪器为 。 ( 4 )下列操作会使配得的溶液浓度偏高的是 。 A. 容量瓶中有少量蒸馏水 B. 溶液从烧杯转移到容量瓶后没有洗涤烧杯 C. 未冷却即将溶液转移至容量瓶 D. 定容时俯视容量瓶刻度线 答案 ( 1 ) 12.5 mol/L ( 2 ) 8.0 ( 3 ) 500 mL 容量瓶、胶头滴管 ( 4 ) CD 考点五:物质的量浓度在化学方程式计算中的应用 5. ( 2017· 金华市武义一中高二上期中) 室温时,向 20 mL HCl 和 H 2 SO 4 的混合溶液中逐滴加入 0.05 mol·L - 1 Ba ( OH ) 2 溶液,生成的 BaSO 4 的质量和溶液 pH 的变化情况如图所示(不考虑溶液混合时体积的变化)。下列说法中正确的是( ) 答案 B 易错点一 物质的量浓度概念理解误区 物质的量浓度计算三大误区 ( 1 )溶质组成要正确分析 ① 与水反应的物质。如 SO 3 溶于水后变为 H 2 SO 4 且水量减少。 ② 含结晶水的物质,如 CuSO 4 ·5H 2 O 溶于水,水的量会增加。 ③ 溶质发生变化,如弱酸、弱碱和可水解的盐,溶质的离子组成会发生变化。 ( 2 )体积变化要盯死看牢 ① 不能用水的体积代替溶液的体积,尤其是固体、气体溶于水。 ② 溶液混合体积会发生变化。 [ 易错训练 1] ( 2018· 广东学业水平测试) 将 c mol/L 的 AlCl 3 溶液 V 1 mL 加水稀释至 V 2 mL ,稀释后溶液中 Cl - 物质的量浓度为( ) 答案 D 易错点二 溶液配制的 3 个注意点 1. 容量瓶的使用 ( 1 )不能用容量瓶直接溶解固体溶质,也不能用于稀释溶液。 ( 2 )容量瓶不能用作反应容器,也不能用于长期贮存溶液。 ( 3 )容量瓶的规格是固定的,不能配制任意体积的溶液,所配溶液的体积一定要与容量瓶的容积相等。 2. 溶液配制的操作 ( 1 )用玻璃棒引流时,玻璃棒末端应插入到刻度线以下,且玻璃棒靠近容量瓶口处不能接触瓶口。 ( 2 )在使用容量瓶的过程中,如需要移动容量瓶,手应握在瓶颈刻度线以上,以免瓶内液体因受热而发生体积变化,导致溶液浓度不准确。 ( 3 )定容摇匀后,液面低于刻度线,不能再滴加蒸馏水。 3. 误差分析 ( 1 )导致 c B 偏低的错误操作:垫纸片称量 NaOH 固体;左码右物(用游码);称量时间过长(潮解);洗涤或转移时溶液溅出;未洗涤烧杯及玻璃棒;超过刻度时用滴管吸出液体;定容时仰视;定容后发现液面低于刻度线再加水。 ( 2 )导致 c B 偏高的错误操作:砝码生锈;定容时俯视;未等溶液冷却至室温就定容。 请回答下列问题: ( 1 )该植物培养液中, NH 的物质的量浓度为 。 ( 2 )该研究小组配制该植物培养液时,还须用到的实验仪器是 (填字母)。 A.450 mL 容量瓶 B.500 mL 容量瓶 C. 两个 250 mL 容量瓶 ( 3 )甲同学用 KCl 和( NH 4 ) 2 SO 4 两种物质进行配制,则需称取 m ( KCl )= g , m [ ( NH 4 ) 2 SO 4 ] = g 。 ( 4 )乙同学用所提供药品中的三种进行配制,请帮助该同学选用三种物质: 、 、 。(填化学式) ( 5 )若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是 (填字母)。 A. 将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 B. 将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶 C. 用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线 D. 用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线 ( 5 )未洗涤烧杯和玻璃棒,会有部分溶质残留在烧杯和玻璃棒上,使所配溶液浓度偏低, A 项符合题意;转移时部分溶液溅出容量瓶,使溶质损失,所配溶液浓度偏低, B 项符合题意;加水时溶液凹液面高于容量瓶刻度线,说明所配溶液体积偏大、浓度偏小, C 项符合题意;俯视读数时,实际液面低于容量瓶刻度线,所配溶液体积偏小、浓度偏大, D 项不符合题意。 答案 ( 1 ) 0.8 mol·L - 1 ( 2 ) B ( 3 ) 14.9 26.4 ( 4 )( NH 4 ) 2 SO 4 NH 4 Cl K 2 SO 4 ( 5 ) ABC查看更多