- 2021-08-24 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山西省康杰中学高二下学期期中考试化学试题 Word版
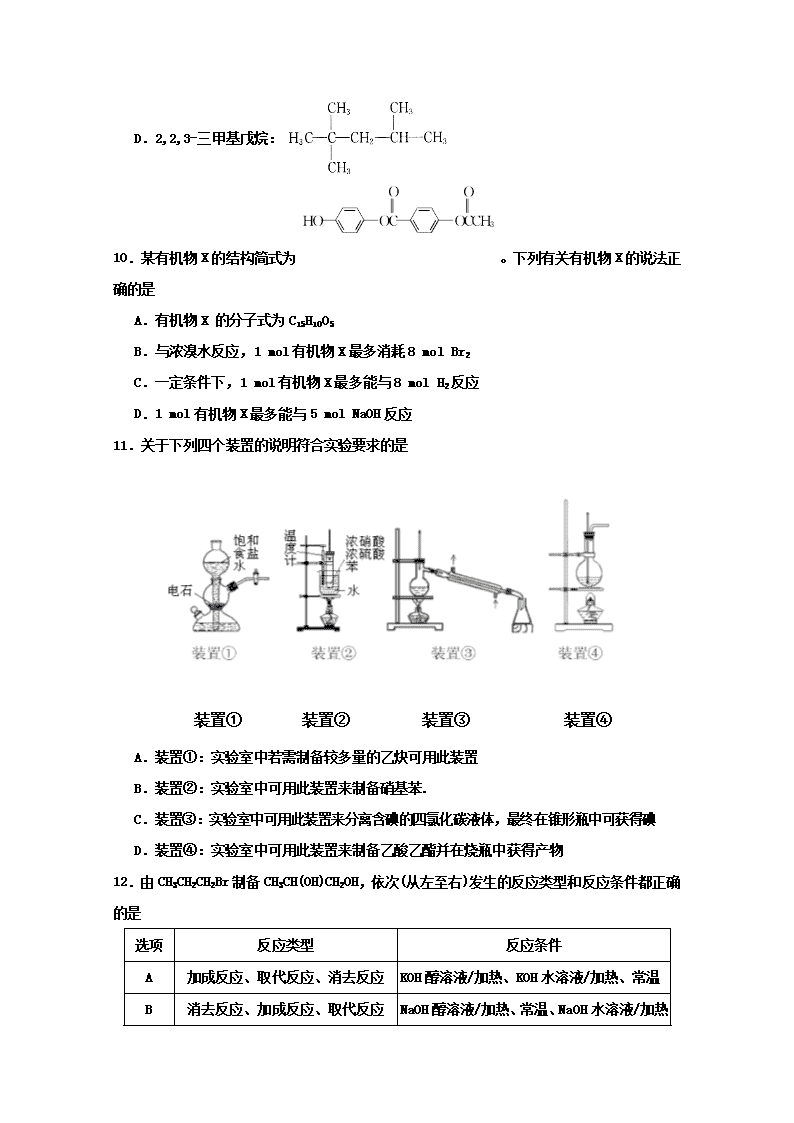
康杰中学2017—2018学年度第二学期期中考试 高二化学试题 2018.4 有关相对原子质量:H=1 O=16 C=12 第I卷(选择题) 一、单选题:共20题 每题3分 共60分 1.下列措施合理的是 A.用福尔马林浸泡海鲜产品 B.用带橡皮塞的玻璃试剂瓶盛装氢氟酸 C.用核磁共振氢谱不能鉴别间二甲苯与对二甲苯 D.饱和碳酸钠溶液和乙酸乙酯可用分液漏斗分离 2.下列各组有机物只用一种试剂无法鉴别的是 A.乙醇、苯、四氯化碳 B.苯、甲苯、环己烷 C.苯、苯酚、己烯 D.苯、乙醛、乙酸 3.NA为阿伏加德罗常数,下列说法正确的是 A.标准状况下,11.2 L的戊烷所含的分子数为0.5 NA B.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA C.1 mol甲基的电子数目为7 NA D.28 g乙烯所含共用电子对数目为4 NA 4.下列关系正确的是 A.沸点:己烷>2-甲基丁烷>戊烷>丁烷 B.2,2,3,3-四甲基丁烷、新戊烷、乙烷中化学环境相同的H原子种类由多到少 C.密度:溴苯 >H2O >苯 D.等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH 5.下表中实验操作能达到实验目的的是 实验操作 实验目的 A 向苯酚的饱和溶液中滴加稀溴水 验证三溴苯酚为白色沉淀 B 向甲酸钠溶液中加新制的Cu(OH)2悬浊液并加热 确定甲酸钠中含有醛基 C 向酒精和乙酸的混合液中加入金属钠 确定酒精中混有醋酸 D 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 检验水解产物中的溴离子 6.某有机物的结构简式为 。下列关于该有机物分子结构的说法中正确的是 A.最多有18个原子在同一平面内 B.最多有4个碳原子在一条直线上 C.最多有12个碳原子在同一平面内 D.所有原子都可能在同一平面内 7.某一定量有机物和足量Na反应得到L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得L二氧化碳,若在同温同压下=≠0,则该有机物可能是 ①CH3CH(OH)COOH ②HOOC—COOH ③CH3CH2COOH ④HOOCCH2CH(OH)CH2COOH ⑤CH3 CH(OH)CH2OH A.② B.②③④ C.只有④ D.① 8.在适当催化剂存在的条件下,对二甲苯()与对二苯甲醛()均可被O2直接氧化为对二苯甲酸。前后两种方案中,制备等量的对二苯甲酸()时,理论上消耗的O2的物质的量之比为 A.3∶1 B.2∶1 C.1∶1 D.4∶1 9.下列有机物的命名正确的是 A.二溴乙烷: B.3-乙基-1-丁烯: C.2-甲基-2,4-己二烯: D.2,2,3-三甲基戊烷: 10.某有机物X的结构简式为 。下列有关有机物X的说法正确的是 A.有机物X 的分子式为C15H10O5 B.与浓溴水反应,1 mol有机物X最多消耗8 mol Br2 C.一定条件下,1 mol有机物X最多能与8 mol H2反应 D.1 mol有机物X最多能与5 mol NaOH反应 11.关于下列四个装置的说明符合实验要求的是 装置④ 装置③ 装置② 装置① A.装置①:实验室中若需制备较多量的乙炔可用此装置 B.装置②:实验室中可用此装置来制备硝基苯. C.装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥形瓶中可获得碘 D.装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 12.由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生的反应类型和反应条件都正确的是 选项 反应类型 反应条件 A 加成反应、取代反应、消去反应 KOH醇溶液/加热、KOH水溶液/加热、常温 B 消去反应、加成反应、取代反应 NaOH醇溶液/加热、常温、NaOH水溶液/加热 C 氧化反应、取代反应、消去反应 加热、KOH醇溶液/加热、KOH水溶液/加热 D 消去反应、加成反应、水解反应 NaOH水溶液/加热、常温、NaOH醇溶液/加热 13.除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 Ⅰ.试剂:①KMnO4 /H+ ②NaOH溶液 ③饱和Na2CO3 溶液 ④H2O ⑤Na ⑥Br2 /H2O ⑦Br2 /CCl4 Ⅱ.装置: 选项 物质 试剂 装置 A C2H6 (C2H4 ) ⑥ ① B 苯(苯酚) ① ③ C CH3 COOC2H5 (CH3COOH) ③ ② D 甲苯(二甲苯) ③ 14.分子式为C5H1OO2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有 A.15种 B. 28种 C.32种 D.40种 15.用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略) A.②中试剂为饱和NaHCO3溶液 B.打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊 C.苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性 D.③中发生反应的化学方程式是2+CO2 +H2O+Na2CO3 16.已知:乙醇可被强氧化剂氧化为乙酸。 可经三步反应制取,其中第二步的反应类型是 A.水解反应 B.加成反应 C.氧化反应 D.消去反应 17.下列有机合成过程中反应类型不合理的是 A.乙烯→乙二醇: B.溴乙烷→乙醇:CH3CH2BrCH2=CH2CH3CH2OH C.1-溴丁烷→1,2-二溴丁烷: CH3CH2CH2CH2BrCH3CH2CH=CH2 D.乙烯→乙炔:CH2=CH2CH≡CH 18.分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的有机物有(不考虑立体异构) A.3种 B.5种 C.6种 D.7 种 19.由丙烷、乙烯、乙炔组成的混合气体,完全燃烧后生成CO2和H2O的物质的量相同,原混合气体中三种烃的体积比不可能是( ) A.1∶2∶1 B.3∶2∶3 C.2∶5∶2 D.1∶2∶3 20.格利雅试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,它可与羰基发生加成反应,如: 今欲通过上述反应合成2-丙醇,选用的有机原料正确的一组是 A.氯乙烷和甲醛 B.氯乙烷和丙醛 C.一氯甲烷和丙酮 D.一氯甲烷和乙醛 第II卷(非选择题) 21.(10分) I. (1)键线式表示的有机物名称为 。 (2)A和B两种有机物可以互溶,其有关性质如表所示: 密度(20℃) 熔点(℃) 沸点(℃) 溶解性 A 0.7137 g/mL -116.6 34.5 不溶于水 B 0.7893 g/mL -117.3 78.5 与水以任意比混溶 要除去B中混有的少量A,可采用 方法。 A.蒸馏 B.过滤 C.萃取 D.加水充分振荡,分液 Ⅱ.(1)扁桃酸 有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。 (2)分子式为C9H12 且属于苯的同系物的同分异构体的数目为_______ III.有下列各组物质: (A)S2和S4 (B) 和 (C)CH4和C8H18 (D) Br Br Br Br H H H H C C (E) ① 组两物质互为同素异形体; ② 组两物质互为同系物 IV. 配平下列化学方程式,只需将配平后草酸的系数、二氧化氯的系数填入答题页上。 KClO3+ H2C2O4+H2SO4 ClO2↑+K2SO4+CO2↑+H2O 22.(10分)化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向方向) 已知以下信息: i.A属于芳香烃,H属于酯类化合物。 ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。 回答下列问题: (1)E的含氧官能团名称 ,B的结构简式 。 (2)G → J的反应类型 。 (3)① E + F → H的化学方程式 。 ② I → G 的化学方程式 。 (4)H的同系物K比H相对分子质量小28,K有多种同分异构体。 ①K的一种同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式 。 ②若K的同分异构体既属于芳香族化合物,又能和饱和NaHCO3溶液反应放出CO2。则满足该条件的同分异构体共有__________种(不考虑立体异构)。 23.(11分)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3 ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白: a 排出室外 d 碎瓷片 b e c 冷水 水 NaOH NaOH (1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式: 。 (2)写出制备1,2-二溴乙烷的化学方程式 。 (3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。 (4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(写出一条) 。 (5)c装置内NaOH溶液的作用 ;写出e装置内NaOH溶液中所发生的化学反应方程式 : 24.(9分)I.下列是A、B、C、D、E五种短周期元素的某些性质: 性质 A B C D E 化合价 -4 -2 -1 -2 -1 电负性 2.5 2.5 3.0 3.5 4.0 (1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是 (填序号)。 a. b.CH4 c.CH2CHCH3 d.CH3CH2C≡CH e.CH3CH3 (2)相同条件下,AD2与BD2分子在水中的溶解度较大的是 (写化学式) (3)B、D形成的简单氢化物,沸点: 更高(写化学式) II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。 (1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 。 (2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 。 (3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。 试剂a是 ;分离方法③是 。 1 2 3 4 5 6 7 8 9 10 D B B C B B D A C D 11 12 13 14 15 16 17 18 19 20 B B A D D B B C D D 高二下学期期中化学参考答案 (2018.4.16号) 21.(10分)I. (1)4-甲基-2-戊烯(1分) (2)A(1分) Ⅱ. (1)13(2分)(2)8(2分) III.①A;(1分) ②C;(1分) IV. 1、2(2分) (两个系数都对给2分,只对一个系数没分) 22.(10分)(1)羧基;(1分) (1分)(2)加聚反应或聚合反应;(1分) (3) +CH3CH(OH)CH3+H2O;(2分)(2分) (4)①(1分);② 4(2分) 23.(11分)(1) CH3CH2OHCH2=CH2 + H2O(2分) (2) CH2=CH2+Br2 → CH2Br-CH2Br(2分) (3) b中水面会下降,玻璃管中的水面会上升,甚至溢出(2分) (4) ①乙烯发生(或通过液溴)速率过快;’②实验过程中乙醇和浓硫酸的混合液没有迅速达到170℃(或其他合理答案)(2分) (5) c除去乙烯中带出的酸性气体(或除去CO2、SO2)(1分);Br2+2NaOH=NaBr+NaBrO+H2O(2分) 24.(9分)I.d(1分) (2)SO2 (1分) (3)H2O(1分) II.(1)冷凝和防止倒吸(或导气、防倒吸、冷凝)(2分) (2)66.7% (2分) (3) ①饱和碳酸钠溶液(1分) 蒸馏(1分)查看更多