2020届高考化学一轮复习水溶液中的离子平衡图像学案
水溶液图像题的突破方法
命题分析:水溶液中的图像能把抽象的溶液中平衡理论形象地表述出来,借助图形可以更直观地认识到外界条件对溶液中离子平衡的影响。纵观近年高考试题,常考的题型有酸、碱稀释图像,酸、碱中和滴定图像和沉淀溶解平衡图像,通过图像分析考查外界条件改变时,对Kw、K、Ksp的影响,某离子浓度的变化,更多地是考查溶液中离子浓度的守恒和大小关系以及运用Ksp进行的计算和判断等。
突破点1 酸、碱稀释图像
突破方法
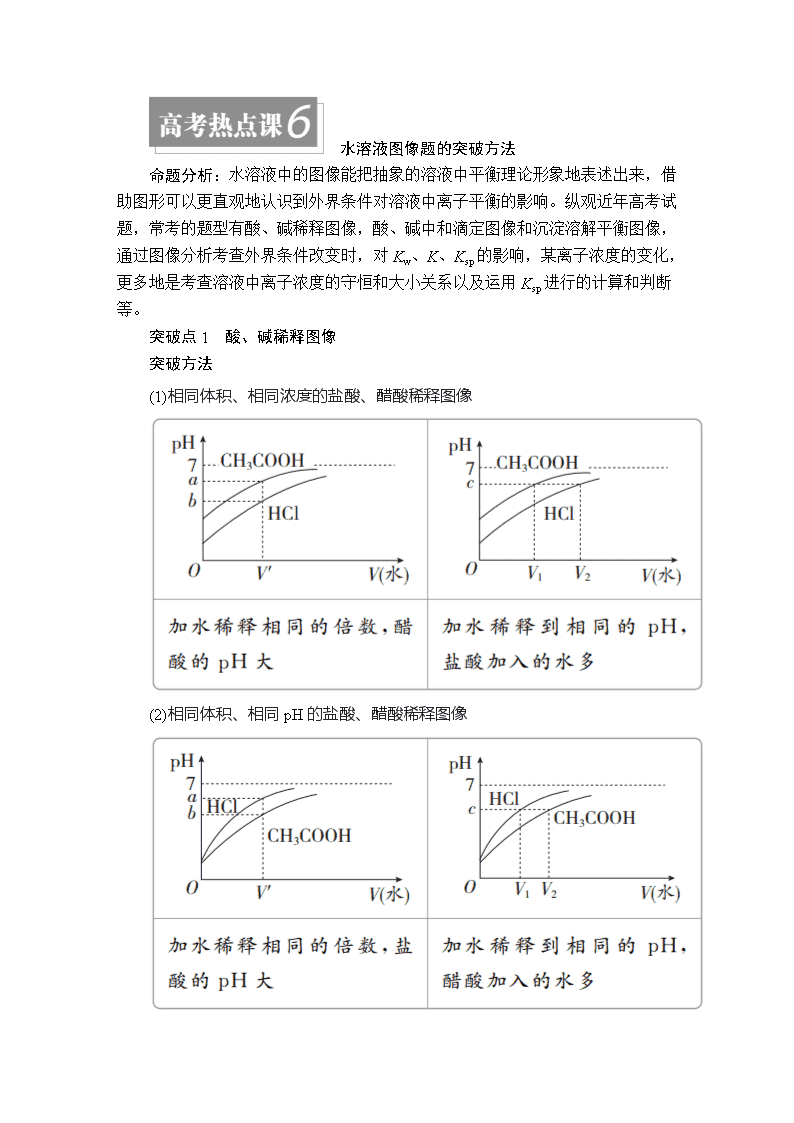
(1)相同体积、相同浓度的盐酸、醋酸稀释图像
(2)相同体积、相同pH的盐酸、醋酸稀释图像
(2018·武汉市高三调研)浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg的变化关系如图所示。下列叙述正确的是( )
A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a
b
D.lg=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则减小
解析 A项,由图像可知当lg=0,即V=V0时,0.1 mol/L的HX溶液和HY溶液的pH分别为2到3之间和1,所以HX是弱酸、HY是强酸,错误;B项,酸抑制水的电离,所以酸性越弱、水的电离程度越大,即pH越大,水电离出的c(H+)·c(OH-)越大,由图像可知,由水电离出的c(H+)·c(OH-):ac(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
解析 己二酸为二元弱酸,当横坐标为0.0时对应M、N两线的pH分别约为5.4和4.4,由第一步电离远远大于第二步电离可知第一步电离时己二酸pH更小,所以N为第一步电离,即曲线N表示pH与lg 的变化关系,B正确;由上述分析可知曲线M为己二酸的第二步电离,则当lg =0.0时,Ka2(H2X)==c(H+)≈10-5.4=100.6×10-6,A正确;NaHX溶液中,<1,则lg<0,此时溶液pH<5.4,溶液呈酸性,所以c(H+)>c(OH-),C正确;由以上分析可知,HX-的电离程度大于其水解程度,故当溶液呈中性时,c(Na2X)>c(NaHX),溶液中各离子浓度大小关系为c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+),D错误。
答案 D
(2018·齐齐哈尔市三模)常温下用0.1000 mol/L的盐酸分别逐滴加入到20.00 mL 0.1000 mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是( )
A.XOH为强碱,MOH、YOH均为弱碱
B.V[HCl(aq)]=15.00 mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C.V[HCl(aq)]=20.00 mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D.V[HCl(aq)]=40.00 mL时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
答案 C
解析 根据图示信息,在未滴加盐酸时,XOH的pH为13,为强碱,MOH、YOH的pH小于13,均为弱碱,A项正确;V[HCl(aq)]=15.00 mL时,三种溶液中分别为XCl、XOH,MCl、MOH,YCl、YOH的混合物,因为碱性:XOH>MOH>YOH,故三种溶液中离子总浓度大小顺序:XOH>MOH>YOH,B项正确;V[HCl(aq)]=20.00 mL时,三种溶液分别恰好是XCl、MCl、YCl溶液,水的电离程度为YOH>MOH>XOH,C项错误;V[HCl(aq)]=40.00 mL时,YOH溶液中应为YCl、HCl的混合物,溶液中的电荷守恒为c(H+)+c(Y+)=c(OH-)+c(Cl-),物料守恒为2[c(Y+)+c(YOH)]=c(Cl-),将电荷守恒和物料守恒两式联立得:c(H+)=c(Y+)+c(OH-)+2c(YOH),D项正确。
突破点3 沉淀溶解平衡图像
突破方法:解沉淀溶解平衡图像题三步骤
第一步:明确图像中纵、横坐标的含义
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义
(1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时Qcc(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
解析 A对:根据题给图像,pH=1.2时,H2A与HA-的物质的量分数相等,则有c(H2A)=c(HA-)。B对:根据题给图像,pH=4.2时,HA-与A2-的物质的量分数相等,K2(H2A)==c(H+)=10-4.2,则lg [K2(H2A)]=-4.2。C对:根据题给图像,pH=2.7时,H2A与A2-的物质的量分数相等,且远小于HA-的物质的量分数,则有c(HA-)>c(H2A)=c(A2-)。D错:根据题给图像,pH=4.2时,HA-与A2-的物质的量分数相等,c(HA-)=c(A2-),且c(HA-)+c(A2-)约为0.1 mol·L-1,c(H+)=10-4.2 mol·L-1,则c(HA-)=c(A2-)>c(H+)。
答案 D
(2018·广东省二模)25 ℃时,改变0.1 mol·L-1 RCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数α(X)=;甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
下列说法正确的是( )
A.丙酸的酸性比甲酸强
B.若0.1 mol·L-1甲酸溶液的pH=2.33,则0.01 mol·L-1甲酸溶液的pH=3.33
C.25 ℃时CH3CH2COOHCH3CH2COO-+H+的lg K=-4.88
D.将0.1 mol·L-1的HCOOH溶液与0.1 mol·L-1的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
答案 C
解析 根据图示,当甲酸、丙酸分子的分布分数α均为50%时,甲酸的pH=3.75,丙酸的pH=4.88。则:Ka(HCOOH)==10-3.75,Ka(CH3CH2COOH)==10-4.88,HCOOH的酸性比丙酸强,A项错误,C项正确;甲酸是弱酸,稀释10倍时,pH变化小于1,若0.1 mol·L-1甲酸溶液的pH=2.33,则0.01 mol·L-1甲酸溶液的pH<3.33,B项错误;Ka(HCOOH)=10-3.75,则Kh(HCOO-)=
==10-10.25,可以看出,等浓度时,HCOOH电离大于HCOO-水解,故将0.1 mol·L-1的HCOOH溶液与0.1 mol·L-1的HCOONa溶液等体积混合,溶液呈酸性,溶液中微粒大小顺序为:c(HCOO-)>c(Na+)>c(HCOOH)>c(H+)>c(OH-),D项错误。