- 2021-08-24 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺600分练习6电化学含解析
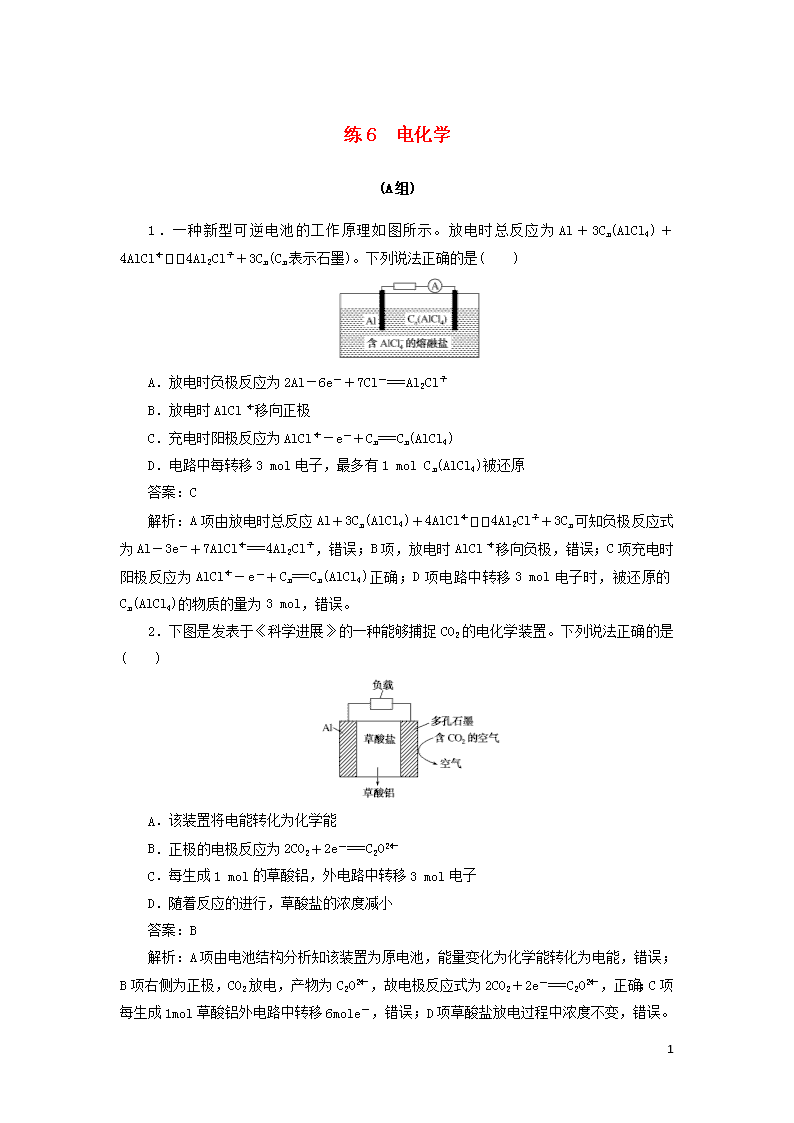
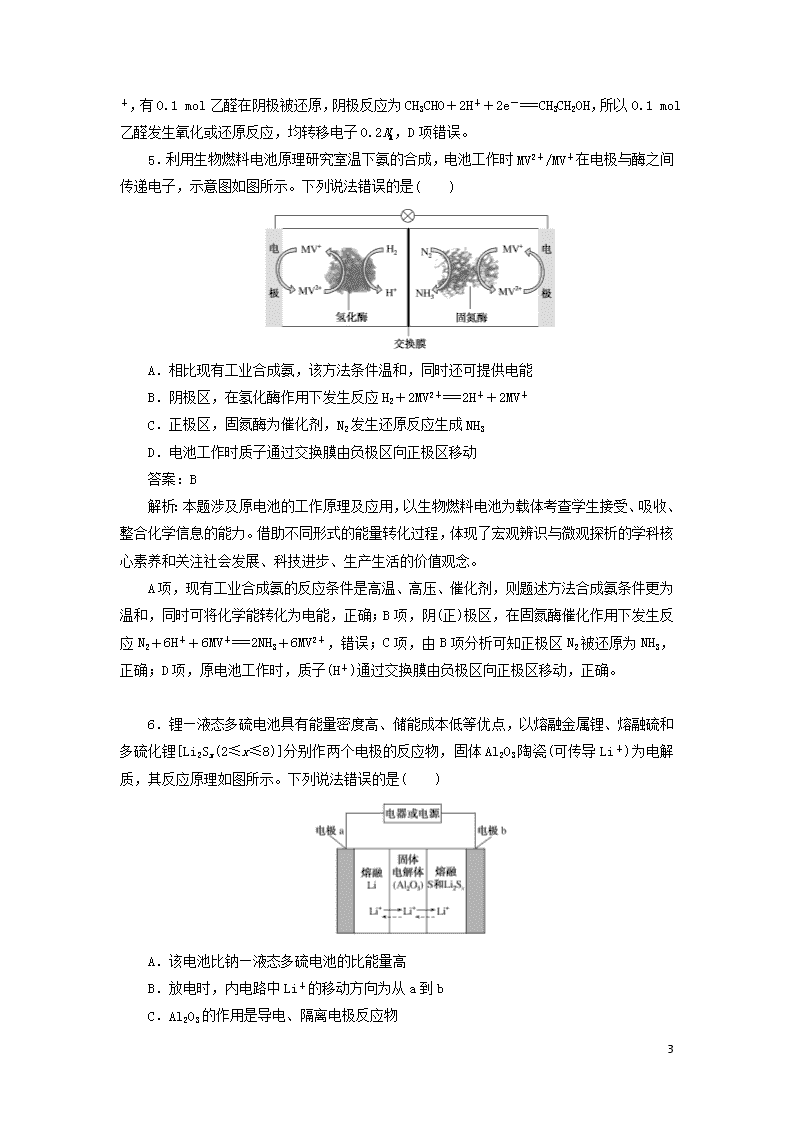
练6 电化学 (A组) 1.一种新型可逆电池的工作原理如图所示。放电时总反应为Al+3Cn(AlCl4)+4AlCl4Al2Cl+3Cn(Cn表示石墨)。下列说法正确的是( ) A.放电时负极反应为2Al-6e-+7Cl-===Al2Cl B.放电时AlCl移向正极 C.充电时阳极反应为AlCl-e-+Cn===Cn(AlCl4) D.电路中每转移3 mol电子,最多有1 mol Cn(AlCl4)被还原 答案:C 解析:A项由放电时总反应Al+3Cn(AlCl4)+4AlCl4Al2Cl+3Cn可知负极反应式为Al-3e-+7AlCl===4Al2Cl,错误;B项,放电时AlCl移向负极,错误;C项充电时阳极反应为AlCl-e-+Cn===Cn(AlCl4)正确;D项电路中转移3 mol电子时,被还原的Cn(AlCl4)的物质的量为3 mol,错误。 2.下图是发表于《科学进展》的一种能够捕捉CO2的电化学装置。下列说法正确的是( ) A.该装置将电能转化为化学能 B.正极的电极反应为2CO2+2e-===C2O C.每生成1 mol的草酸铝,外电路中转移3 mol电子 D.随着反应的进行,草酸盐的浓度减小 答案:B 解析:A项由电池结构分析知该装置为原电池,能量变化为化学能转化为电能,错误;B项右侧为正极,CO2放电,产物为C2O,故电极反应式为2CO2+2e-===C2O,正确;C项每生成1 mol草酸铝外电路中转移6 mol e-,错误;D项草酸盐放电过程中浓度不变,错误。 9 3.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是( ) A.乙烧杯中发生还原反应 B.甲烧杯中溶液的pH逐渐减小 C.电池工作时,盐桥中的SO移向甲烧杯 D.外电路的电流方向是从a到b 答案:D 解析:A项由原理方程式可知乙烧杯中发生Fe2+―→Fe3+的转化,为氧化反应,错误;B项甲烧杯中电极反应式为2MnO+10e-+16H+===2Mn2++8H2O,消耗H+,c(H+)减小,pH逐渐增大,错误;C项SO由正极移向负极,即移向乙烧杯,错误;D项该装置中,a为正极,b为负极,故外电路中电流方向为a―→b,正确。 4.在实验室中,以一定浓度的乙醛Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图所示),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是( ) A.以铅蓄电池为电源,则a极为Pb电极 B.石墨Ⅱ电极附近的pH逐渐减小 C.阳极反应为CH3CHO+H2O-2e-===CH3COOH+2H+ D.每处理含8.8 g乙醛的废水,转移电子的数目为0.4NA 答案:C 解析:根据图示可知,Na+、H+向石墨Ⅱ极移动,石墨Ⅱ为电解池的阴极,b极为电源的负极,a极为电源的正极,以铅蓄电池为电源,铅为负极,二氧化铅为正极,因此a极为PbO2电极,A项错误;在阴极,乙醛得电子生成乙醇,电极反应式为CH3CHO+2H++2e-===CH3CH2OH,电极附近的pH逐渐变大,B项错误;阳极发生氧化反应,CH3CHO失电子被氧化为乙酸,阳极反应为CH3CHO+H2O-2e-===CH3COOH+2H+,C项正确;8.8 g乙醛的物质的量为0.2 mol,有0.1 mol乙醛在阳极被氧化,阳极反应为CH3CHO+H2O-2e-===CH3COOH+2H 9 +,有0.1 mol乙醛在阴极被还原,阴极反应为CH3CHO+2H++2e-===CH3CH2OH,所以0.1 mol乙醛发生氧化或还原反应,均转移电子0.2NA,D项错误。 5.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( ) A.相比现有工业合成氨,该方法条件温和,同时还可提供电能 B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+ C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3 D.电池工作时质子通过交换膜由负极区向正极区移动 答案:B 解析:本题涉及原电池的工作原理及应用,以生物燃料电池为载体考查学生接受、吸收、整合化学信息的能力。借助不同形式的能量转化过程,体现了宏观辨识与微观探析的学科核心素养和关注社会发展、科技进步、生产生活的价值观念。 A项,现有工业合成氨的反应条件是高温、高压、催化剂,则题述方法合成氨条件更为温和,同时可将化学能转化为电能,正确;B项,阴(正)极区,在固氮酶催化作用下发生反应N2+6H++6MV+===2NH3+6MV2+,错误;C项,由B项分析可知正极区N2被还原为NH3,正确;D项,原电池工作时,质子(H+)通过交换膜由负极区向正极区移动,正确。 6.锂—液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属锂、熔融硫和多硫化锂[Li2Sx(2≤x≤8)]分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列说法错误的是( ) A.该电池比钠—液态多硫电池的比能量高 B.放电时,内电路中Li+的移动方向为从a到b C.Al2O3的作用是导电、隔离电极反应物 9 D.充电时,外电路中通过0.2 mol电子,阳极区单质硫的质量增加3.2 g 答案:D 解析:A项,电池提供2 mol e-电量时,该电池对应Li2Sx质量为(14+32x)g,而钠—液态多硫电池对应质量为(46+32x)g,故该电池比能量高,正确;B项由图分析知a为负极,b为正极,Li+从a极移向b极,正确;C项Al2O3为固体电解质,故能导电,同时将两极反应物隔开,正确;D项当外电路中通过0.2 mol e-时,阳极区生成0.1x mol硫,故阳极区生成硫的质量为3.2x g,错误。 7.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( ) A.X为直流电源的负极,Y为直流电源的正极 B.阳极区pH增大 C.图中的b>a D.该过程中的产品主要为H2SO4和H2 答案:B 解析:A项,由图示可知Pt(Ⅰ)极上H+―→H2,发生还原反应,故Pt(Ⅰ)为阴极,X为直流电源的负极,Y为直流电源的正极,正确;B项,Pt(Ⅱ)为阳极,在阳极,SO、HSO被氧化为H2SO4,SO+H2O-2e-===2H++SO,HSO+H2O-2e-===3H++SO,溶液的酸性增强,pH减小,错误;C项,由上面的分析可知,阳极有H2SO4生成,故b>a,正确;D项,阳极产物为H2SO4,阴极产物为H2,正确。 8.某污水处理厂利用微生物电池将镀铬废水中的Cr2O催化还原,其工作原理如下图所示。下列说法不正确的是( ) 9 A.电池工作过程中电子由a极流向b极 B.b极反应式:Cr2O+6e-+14H+===2Cr3++7H2O C.电池工作过程中a极区附近溶液的pH增大 D.每处理1 mol Cr2O,可生成33.6 L(标况下)CO2 答案:C 解析:由图分析知a极发生CH3COOH―→CO2+H+,氧化反应,为负极,b极发生Cr2O+H+―→Cr3+,还原反应,为正极。A项电子由负极流向正极,正确;B项b极反应式为Cr2O+6e-+14H+===2Cr3++7H2O,正确;C项由a极反应式知生成H+,故c(H+)增大,pH减小,错误;D项1 mol Cr2O转化为Cr3+得6 mol e- CH3COOH―→CO2每生成1 mol CO2失4 mol e-,故每处理1 mol Cr2O生成CO2的物质的量为mol(标况下33.6 L),正确。 (B组) 1.科研人员设计了一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种电催化膜反应器可用于正丙醇合成丙酸,装置示意图如图所示,以下叙述错误的是( ) A.微孔钛膜作阴极 B.使用Na2SO4溶液是为了在电解开始时增强溶液导电性 C.正丙醇转化为丙酸的电极反应式为CH3CH2CH2OH+H2O-4e-===CH3CH2COOH+4H+ D.反应器工作时料槽中正丙醇分子向电催化膜移动 答案:A 解析:电催化膜反应器可用于正丙醇合成丙酸,正丙醇合成丙酸属于氧化反应,所以微孔钛膜作阳极,A项错误;Na2SO4溶液可增强溶液导电性,B项正确;正丙醇失电子发生氧化反应生成丙酸,电极反应式为CH3CH2CH2OH+H2O-4e-===CH3CH2COOH+4H+,C项正确;微孔钛膜作阳极,所以反应器工作时料槽中正丙醇分子向电催化膜移动,D项正确。 2.硼酸(H3BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( ) 9 A.M室的电极反应式为2H2O-4e-===O2↑+4H+ B.N室中,进口和出口的溶液浓度大小关系为a%查看更多
- 当前文档收益归属上传用户