内蒙古呼和浩特市2020届高三第二次质量普查调研考试化学试题 Word版含解析
2020年呼和浩特市高三年级第二次质量普查调研考试
理科综合能力测试
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 C1-35.5 Nb-93
一、选择题:
1.中华传统文化源远流长下列对古代著作涉及化学的解读不正确的是( )
A. “以火烧之,紫青烟起,乃真硝石也”利用的是钾元素的焰色反应
B. “落红不是无情物,化作春泥更护花”蕴藏着自然界碳、氮的循环
C. “煮豆燃豆其,豆在釜中泣”涉及的能量变化主要是化学能转化为热能
D. “日照澄洲江雾开,淘金女伴满江限。美人首饰侯王印,尽是沙中浪底来”诗中淘金原理与化学上的萃取一致
【答案】D
【解析】
【详解】A.K元素的焰色为紫色,故“以火烧之,紫青烟起,乃真硝石也”利用的是钾元素的焰色反应,A正确;
B.“落花”中的有机物在土壤中被微生物分解成无机物,形成“春泥”,作为植物的营养(矿质营养、无机营养)被植物吸收,重新起到“护花”作用,B正确;
C.燃豆萁属于放热反应,涉及的能量变化主要是化学能转化为热能,C正确;
D.“日照澄洲江雾开,淘金女伴满江限。美人首饰侯王印,尽是沙中浪底来”诗中淘金原理与化学上的过滤一致,D错误;
答案选D。
2.下列有关说法正确的是( )
A. 汽油、柴油、花生油都是多种碳氢化合物的混合物
B. 蚕丝的主要成分是蛋白质属于天然有机高分子材料
C. 中所有碳原子一定在同一平面上
D. 淀粉和纤维素在人体内水解的最终产物均为葡萄糖
【答案】B
【解析】
【详解】A.花生油属于酯类物质,含有C、H、O三种元素,不属于碳氢化合物,A错误;
- 22 -
B.蚕丝的主要成分是蛋白质,属于天然有机高分子材料,B正确;
C.因为碳碳单键可以旋转,所以中所有碳原子可能在同一平面上,也可能不在同一平面上,C错误;
D.纤维素在人体内不能水解,D错误;
答案选B。
3.短周期主族元素X、Y、Z、Q、R的原子序数依次增大X的一种简单离子与锂离子具有相同的电子层结构Y原子最外层电子数等于内层电子数的2倍,Q的单质与X2Z反应生成X的单质。向X2R的水溶液中缓缓通入RZ2气体,有R单质产生。下列说法正确的是( )
A. X2R溶液为中性
B. 工业上通常采用电解法冶炼Q的单质
C. 最简单气态氢化物的稳定性R>Y>Z
D. RZ2通入Ba(NO3)2溶液中,无明显现象
【答案】B
【解析】
【详解】短周期主族元素X、Y、Z、Q、R原子序数依次增大,X的一种简单离子与锂离子具有相同的电子层结构,则X为氢,Y原子最外层电子数等于内层电子数的2倍,则Y为碳,Q的单质与X2Z反应生成X的单质,则Q为钠,钠与水反应生成氢气,Z为氧,向X2R的水溶液中缓缓通入RZ2气体,有R单质产生,R常见化合价为-2及+4价,则R为硫。
A. H2S溶液为氢硫酸,呈酸性,故A错误;
B. Q为钠,工业上通常采用电解熔融氯化钠的方法冶炼,故B正确;
C. 非金属性越强,其氢化物稳定性越强,最简单气态氢化物的稳定性H2O >CH4>H2S,即Z >Y>R,故C错误;
D. SO2通入Ba(NO3)2溶液中,反应生成硫酸钡沉淀,故D错误;
故选B。
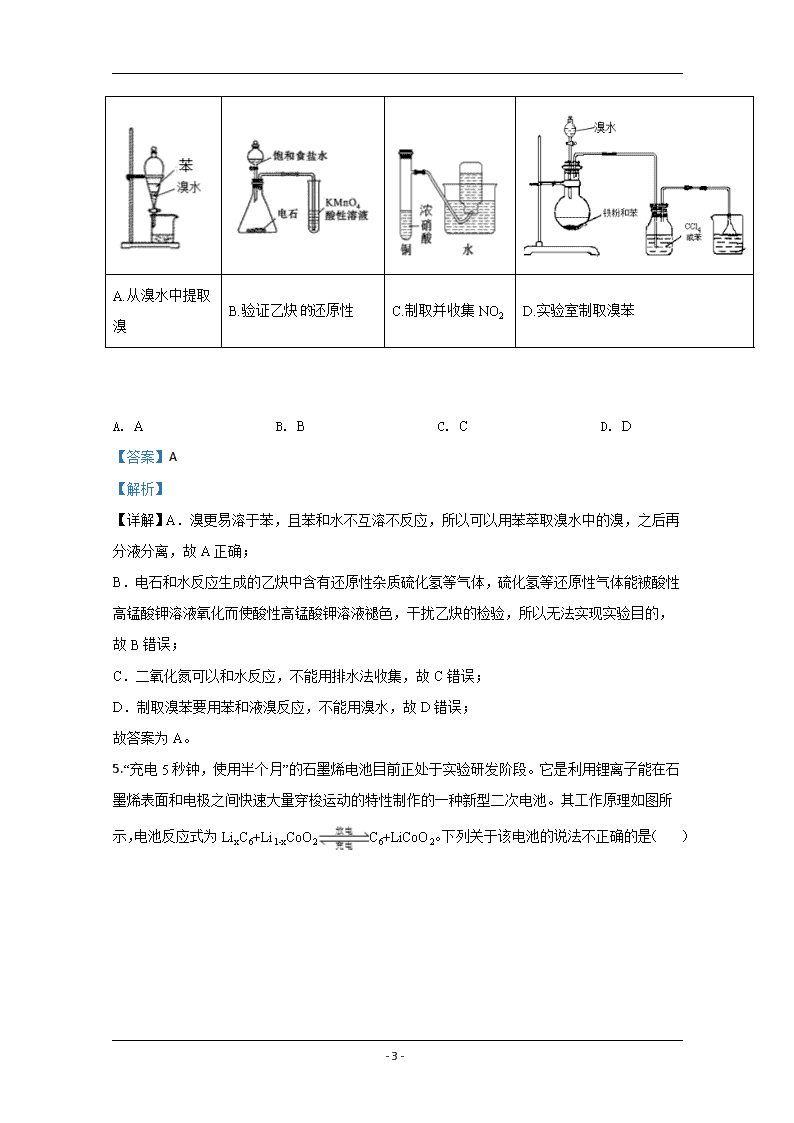
4.下列实验方案能达到实验目的的是( )
- 22 -
A.从溴水中提取溴
B.验证乙炔还原性
C.制取并收集NO2
D.实验室制取溴苯
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.溴更易溶于苯,且苯和水不互溶不反应,所以可以用苯萃取溴水中的溴,之后再分液分离,故A正确;
B.电石和水反应生成的乙炔中含有还原性杂质硫化氢等气体,硫化氢等还原性气体能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,干扰乙炔的检验,所以无法实现实验目的,故B错误;
C.二氧化氮可以和水反应,不能用排水法收集,故C错误;
D.制取溴苯要用苯和液溴反应,不能用溴水,故D错误;
故答案为A。
5.“充电5秒钟,使用半个月”的石墨烯电池目前正处于实验研发阶段。它是利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性制作的一种新型二次电池。其工作原理如图所示,电池反应式为LixC6+Li1-xCoO2C6+LiCoO2。下列关于该电池的说法不正确的是( )
- 22 -
A. 充电时,Li+移向石墨烯
B. 充电时,转移0.5mol电子理论上阴极材料质量增加3.5g
C. 放电时,LiCoO2极发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”,让Li+从石墨烯中脱出有利于回收
【答案】C
【解析】
【分析】
电池反应式知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,上图中左侧为正极,右侧为负极;充电时,阴极、阳极反应式与负极、正极反应式正好相反,根据二次电池的工作原理结合原电池和电解池的工作原理来解答。
【详解】A. 由电池反应知,充电时,Li+在阴极得电子,所以Li+移向石墨烯,故A正确;
B. 充电时,阴极发生的反应为xLi++ xe-+C6=LixC6,转移0.5mol电子时,质量增加0.5mol×7g/mol=3.5g,故B正确;
C. 放电时,LiCoO2极为正极,得电子发生还原反应,电极反应为Li1-xCoO2+xLi++xe-=LiCoO2,故C错误;
D. 根据电池反应式知,充电时锂离子加入石墨中,废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收,故D正确;
故选C。
6.在某温度时将nmol·L-1氨水滴入10mLymol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法不正确的是( )
- 22 -
A y=1.0
B. a点时Kw<1×10-14
C. b点c(NH4+)
、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
【答案】 (1). -744.9 (2). 降低温度 (3). (4). 1 (5). < (6). 乙 (7). 乙的催化活性高(或乙的催化效率高) (8). 一定不是 (9). 催化剂活性降低(或副反应增多)
【解析】
【分析】
- 22 -
(1)根据盖斯定律计算ΔH;
(2)①如果要将图中B点的平衡状态改变为A点的平衡状态,平衡转化率增大,平衡正向进行;
②根据反应速率、计算即可;
③图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,C点二氧化氮转化率30%,计算B、C点对应反应的平衡常数判断反应温度高低;
(3)①根据图象,催化剂在低温下对NO转化率的影响分析;
②使用不同催化剂、温度相同时平衡转化率应相等;甲催化剂随温度升高NO转化率先增大后减小,高于210℃时,NO转化率降低是催化剂活性降低;
【详解】(1)①CO(g)+H2O(g)CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1;
②CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1;
③CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1;
根据盖斯定律,将×(③-②+①×2)得:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-744.9 kJ·mol-1;故答案为:-744.9;
(2)①如果要将图中B点的平衡状态改变为A点的平衡状态,平衡转化率增大,平衡正向进行,正反应为放热反应,降低温度,平衡正向移动,转化率增大,故答案为:降低温度;
②B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0 mol•L-1,c(NO2)=c0 mol•L-1,根据三段式:
NO2 (g) + SO2 (g) ⇌ SO3 (g) + NO (g)
起始量(mol/L) c0 c0 0 0
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
;,故答案:;1;
③NO2(g)+SO2(g)SO3(g)+NO(g) ΔH<0,反应为放热反应,图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0 mol•L-1,c(NO2)=c0 mol•L-1,根据三段式:
- 22 -
NO2 (g) + SO2 (g) ⇌ SO3 (g) + NO (g)
起始量(mol/L) c0 c0 0 0
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
B点平衡常数K(B)=1,
C点二氧化氮转化率30%,n(NO2):n(SO2)=1.5,SO2(g)的起始浓度为c0 mol•L-1,c(NO2)=1.5c0mol/L,根据三段式:
NO2 (g) + SO2 (g) ⇌ SO3 (g) + NO (g)
起始量(mol/L) 1.5c0 c0 0 0
变化量(mol/L) 0.45c0 0.45c0 0.45c0 0.45c0
平衡量(mol/L) 1.05c0 0.55c0 0.45c0 0.45c0
平衡常数K(C)=0.35;
平衡常数:B点大于C点,说明反应温度TB7,则证明苯甲酸是弱酸
【解析】
【分析】
(1)回流装置用球形冷凝管;
(2)经冷凝管冷凝回流的冷凝液进入分水器,分层后,甲苯自动流回到三颈烧瓶中,水从分水器中放出去,这样可以促使反应正向进行,提高甲苯的利用率;该反应完成时,三颈烧瓶中酸性KMnO4溶液颜色不再发生变化;
(3)苯甲酸溶解度随温度升高而增大;抽滤具有过滤速率快,得到的固体水分少等优点;从装置图可知,装置3起到安全瓶的作用;
(4)由于第二步用硫酸酸化滤液,因此可通过检验SO42-来判断粗产品是否洗涤干净;
(5)9.2g甲苯的物质的量为:0.1mol,根据反应方程式,理论上生成苯甲酸为:0.1mol,其质量为0.1mol×122g·mol-1=12.2g,根据实际生成11.0g苯甲酸,可求出苯甲酸的产率;
(6)要通过实验确定苯甲酸是弱酸,最简单的方法就是用pH试纸测定0.010mol·L-1苯甲酸钠溶液的pH大小;
【详解】(1)乙的名称为球形冷凝管,故答案为:球形冷凝管;
(2)实验过程中,经冷凝管冷凝回流的冷凝液进入分水器,分层后,甲苯自动流回到三颈烧瓶中,生成的水从分水器中放出去,这样可以促使反应正向进行,提高甲苯的利用率,同时能减少抽滤所需时间;该反应完成时,三颈烧瓶中酸性KMnO4
- 22 -
溶液颜色不再发生变化,或停止搅拌,静置,液体不再出现分层现象,故答案为:提高甲苯利用率(或转化率);反应混合液颜色不再发生变化(或反应结束后静置不再分层);
(3)苯甲酸溶解度随温度升高而增大,趁热过滤的原因是减少苯甲酸因温度低时析出产率降低;抽滤具有过滤速率快,得到的固体水分少等优点;装置3起到安全瓶(或防倒吸、平衡气压)的作用;故答案为:苯甲酸溶解度随温度升高而增大,减少苯甲酸因温度低时析出产率降低;过滤速度快,得到的固体水份少(固液分离更快更彻底);安全瓶(或防倒吸、平衡气压);
(4)由于第二步用硫酸酸化滤液,因此可通过检验SO42-来判断粗产品是否洗涤干净,检验的方法是向少许最后一次的洗涤液中滴入几滴BaCl2溶液,若无沉淀生成,则说明粗产品洗涤干净,故答案为:取最后一次的洗涤液少许于试管中,滴加几滴BaCl2溶液,若无沉淀生成,产品洗涤干净;
(5)9.2g甲苯的物质的量为:0.1mol,根据反应方程式,理论上生成苯甲酸为:0.1mol,其质量为0.1mol×122g·mol-1=12.2g,根据实际生成11.0g苯甲酸,可求出苯甲酸的产率为11.0g/12.2g×100%≈90.2%,故答案为:90.2%;
(6)实验确定苯甲酸是弱酸,最简单的方法就是用pH试纸测定0.010mol·L-1苯甲酸钠溶液的pH大小,所以用一支干燥洁净的玻璃棒蘸取0.010mol/L的苯甲酸钠溶液滴在pH试纸上,若pH>7,则证明苯甲酸是弱酸,故答案为:用一支干燥洁净的玻璃棒蘸取0.010mol/L的苯甲酸钠溶液滴在pH试纸上,若pH>7,则证明苯甲酸是弱酸。
【点睛】通过实验确定苯甲酸是弱酸,用pH试纸测定0.010mol·L-1苯甲酸钠溶液,而不是测0.010mol·L-1苯甲酸溶液,因若测苯甲酸溶液,只能知道苯甲酸是酸,不能确定其强弱;测苯甲酸钠溶液,得出pH>7,说明苯甲酸根离子水解,使溶液显碱性,说明苯甲酸是弱酸。
10.钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上可利用多种钼矿制备钼酸钠。镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)是我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。工业上进行选择性还原熔炼可以提取镍铁合金同时得到钼酸钠晶体(Na2MoO4·2H2O),其主要流程如图:
- 22 -
已知:Na2MoO4·2H2O是白色晶体,在水中的溶解度随温度升高而增大。
(1)还原熔炼过程中发生了较多的化学变化请结合题干信息补充完整NiS发生的化学反应方程式,并配平。___
□NiS+□Na2CO3+3C+2O2___+____+___。
(2)向水浸液中通人适量CO2和空气,然后过滤,所得滤渣的主要成分为___。
(3)已知过滤所得混合液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1,加入Ba(OH)2固体除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___。
(已知Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8)
(4)从钼酸钠溶液中获取钼酸钠晶体的操作___。
(5)工业上还可以利用如图所示电解装置浸取辉钼矿(主要成分为MoS2)得到Na2MoO4和Na2SO4溶液,制备钼酸钠晶体。
①电解一段时间,电极B附近pH___(填“增大”“减小”或“不变”);
②简述MoO42-生成的原因___。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在二种不同介质中的腐蚀速率实验结果如图所示:
- 22 -
①已知:钼酸钠、月挂酰肌氨酸的相对分子质量分别为M1、M2,要使碳素钢的缓蚀效果最优,钼酸钠和月挂酰肌氨酸的物质的量浓度比应为____;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____。
【答案】 (1). NiS+Na2CO3+3C+2O22Ni+2Na2S+5CO2 (2). S、H2SiO3 (3). 90% (4). 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 (5). 增大 (6). 阳极产生Cl2使MoS2氧化为Na2MoO4 (7). M2:M1 (8). 常温下铁遇浓硫酸钝化
【解析】
【分析】
镍钼矿主要含有MoS2、NiS2、NiS、FeS2、SiO2和C,灼烧镍钼矿,MoS2燃烧,反应方程式为:2MoS2+7O22MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O。
【详解】(1)根据氧化还原反应,得失电子守恒,C元素的化合价从0价升高为+4价生成二氧化碳,Ni元素的化合价从+2价降低为0价,生成单质Ni,O元素的化合价从0价降低为-2价生成二氧化碳,反应方程式为:NiS+Na2CO3+3C+2O22Ni+2Na2S+5CO2,故答案为:NiS+Na2CO3+3C+2O22Ni+2Na2S+5CO2;
(2)SiO2是酸性氧化物,能与碱性溶液反应,水浸液中含SiO32-,通入二氧化碳后发生反应为SiO32-+CO2+H2O=H2SiO3↓+CO32-;水浸液中还含S2-,通入空气被氧化生成S单质,所得到的沉淀为H2SiO3,S,故答案为:H2SiO3,S;
(3)Ksp(BaMoO4)=4×10-8,钼酸钠溶液中c(MoO42-)=0.40 mol•L-1,BaMoO4
- 22 -
开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)==1×10-7mol·L-1,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子浓度为:c(CO32-)==1.0×10-2 mol·L-1,原溶液中c(CO32-)=0.10mol•L-1,碳酸根离子的去除率为:(1-)×100%=1-10%≈90%,故答案为:90%;
(4)钼酸钠溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到钼酸钠晶体,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)①根据图可知,电极B为阴极,发生还原反应,水电离出的氢离子放电,所以电解一段时间后,B附近pH增大,故答案为:增大;
②电极A为阳极,发生氧化反应,溶液中的氯离子失去电子生成氯气,氯气与水反应生成次氯酸,次氯酸将MoS2氧化生成MoO42-,故答案为:阳极产生Cl2使MoS2氧化为Na2MoO4;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,,当相同时,c与M成反比,即物质的量浓度比为:M2:M1,根据故答案为:M2:M1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,故答案为:常温下铁遇浓硫酸钝化;
【点睛】难容电解质的溶度积Ksp越大,沉淀越溶;根据Ksp(BaMoO4)=4×10-8,计算钡离子的浓度,再根据Ksp(BaCO3)=1×10-9,计算碳酸根离子的浓度,再求出碳酸根离子的去除率即可。
(二)选考题
11.据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:
(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是___(填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中
- 22 -
As原子与2个C原子、1个Cl原子形成的VSEPR模型为____。
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是___,石墨烯导电的原因是____。
(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
物质
六氯苯
六溴苯
苯六酸
熔点/℃
231
325
287
水溶性
不溶
不溶
易溶
六溴苯的熔点比六氯苯高的原因是____,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是___。
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON)
- 22 -
,比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为__g·cm-3。(NA是阿伏加德罗常数的值,相关原子量:Nb—93)
【答案】 (1). a (2). 四面体形 (3). sp3 (4). 石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性 (5). 两者结构相似,六溴苯的相对分子质量大于六氯苯,形成的范德华力强,熔点高 (6). 苯六酸含多个羧基,与水分子形成氢键,从而易溶于水,六氯苯、六溴苯为非极性分子,难溶于水 (7).
【解析】
【分析】
(1)激发态失去最外层1个电子所需能量最小;
(2)As原子与2个C原子、1个Cl原子形成共价键,还有一对孤电子对;
(3)石墨烷中碳原子形成4个共价键,杂化类型为sp3;石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性;
(4)分子晶体,结构相似,相对分子质量越大,形成的范德华力强,熔点高;苯六酸含多个羧基,与水分子能形成氢键;六氯苯、六溴苯为非极性分子,根据相似相溶原理,均难溶于水;
(5)根据计算。
【详解】(1)Nb元素的基态原子的核外电子排布式为[Kr]4d55s1,失去最外层1个电子所需能量, [Kr]4d35s15p1属于激发态的电子排布式,所以失去最外层1个电子所需能量最小的a
- 22 -
,故答案为:a;
(2)As原子与2个C原子、1个Cl原子形成共价键,还有一对孤电子对,其VSEPR模型为四面体形,故答案为:四面体形;
(3)石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子形成4个共价键,杂化类型为sp3;石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性,故答案为:sp3;石墨烯中每个碳原子垂直于层平面的2p轨道上的电子,都参与形成了贯穿全层的多原子的大键,因而具有优良的导电性;
(4)六溴苯和六氯苯均属于分子晶体,且结构相似,六溴苯的相对分子质量大于六氯苯,形成的范德华力强,熔点高;苯六酸含多个羧基,与水分子能形成氢键,从而易溶于水,六氯苯、六溴苯为非极性分子,根据相似相溶原理,均难溶于水,故答案为:两者结构相似,六溴苯的相对分子质量大于六氯苯,形成的范德华力强,熔点高;苯六酸含多个羧基,与水分子形成氢键,从而易溶于水,六氯苯、六溴苯为非极性分子,难溶于水;
(5)根据晶胞图可知,该晶胞中含有2个Nb原子,2个O原子,2个N原子,所以,故答案为:;
【点睛】杂化类型:中心原子的价层电子对数为4,则sp3杂化、中心原子的价层电子对数为3,则sp2杂化、中心原子的价层电子对数为2,则sp杂化;中心原子的价层电子对数=键+孤电子对数。
12.利用蒈烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如图。
- 22 -
已知①
②R1CHO+R2CH2CHO+H2O
(1)A的分子式为___。
(2)B的结构简式___。
(3)C中含氧官能团名称为___。
(4)由D生成E,F生成G的反应类型分别是____和_____。
(5)写出由G生成H的化学方程式为____。
(6)满足下列条件D的同分异构体有___种。(不考虑立体异构)
①1molD与碳酸氢钠溶液反应生成标准状况下22.4LCO2气体;
②D分子与稀硫酸共热可水解生成异丙醇;
③该化合物能使溴水褪色。
(7)写出以和CH3CH2OH为原料制备的合成路线流程图(无机试剂任用)___。
【答案】 (1). C10H16 (2). (3). 羰基 (4). 取代反应 (5). 消去反应 (6). +CH3OH+H2O (7). 8种 (8).
- 22 -
【解析】
【分析】
A发生氧化反应生成B,根据已知信息①,B为,B发生信息②中反应生成C,C发生氧化反应生成D,D发生取代反应生成E,G与甲醇在浓硫酸加热条件下发生酯化反应生成H,则G为,F发生消去反应生成G,据此解答。
【详解】(1)根据A的结构简式可知,A分子式为:C10H16,故答案为:C10H16;
(2)A发生氧化反应生成B,根据已知信息①,B为,故答案为:;
(3)C的结构简式为:,其中含氧官能团名称为:羰基,故答案为:羰基;
(4)D发生取代反应生成E,G与甲醇在浓硫酸加热条件下发生酯化反应生成H,则G为,F发生消去反应生成G,故答案为:取代反应;消去反应;
(5)G与甲醇在浓硫酸加热条件下发生酯化反应生成H,则G为
- 22 -
,其化学反应方程式为:+CH3OH+H2O,故答案为:+CH3OH+H2O;
(6)D的分子式为:C8H12O4,①1mol D与碳酸氢钠溶液反应生成标准状况下22.4LCO2气体,说明含有1个羧基;②D分子与稀硫酸共热可水解生成异丙醇,说明D中含有酯基;③该化合物能使溴水褪色,根据分子式推断,含有碳碳双键;则D的同分异构体有:
CH(CH3)2OOCCH=CHCH2COOH、CH(CH3)2OOCCH2CH=CHCOOH、CH(CH3)2OOCC(CH2)CH2COOH、
CH(CH3)2OOCC(CH3)=CHCOOH、CH(CH3)2OOCCH(COOH)CH=CH2、CH(CH3)2OOCC(COOH)=CHCH3、
CH(CH3)2OOCCH=C(COOH)CH3、CH(CH3)2OOCCH2C(COOH)=CH2,共有8种,故答案为:8种;
(7)以和CH3CH2OH为原料制备,由苯丙烯酸和乙醇发生酯化反应得到,苯丙烯酸由苯丙烯醛发生氧化反应得到,苯丙烯醛由苯甲醛和乙醛发生信息中的反应得到,乙醛由乙醇发生氧化反应得到,其合成路线为:,故答案为:
- 22 -
。
【点睛】即能使溴水褪色,也能使酸性高锰酸钾溶液褪色:碳碳双键、碳碳三键;但其原理不一样,使溴水褪色是发生了加成反应,使酸性高锰酸钾溶液褪色是发生了氧化反应。苯也能使溴水褪色,其原理是萃取。
- 22 -