- 2021-08-24 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】广东省清远市方圆培训学校2020届高三模拟试题精练(二十九)(解析版)
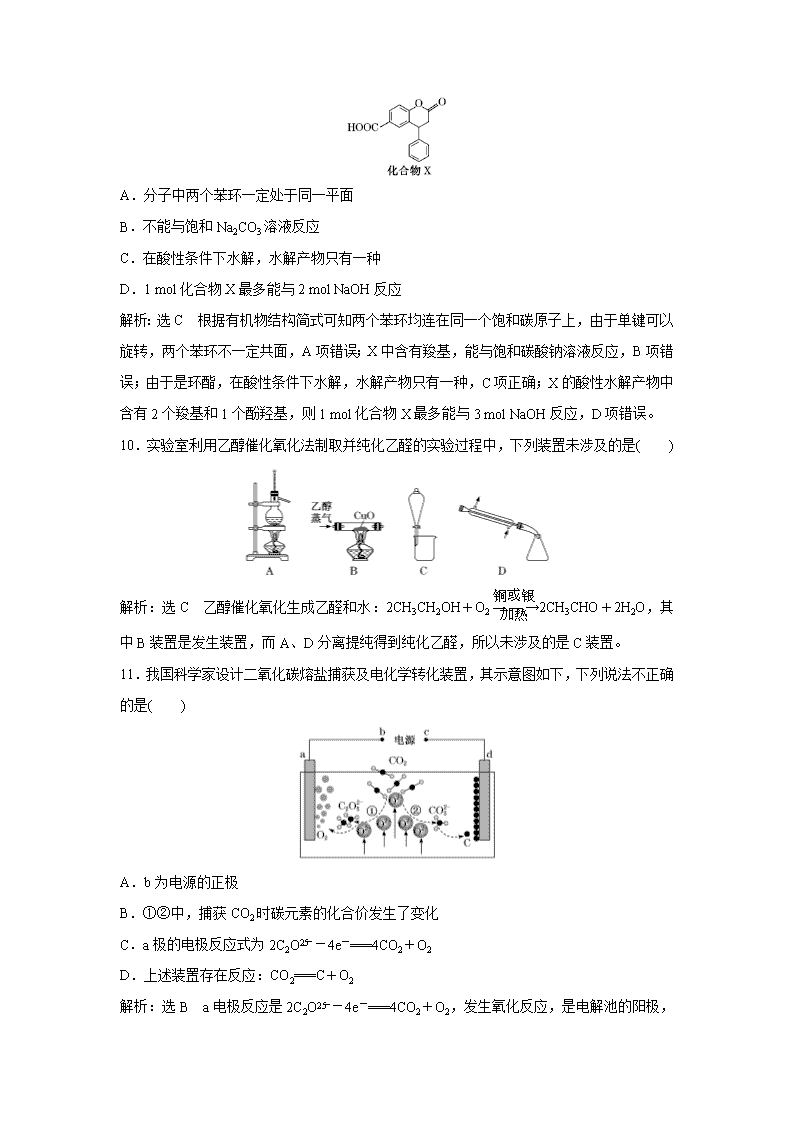
广东省清远市方圆培训学校2020届高三模拟试题精练(二十九) 可能用到的相对原子质量:C 12 O 15 Cu 64 Fe 56 H 1 Ce 140 一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.下列中国制造的产品主体用料不是金属材料的是( ) 世界最大射 电望远镜 中国第一艘 国产航母 中国大飞机 C919 世界最长的 港珠澳大桥 A.钢索 B.钢材 C.铝合金 D.硅酸盐 解析:选D 钢索是金属材料,故A不符合;钢材属于合金为金属材料,故B不符合;铝合金属于金属材料,故C不符合;硅酸盐不是金属材料,故D符合。 8.下列指定反应的离子方程式正确的是( ) A.饱和Na2CO3溶液与CaSO4固体反应:CO+CaSO4CaCO3+SO B.酸化NaIO3和NaI的混合溶液:I-+IO+6H+===I2+3H2O C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3===2FeO+3Cl-+4H++H2O D.电解饱和食盐水:2Cl-+2H+Cl2↑+H2↑ 解析:选A A项,饱和Na2CO3溶液与CaSO4发生复分解反应生成更难溶于水的CaCO3,反应的离子方程式为CO+CaSO4CaCO3+SO,正确;B项,电荷不守恒,得失电子不守恒,正确的离子方程式为5I-+IO+6H+===3I2+3H2O,错误;C项,在碱性溶液中不可能生成H+,正确的离子方程式为3ClO-+2Fe(OH)3+4OH-===3Cl-+2FeO+5H2O,错误;电解饱和食盐水生成NaOH、H2和Cl2,其离子方程式为2Cl-+2H2OCl2↑+H2↑+2OH-,D项错误。 9.化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( ) A.分子中两个苯环一定处于同一平面 B.不能与饱和Na2CO3溶液反应 C.在酸性条件下水解,水解产物只有一种 D.1 mol化合物X最多能与2 mol NaOH反应 解析:选C 根据有机物结构简式可知两个苯环均连在同一个饱和碳原子上,由于单键可以旋转,两个苯环不一定共面,A项错误;X中含有羧基,能与饱和碳酸钠溶液反应,B项错误;由于是环酯,在酸性条件下水解,水解产物只有一种,C项正确;X的酸性水解产物中含有2个羧基和1个酚羟基,则1 mol化合物X最多能与3 mol NaOH反应,D项错误。 10.实验室利用乙醇催化氧化法制取并纯化乙醛的实验过程中,下列装置未涉及的是( ) 解析:选C 乙醇催化氧化生成乙醛和水:2CH3CH2OH+O22CH3CHO+2H2O,其中B装置是发生装置,而A、D分离提纯得到纯化乙醛,所以未涉及的是C装置。 11.我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下,下列说法不正确的是( ) A.b为电源的正极 B.①②中,捕获CO2时碳元素的化合价发生了变化 C.a极的电极反应式为2C2O-4e-===4CO2+O2 D.上述装置存在反应:CO2===C+O2 解析:选B a电极反应是2C2O-4e-===4CO2+O2 ,发生氧化反应,是电解池的阳极,则b为正极,故A、C正确;①捕获CO2时生成的C2O中碳元素的化合价仍为+4价,②捕获CO2时生成CO时碳元素的化合价仍为+4价,碳元素的化合价均未发生变化,故B错误;由电解装置示意图可知a电极生成O2,d电极生成C,电解池总反应式为CO2===C+O2,故D正确。 12.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是( ) A.原子半径:Z>W>R B.最简单氢化物的热稳定性:R>W C.W与X形成的化合物同W与Z形成的化合物的化学键类型完全相同 D.Y的最高价氧化物对应的水化物是弱酸 解析:选C 由“X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素”,可推出X为H;由“Y元素的最高正价与最低负价的绝对值相等”,可推出Y为C或Si;由“Z的核电荷数是Y的2倍”,可推出Y为C,Z为Mg,结合“W的最外层电子数是其最内层电子数的3倍”,可推出W为S,从而进一步推出R为Cl。由同一周期主族元素从左到右原子半径依次减小可知,原子半径:Z(Mg)>W(S)>R(Cl),A项正确;元素的非金属性越强,形成的气态氢化物越稳定,故最简单氢化物的热稳定性:R(Cl)>W(S),B项正确;S与H形成的H2S中只含有共价键,S与Mg形成的MgS中只含有离子键,二者所含化学键的类型不同,C项错误;C的最高价氧化物对应的水化物是H2CO3,H2CO3属于弱酸,D项正确。 13.室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是( ) A.M点所示溶液中c(NH)+c(NH3·H2O)=c(Cl-) B.N点所示溶液中c(NH)>c(Cl-) C.Q点消耗盐酸的体积等于氨水的体积 D.M点和N点所示溶液中水的电离程度相同 解析:选D 由于KW=c(H+)×c(OH-)=10-14,则溶液的pH+pOH=14,实线为pH曲线,虚线为pOH曲线,作垂直体积坐标轴线与pH曲线、pOH曲线交点为相应溶液中pH、pOH。Q点的pH=pOH,则Q点溶液呈中性。M点溶液呈碱性,为NH4Cl、NH3·H2O混合溶液,溶液中c(NH)+c(NH3•H2O)>c(Cl-),A错误;N点溶液呈酸性,溶液中c(H+)>c(OH-),结合电荷守恒c(NH)+c(H+)=c(Cl-)+c(OH-),可知c(NH)查看更多
相关文章
- 当前文档收益归属上传用户