- 2021-08-24 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省清远市方圆培训学校2020届高三化学模拟试题精练(十七) Word版含答案
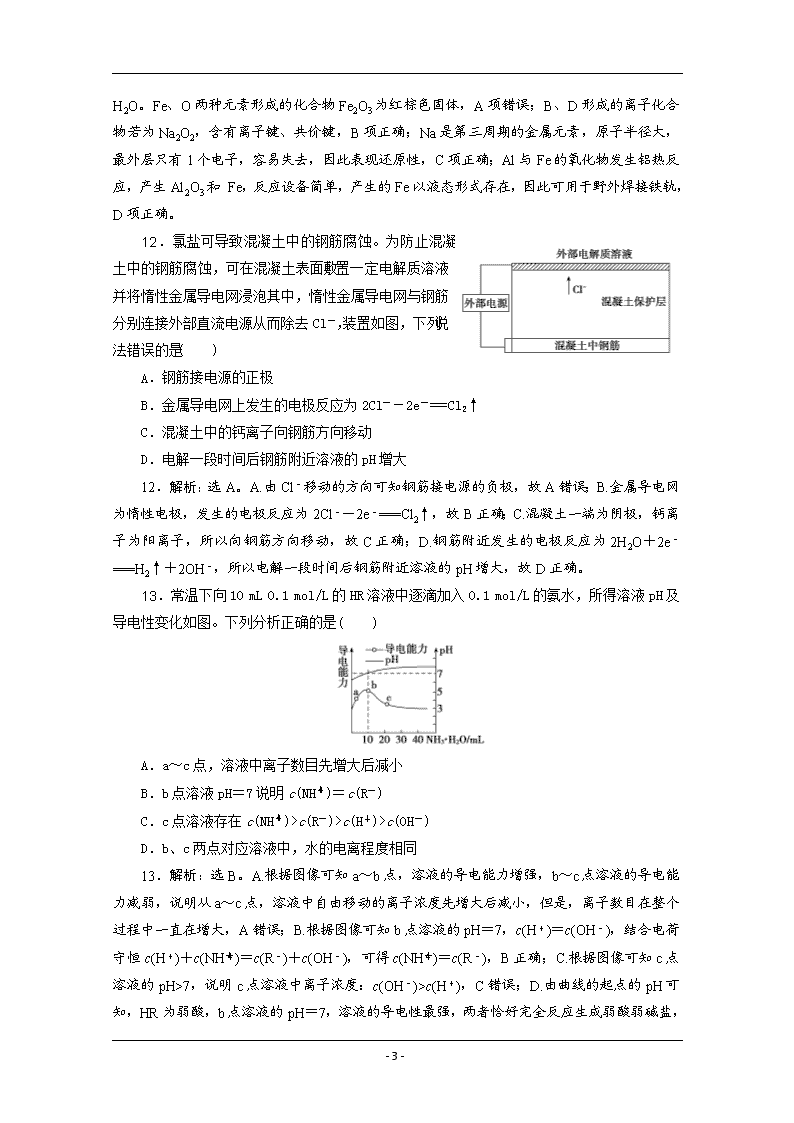
广东省清远市方圆培训学校2020届 化学模拟试题精练(十七) (考试用时:50分钟 试卷满分:100分) 一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.下列对有关文献的理解错误的是( ) A. 《天工开物》记载制造青瓦“窑泥周寒其孔,浇水转釉”,红瓦转化为青瓦的原因是Fe2O3转化为其他铁的氧化物 B.《物理小识》记载“青矾”(绿矾)厂气熏人,衣服当之易烂,栽木不没,“气”凝即得 “矾油”。青矾厂气是CO 和CO2 C.《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作时如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是醋酸亚铁 D.《本草经集注》对“消石”的注解如下:“……如握雪不冰。强烧之,紫青烟起,仍成灰……”这里的“消石”指的是硝酸钾 7.解析:选B。“瓦”属于传统无机非金属材料,主要成分为硅酸盐,红瓦中含有氧化铁,浇水后,氧化铁转化为其他铁的氧化物,红瓦转化为青瓦,A正确;这里所说的“青矾厂气”,指煅烧硫酸亚铁(FeSO4·7H2O)后产生的三氧化硫和二氧化硫,这类气体遇水或湿空气,会生成硫酸、亚硫酸或具有腐蚀性的酸雾,B错误;醋中含有醋酸,与铁反应生成醋酸亚铁和氢气,因此铁华粉是指醋酸亚铁,C正确;硝酸钾是白色固体,硝酸钾强烧时火焰呈紫色, D正确;故选B。 8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( ) A.常温常压下,3.2 g肼(N2H4)中含有的共价键数目为0.4NA B.标准状况下,4.48 L CO2 和N2O的混合气体中含有的电子数为4.4NA C.0.5 L 0.5 mol·L-1醋酸溶液中含有的分子数目小于0.25NA D.常温常压下,NaH 与水反应产生2 g氢气时,转移电子数为2NA 8.解析:选B。A.3.2 g肼(N2H4)的物质的量为3.2 g÷32 g/mol=0.1 mol,其分子结构中除了含有4个N-H键外,还含有1个N—N键,所以3.2 g肼(N2H4)中含有的共价键数目为0.5NA,故A错误;B.标准状况下,4.48 L CO2和N2O混合气体的物质的量为0.2 mol,而每个CO2分子和N2O分子均含有22个电子,则所含电子总数为4.4NA,故B正确;C.醋酸溶液中除了醋酸分子外,还含有水分子,所以该醋酸溶液中含有的分子数目大于0.25NA,故C错误;D.NaH与水反应的化学方程式为NaH+H2O===NaOH+H2↑,由反应方程式可知,当反应产生2 g氢气时,转移电子的物质的量为1 mol,粒子数为NA,故D错误。 9.设NA为阿伏加德罗常数的值。下列有关叙述正确的是( ) - 14 - A.1 mol甲醇中含有的共价键数为4NA B.1 mol氯气分别与铁和铝完全反应时转移的电子数均为3NA C.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g D.1 mol CH3COONa 和少量CH3COOH溶于水所得中性溶液中,CH3COO-的数目为NA 9.解析:选D。1 mol甲醇中含有的共价键数为5NA,A项错误;1 mol氯气分别与铁和铝反应时,氯元素化合价由0变为-1,所以1 mol氯气分别与铁和铝完全反应时转移的电子数均为2NA,B项错误;粗铜中含有杂质铁、锌等,所以电路中转移的电子数为0.2NA时,阳极不一定减少6.4 g,C项错误;根据电荷守恒,1 mol CH3COONa和少量CH3COOH溶于水中,则n(CH3COO-)+n(OH-)=n(Na+)+n(H+),溶液呈中性,则n(OH-)=n(H+),所以n(CH3COO-)=n(Na+)=1 mol,D项正确。 10.立体烷烃中有一系列对称结构的烷烃,如:(正四面体烷C4H4)、(棱晶烷C6H6)、(立方烷C8H8)等,下列有关说法错误的是( ) A.以此类推分子式为C12H12的立体烷烃的结构应为正六棱柱 B.上述一系列物质互为同系物,它们的通式为C2nH2n(n≥2) C.棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物都有三种 D.苯乙烯()、环辛四烯()与立方烷属于同分异构体 10.解析:选B。A.由题意可以推测分子式为C12H12的立体烷烃的结构应为正六棱柱,故A正确;B.该系列有机物质的通式为C2nH2n(n≥2),但它们不是同系物,故B错误;C.棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物都有三种,故C正确;D.苯乙烯、环辛四烯()与立方烷分子式相同,都为C8H8,但结构不同,属于同分异构体,故D正确。 11.已知A、B、C、D为原子序数依次增大的短周期元素,E为地壳中含量最高的过渡金属元素。A与D同主族,B与C同周期,且C与D的原子序数之和为20,C单质能与无色无味液体m反应置换出B单质,D单质也能与m反应置换出A单质,A、B、C均能与D形成离子化合物。下列说法错误的是( ) A.B、E两元素的形成的化合物都为黑色固体 B.B、D形成的离子化合物可能含有共价键 C.D的单质只有还原性,没有氧化性 D.工业上可以用铝热法制取金属E用于野外焊接铁轨 11.解析: - 14 - 选A。由题中信息可知,A为H,B为O,C为F,D为Na,E为Fe,m是H2O。Fe、O两种元素形成的化合物Fe2O3为红棕色固体,A项错误;B、D形成的离子化合物若为Na2O2,含有离子键、共价键,B项正确;Na是第三周期的金属元素,原子半径大,最外层只有1个电子,容易失去,因此表现还原性,C项正确;Al与Fe的氧化物发生铝热反应,产生Al2O3和 Fe,反应设备简单,产生的Fe以液态形式存在,因此可用于野外焊接铁轨,D项正确。 12.氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是( ) A.钢筋接电源的正极 B.金属导电网上发生的电极反应为2Cl--2e-===Cl2↑ C.混凝土中的钙离子向钢筋方向移动 D.电解一段时间后钢筋附近溶液的pH增大 12.解析:选A。A.由Cl-移动的方向可知钢筋接电源的负极,故A错误;B.金属导电网为惰性电极,发生的电极反应为2Cl--2e-===Cl2↑,故B正确;C.混凝土一端为阴极,钙离子为阳离子,所以向钢筋方向移动,故C正确;D.钢筋附近发生的电极反应为2H2O+2e-===H2↑+2OH-,所以电解一段时间后钢筋附近溶液的pH增大,故D正确。 13.常温下向10 mL 0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是( ) A.a~c点,溶液中离子数目先增大后减小 B.b点溶液pH=7说明c(NH)=c(R-) C.c点溶液存在c(NH)>c(R-)>c(H+)>c(OH-) D.b、c两点对应溶液中,水的电离程度相同 13.解析:选B。A.根据图像可知a~b点,溶液的导电能力增强,b~c点溶液的导电能力减弱,说明从a~c点,溶液中自由移动的离子浓度先增大后减小,但是,离子数目在整个过程中一直在增大,A错误;B.根据图像可知b点溶液的pH=7,c(H+)=c(OH-),结合电荷守恒c(H+)+c(NH)=c(R-)+c(OH-),可得c(NH)=c(R-),B正确;C.根据图像可知c点溶液的pH>7,说明c点溶液中离子浓度:c(OH-)>c(H+ - 14 - ),C错误;D.由曲线的起点的pH可知,HR为弱酸,b点溶液的pH=7,溶液的导电性最强,两者恰好完全反应生成弱酸弱碱盐,该盐水解促进水的电离;而c点溶液显碱性,说明氨水过量,氨水电离产生OH-会抑制水的电离,使水的电离程度减小,所以水的电离程度:b>c,D错误。 选 择 题 答 题 栏 题号 7 8 9 10 11 12 13 答案 二、非选择题(共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。) (一)必考题:共43分。 26.(14分)NaClO2常用来漂白织物,其漂白能力是漂白粉的4~5倍,NaClO2也是一种重要的杀菌消毒剂。工业上生产NaClO2的一种工艺流程如图所示: (1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为________________________________________________________________________。 (2)反应结束后,向ClO2发生器中通入一定量空气,目的是_______________________。 (3)吸收器中发生反应的化学方程式为______________________________。吸收器中要用冷的NaOH溶液和H2O2溶液吸收CO2,原因是________________________________________。 (4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是_________(填化学式),阴极的电极反应式为_________________________。 (5)相同条件下,1 mol NaClO2与_____________g Cl2的氧化能力相当。 26.解析:(1)NaClO3和SO2、H2SO4反应生成ClO2和NaHSO4,化学方程式为2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4,反应的离子方程式为2ClO+SO2===2ClO2+SO。(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收。(3)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,反应的化学方程式为2ClO2+2NaOH+H2O2===2NaClO2+O2+2H2O,为了提高ClO2的利用率及防止H2O2分解,反应温度不能过高。(4)阳极:2Cl--2e-===Cl2↑,阳极的电解产物是Cl2,阴极:ClO2+e-===ClO。(5)NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,依据电子转移数目相等,相同条件下,1 mol NaClO2与2 mol Cl2的氧化能力相当,所以氯气的质量为142 g。 答案:(1)2ClO+SO2===2ClO2+SO (2)将ClO2赶入吸收器,确保其被充分吸收 (3)2ClO2+2NaOH+H2O2===2NaClO2+O2+2H2O 温度过高,H2O2分解增多,ClO2逸出加快,不利于ClO2的吸收 (4)Cl2 ClO2+e-===ClO (5)142 - 14 - 27.(15分)氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390 ℃,沸点是430 ℃,溶于冷水,遇热水则强烈水解。在380~400 ℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题: (1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填字母)。 A.浓氨水、CaO B.NH4Cl固体、Ca(OH)2固体 C.浓氨水 D.NH4NO3固体、NaOH固体 (2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处字母),装置A的作用是__________________________。 (3)装置C中仪器的名称是___________,盛装的试剂是_____________。实验开始后,向X中通入NH3与加热仪器X的先后顺序为_____________。 (4)实验室还可用浓氨水与固体NaOH混合制备氨气,但多次实验表明,此方法收集到的NH3量总是比理论值低许多,其最可能的原因是____________________________________。 (5)氨基锂能与热水反应生成LiOH与一种气体,请推测该气体的成分并用实验验证你的结论:________________________________________________________________________ ________________________________________________________________________。 27.解析:(1)因NH4NO3受热或撞击易发生爆炸,故不能用NH4NO3固体、NaOH固体制备NH3;(2)因LiNH2能与水反应,故进入B中的氨气应该是干燥的,又因为氨气无法在B中消耗完且空气中水蒸气也可以逆向进入B,因氨气溶解时可能会产生倒吸现象,故相应的连接顺序为efcdhga;装置A中盛放浓硫酸,用于吸收氨气,及防止空气中的水蒸气进入B中;(3)装置C用于干燥氨气,可以使用碱性干燥剂;由于Li能与空气中氧气反应,故要先通入一段时间的氨气,排尽装置内的空气;(4)因氨气属于易溶于水的气体,故它在溶液中生成时,溶液中会溶解有相当多的氨气,从而导致进入B中的氨气量比理论值小许多;(5)由LiNH2+H2O===LiOH+NH3推测,气体产物是氨气,可用红色石蕊试纸检测该气体。 答案:(1)D (2)efcdhga 盛放浓硫酸,用于吸收氨气,及防止空气中的水蒸气进入B中 (3)干燥管 碱石灰 先通氨气再加热 (4)因氨气属于易溶于水的气体,故它在溶液中生成时,溶液中会溶解有相当多的氨气,故从而导致进入B中的氨气量比理论值小许多 (5)该气体为氨气,取少量试样放入试管中并加入适量热水,再将湿润的红色石蕊试纸靠近试管口,试纸变蓝 - 14 - 28.(14分)汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应: ①N2(g)+O2(g)2NO(g) ②2NO(g)+O2(g)2NO2(g) ③NO2(g)+CO(g)CO2(g)+NO(g) 弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题: (1)请根据下表数据填空:N2(g)+O2(g)2NO(g) ΔH=______________。 物质 N2 O2 NO 能量(kJ) 946 497 811.25 (断开1 mol物质中化学键所需要的能量) (2)实验测得反应2NO(g)+O2(g)2NO2(g) ΔH<0的即时反应速率满足以下关系式: v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响 ①温度为T1时,在1 L的恒容密闭容器中,投入0.6 mol NO和0.3 mol O2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_________ T2 (填“大于”“小于”或“等于”)。 ②研究发现该反应按如下步骤进行: 第一步:NO+NON2O2 快速平衡 第二步:N2O2+O22NO2 慢反应 其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2)。下列叙述正确的是________。 A.同一温度下,平衡时第一步反应的越大反应正向程度越大 B.第二步反应速率低,因而转化率也低 C.第二步的活化能比第一步的活化能低 D.整个反应的速率由第二步反应速率决定 (3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为2NO2(g)+4CO(g)===4CO2(g)+N2(g) ΔH<0 某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示: 时间/min 0 2 4 6 8 10 12 压强/kPa 75 73.4 71.95 70.7 69.7 68.75 68.75 回答下列问题: ①在此温度下,反应的平衡常数Kp=_____________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡____________(填“右移”或“左移”或“不移动”); ②若将温度降低,再次平衡后,与原平衡相比体系压强p(总)如何变化?_________(填“增大”“减小”或“不变”),原因是_______________________。 - 14 - 28.解析:(1)计算出①N2(g)+O2(g)===2NO(g)的ΔH=E(反应物键能)-E(生成物键能)=(946+497-811.25×2) kJ/mol=-179.5 kJ/mol; (2)①温度为T1时:2NO(g)+O2(g)2NO2(g) 开始(mol/L) 0.6 0.3 0 转化(mol/L) 0.2 0.1 0.2 平衡(mol/L) 0.4 0.2 0.2 则温度为T1时,平衡常数K1==1.25,由于平衡时v正=v逆,不难推出平衡常数等于速率常数之比,即:K1==1.25;温度为T2时,该反应存在K2==1,K2查看更多
相关文章
- 当前文档收益归属上传用户