- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版化学能与热能
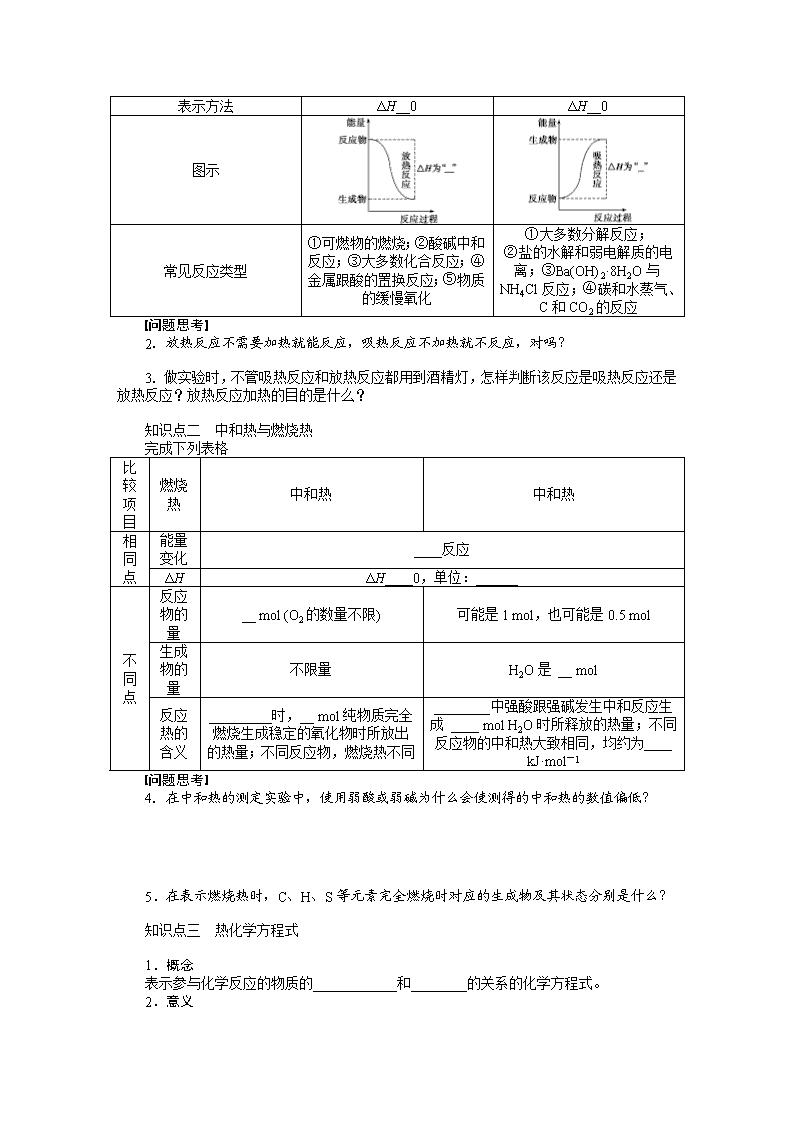
第八章 化学反应中的能量变化 电化学 学案36 化学反应与能量变化 [考纲要求] 1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 知识点一 化学反应的焓变 1.化学反应中的能量变化 (1)化学反应中的两大变化:________变化和__________变化。 (2)化学反应中的两大守恒:________守恒和__________守恒。 (3)化学反应中的能量转化形式:________、光能、电能等。通常主要表现为________的变化。 2.焓变 反应热 (1)定义:在________条件下进行的反应的________。 (2)符号:________。 (3)单位:__________或__________。 (4)化学键与化学反应中能量变化的关系 发生化学反应时,断开反应物的化学键要________能量,形成生成物的化学键要________能量,这两个过程中的能量________,因此化学反应中必然伴随着能量的变化。即 迷津指点 ①吸热反应完成后体系能量增加,故ΔH>0,为正值。放热反应完成后体系能量减少,故ΔH<0,为负值。 ②比较反应热(ΔH)的大小时,不要忽视“+”、“-”号。放热越多,ΔH就越小。 问题思考 1.同质量的硫粉在空气中燃烧和在纯氧中燃烧,哪一个放出的热量多,为什么? 3.放热反应和吸热反应 放热反应 吸热反应 定义 ________热量的化学反应 ________热量的化学反应 形成原因 反应物具有的总能量____生成物具有的总能量 反应物具有的总能量____生成物具有的总能量 与化学键 的关系 生成物成键时释放的总能量____反应物断键时吸收的总能量 生成物成键时释放的总能量____反应物断键时吸收的总能量 表示方法 ΔH__0 ΔH__0 图示 常见反应类型 ①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化 ①大多数分解反应; ②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应 问题思考 2.放热反应不需要加热就能反应,吸热反应不加热就不反应,对吗? 3.做实验时,不管吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么? 知识点二 中和热与燃烧热 完成下列表格 比较项目 燃烧热 中和热 中和热 相同点 能量变化 ____反应 ΔH ΔH____0,单位:______ 不同点 反应物的量 __ mol (O2的数量不限) 可能是1 mol,也可能是0.5 mol 生成物的量 不限量 H2O是 __ mol 反应热的含义 _________时,__ mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;不同反应物,燃烧热不同 ________中强酸跟强碱发生中和反应生成 ____ mol H2O时所释放的热量;不同反应物的中和热大致相同,均约为____ kJ·mol-1 问题思考 4.在中和热的测定实验中,使用弱酸或弱碱为什么会使测得的中和热的数值偏低? 5.在表示燃烧热时,C、H、S等元素完全燃烧时对应的生成物及其状态分别是什么? 知识点三 热化学方程式 1.概念 表示参与化学反应的物质的____________和________的关系的化学方程式。 2.意义 表明了化学反应中的________变化和________变化。 如:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 表示:2 mol氢气和1 mol氧气反应生成2 mol液态水时放出571.6 kJ的热量。 3.书写 (1)注明反应条件:反应热与测定条件(温度、压强等)有关。绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。 (2)注明物质状态:常用____、____、____、____分别表示固体、液体、气体、溶液。 (3)注意符号单位:ΔH应包括“+”或“-”、数字和单位(kJ·mol-1)。 (4)注意守恒关系:①原子守恒和得失电子守恒;②能量守恒。(ΔH与化学计量数相对应) (5)注意特殊反应: ①表示中和热的热化学方程式中,产物H2O的系数必为____。 ②表示燃烧热的热化学方程式中,可燃物的系数必为____,且燃烧产物应为________________。 (6)区别普通方程式:一般不注“↑”、“↓”以及“点燃”、“加热”等。 一、热化学方程式的书写 1.书写热化学方程式时,一定要注明反应条件吗? 2.物质的聚集状态与ΔH有什么联系? 3.热化学方程式中的化学计量数表示的意义是什么?使用时需注意什么问题? 典例导悟1 (2009·四川理综,9)25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( ) A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1 B.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 C.C8H18(l)+O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1 D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1 听课记录: 二、反应热大小的比较 1.比较ΔH的大小时需带正负号吗? 2.怎样比较两个反应的ΔH大小? (1)同一反应,生成物状态不同时 A(g)+B(g)===C(g) ΔH1<0 A(g)+B(g)===C(l) ΔH2<0 因为C(g)===C(l) ΔH3____, 则ΔH3=__________,ΔH2____ΔH1。 (2)同一反应,反应物状态不同时 S(g)+O2(g)===SO2(g) ΔH1<0 S(s)+O2(g)===SO2(g) ΔH2<0 ΔH2+ΔH3=____,则ΔH3=____________,又ΔH3________,所以ΔH1____ΔH2。 (3)两个有联系的不同反应相比 C(s)+O2(g)===CO2(g) ΔH1<0 C(s)+O2(g)===CO(g) ΔH2<0 根据常识可知CO(g)+O2(g)===CO2(g) ΔH3<0 又因为ΔH2+ΔH3=____,所以ΔH2____ΔH1。 典例导悟2 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( ) ①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2 ②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4 ③H2(g)+O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6 ④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8 A.① B.④ C.②③④ D.①②③ 听课记录: 1.判断正误 (1)A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1( ) B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1( ) (2010·浙江理综-12A、B) (2)化学反应必然伴随着能量的变化( ) (2009·上海-5D) (3)1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热( ) (2008·四川理综-7D) 2.(2011·北京理综,10)25 ℃、101 kPa下: ①2Na(s)+O2(g)===Na2O(s) ΔH1=-414 kJ·mol-1 ②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ·mol-1 下列说法正确的是( ) A.①和②产物的阴、阳离子个数比不相等 B.①和②生成等物质的量的产物,转移电子数不同 C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ·mol-1 3.(2011·上海,3)据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( ) 题组一 化学反应的热效应 1.(2011·西宁质检)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1 ②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1 下列说法正确的是( ) A.CH3OH的燃烧热为192.9 kJ·mol-1 B.反应①中的能量变化如右图所示 C.CH3OH转变成H2的过程一定要吸收能量 D.根据②推知反应CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 2.(2011·贵阳月考)下列说法中正确的是( ) A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0 D.ΔH的大小与热化学方程式的计量数无关 3.已知某反应A(g)+B(g)C(g)+D(g),过 程中的能量变化如图所示,回答下列问题。 (1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。 (2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH______(填“增大”、“减小”或“不变”)。 题组二 反应热大小的比较 4.已知一定温度下合成氨反应: N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1 在相同温度,相同体积的密闭容器中进行如下实验: ①通入1 mol N2和3 mol H2达到平衡时放热为Q1; ②通入2 mol N2和6 mol H2达到平衡时放热为Q2。 则下列关系正确的是( ) A.Q2=2Q1 B.Q1>Q2/2 C.Q1<Q2<184.8 kJ D.Q1=Q2<92.4 kJ 5.下列说法或表示正确的是( ) A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 B.由单质A转化为单质B时ΔH=+119 kJ·mol-1可知单质B比单质A稳定 C.稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ D.在101 kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,则H2在101 kPa时的燃烧热为571.6 kJ·mol-1 题组三 热化学方程式 6.(2011·沈阳质检)下列热化学方程式中ΔH的绝对值能表示可燃物的燃烧热的是( ) A.H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1 B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 D.CO(g)+1/2O2(g)===CO2(g) ΔH=-283 kJ·mol-1 7.(2009·重庆理综,12)下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热) D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) 题号 1 2 4 5 6 7 答案 题组四 综合探究 8.化学键的键能是指气态原子间形成1 mol化学键时释放的能量。如H(g)+I(g)―→H—I(g) ΔH=-297 kJ·mol-1,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。一个化学反应一般都有旧化学键的断裂和新化学键的形成。下表是一些键的键能的数据(kJ·mol-1): 键能 (kJ·mol-1) 键能 (kJ·mol-1) H—H 436 S===S 255 C—Cl 330 Cl—Cl 243 H—S 339 C—I 218 H—Cl 432 C—F 427 H—F 565 H—O 464 C—O 347 回答下列问题: (1)由表中数据能否得出这样的结论: ①半径越小的原子形成的共价键越牢固(即键能越大),________(填“能”或“不能”)。 ②非金属性越强的原子形成的共价键越牢固,________(填“能”或“不能”)。能否从数据中找出一些规律,请写出一条: ____________________________________ ________________________________________________________________________; 试预测C—Br键的键能范围 _________________________________________。 (2)由热化学方程式H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1,并结合表中数据可推知一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物的键能之间的关系是________________________________________________________________________, 由热化学方程式2H2(g)+S2(s)===2H2S(g) ΔH=-224.5 kJ·mol-1和表中数据可计算出1 mol S2(s)气化时将______(填“吸收”或“放出”)________kJ的热量。 学案36 化学反应与能量变化 【课前准备区】 知识点一 1.(1)物质 能量 (2)质量 能量 (3)热能 热量 2.(1)恒压 热效应 (2)ΔH (3)kJ/mol kJ·mol-1 (4)吸收 放出 不相等 吸热 E1 E2 > 放热 E1 E2 < 3. 放热反应 吸热反应 定义 放出热量的化学反应 吸收热量的化学反应 形成原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量 与化学键的关系 生成物成键时释放的总能量大于反应物断键时吸收的总能量 生成物成键时释放的总能量小于反应物断键时吸收的总能量 表示方法 ΔH<0 ΔH>0 图示 知识点二 比较项目 燃烧热 中和热 相同点 能量变化 放热反应 ΔH ΔH<0,单位:kJ·mol-1 不同点 反应物的量 1 mol (O2的数量不限) 可能是1 mol,也可能是0.5 mol 生成物的量 不限量 H2O是 1 mol 反应热的含义 25_℃、101_kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;不同反应物,燃烧热不同 稀溶液中强酸跟强碱发生中和反应生成 1 mol H2O时所释放的热量;不同反应物的中和热大致相同,均约为57.3 kJ·mol-1 知识点三 1.物质的量 反应热 2.物质 能量 3.(2)s l g aq (5)①1 ②1 稳定的氧化物 问题思考 1.在空气中燃烧放出的热量多,因在纯氧中燃烧火焰明亮,光能多,故热量少。 2.不正确。反应放热还是吸热,与反应物和生成物具有的能量有关,与加热与否无必然关系。例如红磷和O2生成P2O5需要加热,铵盐和碱不加热就能进行。 3.持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的是放热反应。放热反应加热目的一般是加快反应速率。 4.因为弱酸或弱碱的电离过程中会吸收一部分热量,从而使测得的结果偏低。 5.CO2(g)、H2O(l)、SO2(g) 【课堂活动区】 一、1.不一定。反应热ΔH与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明ΔH的测定条件。绝大多数ΔH是在25 ℃、101 kPa下测定的,可不注明温度和压强。 2.反应物和产物的聚集状态不同,反应热ΔH不同。因此,必须注明物质的聚集状态。这是因为: 3.(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。因此化学计量数可以是整数,也可以是分数。 (2)热化学方程式中的反应热是表示反应物完全反应时的热量变化,与反应是否可逆无关。方程式中化学式前面的化学计量数必须与ΔH相对应,即化学计量数与ΔH成正比。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。如: ①H2(g)+Cl2(g)===2HCl(g) ΔH1 ②H2(g)+Cl2(g)===HCl(g) ΔH2 ③2HCl(g)===H2(g)+Cl2(g) ΔH3 则有:ΔH1=2ΔH2=-ΔH3 二、1.比较吸、放热反应过程中,吸收或放出热量的多少时不考虑符号,但比较ΔH大小时,必须带正、负号比较,对放热反应,ΔH越小,放热越多;对吸热反应,ΔH越大,吸热越多。 2.(1)<0 ΔH2-ΔH1 < (2)ΔH1 ΔH1-ΔH2 <0 < (3)ΔH1 > 典例导悟 1.B [H2SO4与Ba(OH)2溶液反应,不仅生成了H2O还有BaSO4生成,因此A项放出的热量比57.3 kJ×2还多,A项错误;辛烷的燃烧热是指1 mol辛烷完全燃烧生成CO2气体和液态水时放出的热量是5 518 kJ,C、D项均错误。] 2.C [本题主要考查对“ΔH”的理解,明确“ΔH”既有“+”、“-”,又有数值大小。碳与氧气反应放热,即ΔH1<0,ΔH2<0,CO再与O2作用时又放热,所以ΔH1<ΔH2;等量的固态硫变为气态硫蒸气时吸收热量,故在与O2作用产生同样多的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。故本题答案为C。] 【课后练习区】 高考集训 1.(1)A.× 解析 H2O的状态应为液态。 B.× 解析 由等效平衡分析ΔH>-38.6 kJ·mol-1。 (2)√ (3)× 2.D [A项Na2O2中的阴离子是O,所以Na2O2中阳离子与阴离子的个数比为2∶1,与Na2O相同,故A错误;B项两种情况下生成等物质的量的生成物时转移的电子数相等,故B错误;C项温度升高后产物是Na2O2,故C错误;D项正确。] 3.B [本题从水分解过程中的能量变化入手,主要考查催化剂对化学反应的影响以及化学反应吸(放)热与能量变化的关系。水分解过程吸热,反应物的总能量小于生成物的总能量;加入催化剂,可以降低反应的活化能,B项正确。] 考点集训 1.D [A项中192.9 kJ·mol-1是反应②的热效应,而不是CH3OH的燃烧热,A错;B项中根据反应①的ΔH=+49.0 kJ·mol-1可知该反应为吸热反应,生成物的总能量应该大,B错;C项中从反应①和②看,前者是吸热的,后者是放热的,C错;根据反应②CH3OH为气态时ΔH=-192.9 kJ·mol-1,而当CH3OH为液态时ΔH应大于-192.9 kJ·mol-1,D正确。] 2.C [化学反应中一定有能量变化,A错误;B项中,ΔH=反应物的键能总和-生成物的键能总和,得ΔH<0,故为放热反应。] 3.(1)吸热 E1-E2 一定低 (2)减小 减小 不变 解析 (1)由于反应物吸收的能量大于产物放出的能量,所以该反应为吸热反应,吸热反应的焓变大于零,从图象中看出反应物的能量低,产物的能量高,该反应一定为吸热反应。 (2)催化剂只能改变化学反应的快慢,催化剂能降低化学反应的活化能来加快化学反应速率,对于可逆反应,催化剂能同等程度的降低正反应和逆反应的活化能。 4.C [热化学方程式表示已完成的数量关系,即1 mol N2(g)和3 mol H2(g)完全反应,放出92.4 kJ热量,而①中不完全反应,故Q1<92.4 kJ,因②相当于两个①的容器压缩而成,平衡正移,故Q2>2Q1,但Q2小于2×92.4 kJ,故C正确。] 5.A [选项A,硫燃烧时,固体的硫变为蒸气时,需要吸收热量,故等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多;选项B,单质A转化为单质B时吸热,故A具有的能量比B低,故A比B稳定;选项C,浓硫酸与水作用放出热量,故所测的中和热应大于57.3 kJ;选项D,燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所释放出的热量,由该热化学方程式可知,H2的燃烧热应为-285.8 kJ·mol-1。] 6.D [燃烧热指1 mol物质完全燃烧生成稳定氧化物时释放的能量,生成的水必须是液态,故B、C项错;A中不是与氧气的反应,故错。] 7.C [根据燃烧热的概念,生成的水应为液态,A项错;B项中反应放热,ΔH应为负值,B项错;D项中没表示聚集状态,D项错。] 8.(1)①不能 ②不能 与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强 218~330 kJ·mol-1 (2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差 吸收 4.5 解析 断裂化学键的难易与形成化学键的两个原子的性质有关,比较时要选择同一标准,否则不可比。依题意,C—Br键键能介于C—I、C—Cl键键能之间。查看更多