2019届一轮复习人教版盐类的水解学案(4)
第29讲 盐类的水解
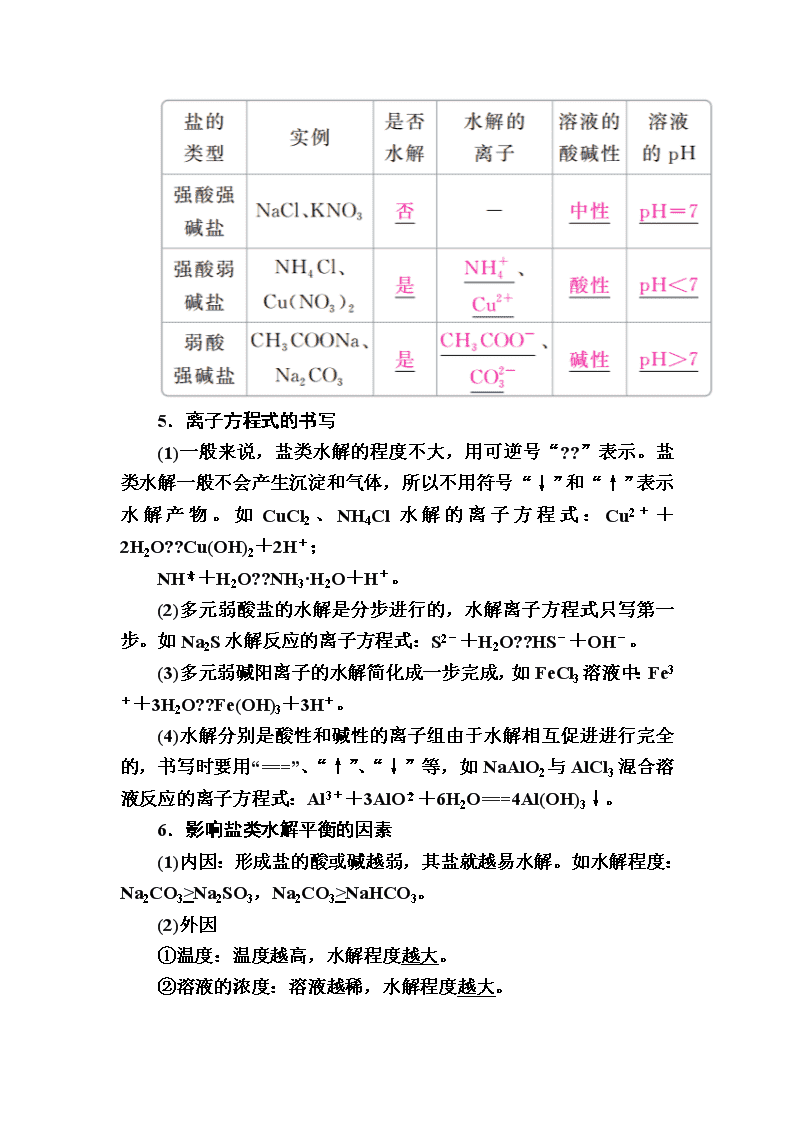
1.定义
在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.实质
3.特点
4.规律
有弱才水解,越弱越水解,谁强显谁性,同强显中性。
5.离子方程式的书写
(1)一般来说,盐类水解的程度不大,用可逆号“??”表示。盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。如CuCl2、NH4Cl水解的离子方程式:Cu2++2H2O??Cu(OH)2+2H+;
NH+H2O??NH3·H2O+H+。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式只写第一步。如Na2S水解反应的离子方程式:S2-+H2O??HS-+OH-。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl3溶液中:Fe3++3H2O??Fe(OH)3+3H+。
(4)水解分别是酸性和碱性的离子组由于水解相互促进进行完全的,书写时要用“===”、“↑”、“↓”等,如NaAlO2与AlCl3混合溶液反应的离子方程式:Al3++3AlO+6H2O===4Al(OH)3↓。
6.影响盐类水解平衡的因素
(1)内因:形成盐的酸或碱越弱,其盐就越易水解。如水解程度:Na2CO3>Na2SO3,Na2CO3>NaHCO3。
(2)外因
①温度:温度越高,水解程度越大。
②溶液的浓度:溶液越稀,水解程度越大。
7.盐类水解的应用
1.正误判断,正确的画“√”,错误的画“×”。
(1)酸式盐溶液一定呈酸性。( )
(2)能水解的盐溶液一定呈酸性或碱性,不可能呈中性。( )
(3)Na2CO3溶液显碱性的原因:CO+2H2O??H2CO3+2OH-。( )
(4)向Na2CO3溶液中加入少量Ca(OH)2固体,CO水解程度减小,pH减小。( )
(5)在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)。( )
(6)关于氯化铵溶液,加水稀释时,的值减小。( )
(7)降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动。( )
(8)通入适量的HCl气体使FeCl3溶液中增大。( )
答案 (1)× (2)× (3)× (4)× (5)√ (6)√
(7)× (8)×
2.教材改编题
(据人教选修四P59 T1)下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O??H3O++Cl-
②AlCl3+3H2O===Al(OH)3+3HCl
③CO+2H2O??H2CO3+2OH-
④碳酸氢钠溶液:HCO+H2O??CO+H3O+
⑤HS-的水解:HS-+H2O??S2-+H3O+
⑥NaAlO2与NaHCO3溶液混合:AlO+HCO+H2O===Al(OH)3↓+CO
A.①②③④ B.①②③⑥
C.②③⑤⑥ D.全部
答案 D
解析 ①④⑤是电离方程式且①应用“===”;②是水解反应方程式,但应用“??”;③的水解方程式错误,应分步进行;⑥是化学反应方程式,不属于双水解反应。
考点1 盐类水解的实质及规律
典例1 (2015·海南高考)0.1 mol下列气体分别与1 L 0.1 mol·L-1 的NaOH溶液反应,形成的溶液pH最小的是( )
A.NO2 B.SO2
C.SO3 D.CO2
解析 A项,NO2和NaOH溶液发生反应:2NO2+2NaOH===NaNO3+NaNO2+H2O,二者恰好反应得到的是NaNO3和NaNO2的混合溶液,NaNO2是强碱弱酸盐,水溶液显碱性;B项,发生反应:SO2+NaOH===NaHSO3,该物质是强碱弱酸盐,由于HSO电离大于水解,所以溶液显酸性;C项,发生反应:SO3+
NaOH===NaHSO4,该盐是强酸强碱的酸式盐,完全电离出H+,溶液显酸性,相当于一元强酸,所以酸性比NaHSO3强;D项,发生反应:CO2+NaOH===NaHCO3,该物质是强碱弱酸盐,由于HCO电离小于水解作用,所以溶液显碱性。因此溶液的酸性最强的是NaHSO4,溶液的酸性越强,pH越小。
答案 C
名师精讲
盐类水解的规律
(1)“谁弱谁水解,越弱越水解,谁强显谁性。”如酸性:HCN
CH3COONa。
(2)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液显碱性。如NaHCO3溶液中:HCO??H++CO(次要),HCO+H2O??H2CO3+OH-(主要)。
②若电离程度大于水解程度,溶液显酸性。如NaHSO3溶液中:HSO??H++SO (主要),HSO+H2O??H2SO3+OH-(次要)。
(3)相同条件下的水解程度:正盐>相应酸式盐,如CO>HCO。
(4)相互促进水解的盐>单独水解的盐>水解相互抑制的盐。如NH的水解程度:(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2。
1.常温下,0.1 mol·L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是( )
A.HX、HY、HZ的酸性依次增强
B.离子浓度:c(Z-)>c(Y-)>c(X-)
C.电离常数:K(HZ)>K(HY)
D.c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ)
答案 D
解析 NaX、NaY、NaZ的pH分别为7、8、9,则HX是强酸,HY、HZ是弱酸,再根据水解规律可知,HY的酸性强于HZ的酸性。所以酸性:HX>HY>HZ,故A、C错误;根据“越弱越水解”可知B错误;D选项是正确的物料守恒关系式。
2.(1)已知酸性:HNO2>HCOOH>H2CO3>HCN>HCO,则相同条件下,相同浓度的NaNO2、HCOONa、Na2CO3、NaCN、NaHCO3五种盐溶液的碱性强弱顺序为________________________________________________________________________。
(2)已知HSO的电离程度大于水解程度,HCO的电离程度小于水解程度,则同浓度的NaHSO4、NaHCO3、NaHSO3溶液pH大小顺序为____________________。
(3)同浓度的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2、NH4Cl、NH4HSO4、NH4HCO3溶液中c(NH)的大小顺序为________________________。
答案 (1)Na2CO3>NaCN>NaHCO3>HCOONa>NaNO2
(2)NaHCO3>NaHSO3>NaHSO4
(3)(NH4)2Fe(SO4)2>(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl>NH4HCO3
解析 酸越弱,对应盐的水解程度越大,碱性越强。
考点2 盐类水解的影响因素
典例2 CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,能使比值一定减小的是( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸 ⑥降温
A.只有①③ B.①③④
C.②④⑤⑥ D.③④⑥
解析 ①加入固体NaOH,c(Na+)与c(CH3COO-)都增大,但
c(Na+)增大幅度较大,则比值减小,符合;②加入固体KOH,抑制水解,则c(CH3COO-)增大,而c(Na+)不变,则比值增大,不符合;③加入固体NaHSO4,水解平衡向右移动,c(Na+)增大,c(CH3COO-)减小,则比值减小,符合;④加入固体CH3COONa,浓度增大,水解程度降低,则比值增大,不符合;⑤加入冰醋酸,c(CH3COO-)增大,则比值增大,不符合;⑥水解是吸热反应,降温,平衡逆向进行,醋酸根离子浓度增大,则比值增大,不符合。
答案 A
名师精讲
从定性、定量两角度理解盐类水解
(1)盐类水解受温度、浓度、溶液的酸碱性等因素的影响,以FeCl3水解为例,当改变条件如升温、通入HCl气体、加水、加NaHCO3溶液等时,平衡均会发生移动。
(2)水解平衡常数(Kh)只受温度的影响,它与Ka(或Kb)、Kw的定量关系为Ka·Kh=Kw或Kb·Kh=Kw。
3.已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO+H2O??H2SO3+OH-' ①
HSO??H++SO ②
向0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO
)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO)+c(OH-)+c(SO)
C.加入少量NaOH溶液,、的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO)>c(H+)=c(OH-)
答案 C
解析 加入金属钠,钠与溶液中的H+反应,使平衡②右移,生成的NaOH使平衡①左移,但溶液中c(HSO)减小,A错;根据电荷守恒式c(H+)+c(Na+)=c(HSO)+c(OH-)+2c(SO)可知B错;加入少量NaOH溶液后,平衡①左移,平衡②右移,故增大,溶液中的c(OH-)增大,c(H+)减小,故变大,C正确;根据电荷守恒式,当溶液呈中性时,则:[c(NH)+c(Na+)]=c(SO)+c(HSO)>c(OH-)=c(H+),D项错误。
4.25 ℃时,H2SO3??HSO+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
答案 1×10-12 增大
解析 H2SO3的电离常数表达式为Ka=,NaHSO3的水解反应的平衡常数Kh=====1×10-12。由Kh=得
eq f(c(H2SO3),c(HSOoal(-,3)))=,加入I2后,HSO被氧化为H2SO4,c(H+)增大,c(OH-)减小,Kh不变,所以增大。
考点3 盐类水解的应用
典例3 下列有关说法正确的是( )
A.(2016·全国卷Ⅱ)由MgCl2溶液制备无水MgCl2,将MgCl2溶液加热蒸干
B.(2016·全国卷Ⅰ)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
C.(2016·天津高考)室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH+2H2O===NH3·H2O+H3O+
D.(全国卷Ⅰ)AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
解析 由MgCl2溶液制备无水MgCl2时,先使MgCl2从溶液中结晶析出MgCl2·6H2O,然后MgCl2·6H2O在HCl气流中加热,防止MgCl2发生水解,A错误;FeCl3易发生水解,故配制FeCl3溶液时,将其固体溶于较浓的盐酸中,再加水稀释,以抑制FeCl3的水解,B正确;盐类水解一般是微弱的,书写离子方程式时应使用“??”,C错误;水解方程式分别为AlCl3+3H2O??Al(OH)3+3HCl,Al2(SO4)3+6H2O??2Al(OH)3+3H2SO4,加热促进水解,由于盐酸为挥发性酸,硫酸为难挥发性酸,故前者最终产物为Al2O3,后者最终产物为Al2(SO4)3,D错误。
答案 B
名师精讲
1.盐溶液蒸干灼烧时所得产物的类型判断
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)CuSO4(s);Al2(SO4)3(aq)Al2(SO4)3(s)。
盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,如AlCl3(aq)Al(OH)3Al2O3。
(2)酸根阴离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质。
(3)考虑盐受热时是否分解。
Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干灼烧后分别为Ca(HCO3)2―→
CaCO3(CaO);NaHCO3―→Na2CO3;KMnO4―→K2MnO4+MnO2;NH4Cl―→NH3↑+HCl↑。
(4)还原性盐在蒸干时会被O2氧化。
例如,Na2SO3(aq)Na2SO4(s)。
FeCl2(aq)Fe(OH)2(s)Fe(OH)3(s)Fe2O3。
2.因相互促进水解不能大量共存的离子组合
(1)Al3+与HCO、CO、AlO、SiO、HS-、S2-、ClO-。
(2)Fe3+与HCO、CO、AlO、SiO、ClO-。
(3)NH与SiO、AlO。
注意 ①NH与CH3COO-、HCO虽能发生双水解反应,但水解程度都不大,故能大量共存。②Fe3+在中性条件下已完全水解。
5.下列说法与盐的水解有关的是( )
①明矾可以作净水剂 ②实验室配制FeCl3溶液时,先将FeCl3溶于较浓的盐酸中,再稀释到所需浓度 ③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂 ④在NH4Cl溶液中加入金属镁会产生氢气 ⑤草木灰与铵态氮肥不能混合施用 ⑥实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞 ⑦纯碱溶液去油污
A.仅①③⑥ B.仅②③⑤
C.仅③④⑤ D.全部有关
答案 D
解析 ①明矾为硫酸铝钾的结晶水合物,Al3+可水解生成具有吸附性的Al(OH)3胶体,可用作净水剂,与水解有关;②FeCl3水解呈酸性,盐酸可抑制其水解,防止溶液浑浊,与水解有关;③NaHCO3和Al2(SO4)3可发生相互促进的水解反应生成CO2,可用于灭火,与水解有关;④NH4Cl水解呈酸性,加入镁可生成氢气,与水解有关;⑤草木灰中的CO与NH发生相互促进的水解反应,两者混合可降低肥效,与水解有关;⑥Na2CO3为强碱弱酸盐,水解呈碱性,不能用玻璃塞,与水解有关;⑦纯碱呈碱性,油污可在碱性条件下水解,与水解有关。
6.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。
将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是____________。
(3)本实验用加碱沉淀法能不能达到目的?________,原因是________________________________________________________________________。
(4)分析除去Fe3+的原理(结合离子方程式说明
)________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(5)加氧化剂的目的是________________________________________________________________________________________________________________________________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________,应如何操作?_______________________________________________ _________________________________________________________________________________________________。
答案 (1)C
(2)CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3]
(3)不能 加碱的同时也会使Cu2+生成Cu(OH)2沉淀
(4)溶液中Fe3+水解:Fe3++3H2O??Fe(OH)3+3H+,加入CuO[或Cu(OH)2等]能消耗溶液中的H+,使上述水解平衡向右移动,从而使Fe3+形成Fe(OH)3沉淀而除去
(5)将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
(6)不能 应在HCl气流中加热蒸发
解析 (1)除杂时不能引入新的杂质,只有H2O2符合要求。
(2)当CuCl2溶液中混有Fe3+时,可以利用Fe3+的水解:Fe3++3H2O??Fe(OH)3+3H+,加入CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3与溶液中的H+作用,使水解平衡右移,从而使Fe3+转化为Fe(OH)3沉淀而除去。
(3)若用加碱法使Fe3+沉淀,同时也必将使Cu2+沉淀,因此加碱沉淀不可行。
(6)为了抑制CuCl2水解,应在HCl气流中加热蒸发。
(建议用时:40分钟)
一、选择题(每题7分,共77分)
1.下列用途(现象)对应离子方程式的表示不正确的是( )
A.明矾用于净水:Al3++3H2O??Al(OH)3(胶体)+3H+
B.配制氯化铁溶液时先将氯化铁固体溶于盐酸中:Fe3++3H2O??Fe(OH)3+3H+
C.用纯碱清洗油污:CO+H2O??HCO+OH-
D.浓硫化钠溶液具有臭味:S2-+2H2O===H2S↑+2OH-
答案 D
解析 明矾水解产生Al(OH)3(胶体)具有吸附作用,水解方程式正确,A正确;氯化铁易水解,加入盐酸抑制其水解,B正确;碳酸钠水解产生氢氧根离子促使油脂水解,C正确;硫化钠分步水解产生硫化氢而有臭味,水解方程式应分步书写,且没有气体符号,使用可逆符号,D错误。
2.在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O??HS-+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入H2S,HS-浓度减小
C.升高温度,增大
D.加入NaOH固体,溶液pH减小
答案 C
解析 平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的,A错误;通入H2S,溶液中氢氧根离子浓度减小,使S2-+H2O??HS-+OH-正向移动,HS-浓度增大,B错误;水解反应是吸热反应,升温促进水解,平衡正向移动,c(S2-)减小,c(HS-)增大,所以增大,C正确;加入NaOH固体,溶液pH增大,D错误。
3.配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是( )
A.FeSO4(Fe) B.SnCl2(HCl)
C.FeCl3(HCl) D.NaAlO2(NaOH)
答案 A
解析 配制FeSO4时加入少量Fe粉目的是防止Fe2+被氧化,A错误;配制盐溶液时,为抑制盐的水解而加入酸或碱,但应注意不能引入杂质离子,加入的酸应是与盐中的酸根对应的强酸,如配制FeCl3溶液加盐酸;加入的碱应是与盐中的阳离子对应的强碱,如配制Na2S溶液要加NaOH溶液。
4.(2017·合肥模拟)等物质的量浓度、等体积的下列溶液中:①H2CO3;②Na2CO3;③NaHCO3;④NH4HCO3;⑤(NH4)2CO3。
下列关系或者说法正确的是( )
A.c(CO)的大小关系:②>⑤>③>④>①
B.c(HCO)的大小关系:④>③>⑤>②>①
C.将溶液蒸干灼烧只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
答案 A
解析 由于④中NH与HCO水解相互促进,故c(HCO)大小为③>④,B错误;将各溶液蒸干后①③④⑤都分解,得不到原来的物质,C错误;Na2CO3只能与盐酸反应,而与NaOH溶液不反应,D错误;NH与CO水解相互促进,c(CO)大小为②>⑤,HCO既水解又电离,水解程度大于电离程度,c(CO)大小为④<③<⑤<②,H2CO3是弱酸,二级电离Ka2很小,H2CO3中的c(CO)最小,A正确。
5.为了使Na2S溶液中的比值变小,可加入的物质是( )
A.适量盐酸 B.适量NaOH溶液
C.适量NH4Cl固体 D.适量KHS固体
答案 D
解析 由S2-+H2O??HS-+OH-知,要使比值减小,即使S2-
水解平衡向逆向移动即可。加入盐酸,会使得化学平衡正向移动,c(S2-)减小,则使得比值变大,A错误;加入适量的氢氧化钠溶液,会使c(Na+)增大,使得比值变大,B错误;加入适量NH4Cl固体,NH4Cl水解显酸性,与S2-的水解相互促进,造成S2-水解程度增大,使得S2-的物质的量减小,而Na+的物质的量不变,则的比值增大,C错误;加入适量KHS固体,抑制了硫离子的水解,硫离子的浓度会增大,而c(Na+)不变,所以该比值变小,D正确。
6.(2017·甘肃张掖模拟)25 ℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是( )
A.对于该溶液一定存在pH≥7
B.若c(OH-)>c(H+),则溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C.若溶液中c(A-)=c(Na+),则溶液一定呈中性
D.若溶质为NaA,则溶液中一定存在:c(Na+)>c(A-)>c(OH-)>c(H+)
答案 C
解析 若是较多的酸溶液和少量的盐溶液混合,则混合溶液显酸性,pH<7,A错误;若是氢氧化钠溶液和少量的盐溶液混合,则混合溶液显碱性,且混合溶液中,c(Na+)>c(OH-)>c(A-)>c(H+),B错误;根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),若溶液中c(A-)=c(Na+),则一定有c(H+)=c(OH-),即溶液一定呈中性,C正确;若NaA是强酸强碱盐,则c(A-)=c(Na+),D错误。
7.某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol·L-1 NaHCO3溶液,测其pH为9.7;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A.NaHCO3溶液呈碱性的原因是HCO的水解程度大于电离程度
B.加入CaCl2促进了HCO的水解
C.反应的离子方程式是2HCO+Ca2+===CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO)+2c(CO)+c(Cl-)
答案 B
解析 NaHCO3既能电离又能水解,水解显碱性,电离显酸性,NaHCO3溶液呈碱性的原因是HCO的水解程度大于电离程度,A正确;溶液中存在HCO??CO+H+,加入CaCl2消耗CO,促进HCO的电离,B错误;HCO与Ca2+生成CaCO3和H+,H+结合HCO生成H2CO3,则反应的离子方程式为2HCO+Ca2+===CaCO3↓+H2CO3,C正确;溶液中存在电荷守恒,c(Na+)+c(H+)+2c(Ca2+)=c(HCO)+2c(CO)+c(Cl-)+c(OH-),溶液的pH=7,c(H+)=c(OH-),c(Na+)+2c(Ca2+)=c(HCO)+2c(CO)+c(Cl-),D正确。
8.(2017·洛阳模拟)常温下,浓度均为0.1 mol·L-1的下列四种盐溶液,其pH测定如下表所示:
序号
①
②
③
④
溶液
CH3COONa
NaHCO3
Na2CO3
NaClO
pH
8.8
9.7
11.6
10.3
下列说法正确的是( )
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中,c(Na+)=c(CO)+c(HCO)+c(H2CO3)
答案 B
解析 四种盐溶液均促进了水的电离,水解显碱性,水解程度越大,pH越大,则四种溶液中,水的电离程度③>④>②>①,A错误;Na2CO3和NaHCO3溶液中都存在着H+、OH-、CO、
HCO、H2CO3、Na+、H2O,B正确;CH3COOH的酸性强于HClO,在浓度相等时,pH小的是CH3COOH,C错误;根据物料守恒,Na2CO3溶液中,c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3),D错误。
9.25 ℃时,物质的量浓度相等的NaHCO3、CH3COONa混合溶液中,下列有关说法或粒子浓度关系正确的是(Ka表示CH3COOH的电离平衡常数)( )
A.pH可能等于7
B.c(HCO)=c(CH3COO-)
C.c(OH-)=
D.c(HCO)+c(H2CO3)+c(CO)=c(CH3COOH)+c(CH3COO-)
答案 D
解析 物质的量浓度相等的NaHCO3、CH3COONa混合溶液中,由于HCO、CH3COO-的水解,混合液一定显示碱性,A错误;醋酸根离子的水解程度小于碳酸氢根离子,则溶液中一定满足:c(HCO)<c(CH3COO-),B错误;醋酸钠溶液中,醋酸根离子的水解平衡常数为Kh==,整理可得:c(OH-)=,C错误;根据混合液中的物料守恒可得:c(HCO)+c(H2CO3)+c(CO)=c(CH3COOH)+c(CH3COO-),D正确。
10.(2017·兰州实战)已知常温下浓度为0.1 mol·L-1的下列溶液的pH如下表所示:
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
下列有关说法正确的是( )
A.加热0.1 mol·L-1 NaClO溶液测其pH,pH小于9.7
B.0.1 mol·L-1 Na2CO3溶液中,存在关系:c(OH-)-c(H+)=c(HCO)+2c(H2CO3)
C.根据上表数据得出三种酸电离平衡常数大小关系为HF>HClO>H2CO3(一级电离平衡常数)
D.pH=2的HF溶液与pH=12的NaOH溶液以体积比1∶1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-)
答案 B
解析 弱酸根离子的水解为吸热反应,加热促进水解,故加热0.1 mol·L-1的NaClO溶液时,其pH>9.7,A错误;根据质子守恒知,B正确;根据“越弱越水解”可知对应的酸的酸性HF>HClO>HCO,酸性越强,酸的电离常数越大,故电离常数大小关系为HF>HClO>H2CO3(二级电离平衡常数),C错误;氢氟酸为弱酸,pH=2的HF溶液与pH=12的NaOH溶液等体积混合时,氢氟酸过量,溶液呈酸性,D错误。
11.25 ℃时,下列叙述正确的是( )
A.将pH=3的醋酸和pH=11的NaOH溶液等体积混合,pH>7
B.NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO)
C.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
D.KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同
答案 C
解析 pH=3的醋酸和pH=11的NaOH溶液等体积混合,醋酸过量,溶液显酸性,pH<7,A错误;反应后溶液中电荷守恒为c(NH)+c(H+)+c(Na+)=2c(SO)+c(OH-),pH=7,c(H+)=c(OH-),则c(NH)+c(Na+)=2c(SO),B错误;CH3COOH与CH3COONa混合溶液pH<7,c(H+)>c(OH-),CH3COOH的电离程度大于CH3
COO-的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),C正确;KNO3不影响水的电离,CH3COONH4促进水的电离,D错误。
二、非选择题(共23分)
12.(2017·天水模拟)(11分)电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式
电离平衡常数
HCN
K=4.9×10-10
CH3COOH
K=1.8×10-5
H2CO3
K1=4.4×10-7,K2=4.7×10-11
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为____________________________(填写序号)。
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________________________________________________ __________________。
(3)现有浓度为0.02 mol·L-1的HCN与0.01 mol·L-1 NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是________。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01 mol·L-1
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子方程式表示灭火的原理
________________________________________________________________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小_______________________________________________________ _________________;
电荷守恒表达式_________________________________ _______________________________________。
答案 (1)b>a>c
(2)NaCN+CO2+H2O===NaHCO3+HCN
(3)B、D
(4)Al3++3HCO===Al(OH)3↓+3CO2↑
(5)c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-)
c(HC2O)+2c(C2O)+c(OH-)=c(Na+)+c(H+)
解析 (1)由电离平衡常数:CH3COOH>H2CO3>HCN知,等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为Na2CO3>NaCN>CH3COONa。
(2)由电离平衡常数H2CO3>HCN>HCO知,NaCN和少量CO2反应生成NaHCO3、HCN,反应的化学方程式为NaCN+CO2+H2O===NaHCO3+HCN。
(3)将0.02 mol·L-1的HCN与0.01 mol·L-1的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度都为0.005 mol·L-1的NaCN、HCN,测得c(Na+)>c(CN-),根据电荷守恒可知:c(H+)<c(OH-),溶液呈碱性,A错误,B正确;溶液中存在等物质的量的溶质HCN和NaCN,其中CN-+H2O??HCN+OH-,H2O??H++OH-,c(H+)+c(HCN)>c(OH-),C错误;由物料守恒可知,c(HCN)+c(CN-)=0.01 mol·L-1,D正确。
(4)Al3+与HCO发生相互促进水解反应,生成Al(OH)3和CO2,反应的离子方程式为Al3++3HCO===Al(OH)3↓+3CO2↑。
(5)NaHC2O4溶液显酸性,则HC2O的电离程度大于其水解程度,所以c(C2O)>c(H2C2O4),由于氢离子来自水的电离和HC2O
的电离,则c(H+)>c(C2O),HC2O的水解程度较小,则c(HC2O)>c(C2O),溶液中各离子浓度大小为c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-);溶液中存在的阴离子为HC2O、C2O、OH-,阳离子为Na+、H+,其电荷守恒表达式为c(HC2O)+2c(C2O)+c(OH-)=c(Na+)+c(H+)。
13.(12分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是________________________________________________________________________________________________________________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH)__________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中c(NH)。
(3)20 ℃时,pH=3的NH4Al(SO4)2中,2c(SO)-c(NH)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是
____________________。
答案 (1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O??Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水
(2)小于
(3)10-3 mol·L-1
(4)a c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
解析 (1)NH4Al(SO4)2溶于水电离出的Al3+发生水解反应:Al3++3H2O??Al(OH)3(胶体)+3H+,Al(OH)3胶体粒子表面积大,可以吸附悬浮在水中的杂质使其沉降从而达到净水的目的。
(2)NH4Al(SO4)2中Al3+水解产生的H+抑制NH的水解,NH4HSO4电离出的H+也抑制NH的水解,由于后者电离出的c(H+)=0.1 mol·L-1,对NH水解抑制的程度更大,故c(NH)更大。
(3)根据电荷守恒:c(OH-)+2c(SO)=c(H+)+c(NH)+3c(Al3+),所以,2c(SO)-c(NH)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol·L-1-10-11 mol·L-1≈10-3 mol·L-1。
(4)当加入100 mL 0.1 mol·L-1 NaOH溶液时,溶液为(NH4)2SO4与Na2SO4的混合溶液,NH水解促进水的电离,故a点水的电离程度最大。b点时,pH=7,c(H+)=c(OH-),由于加入NaOH溶液的体积大于100 mL,故c(Na+)>c(SO),部分NH与OH-反应生成了NH3·H2O,故c(SO)>c(NH),所以b点时,离子浓度由大到小的顺序为c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。