- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点8氯及其化合物学案
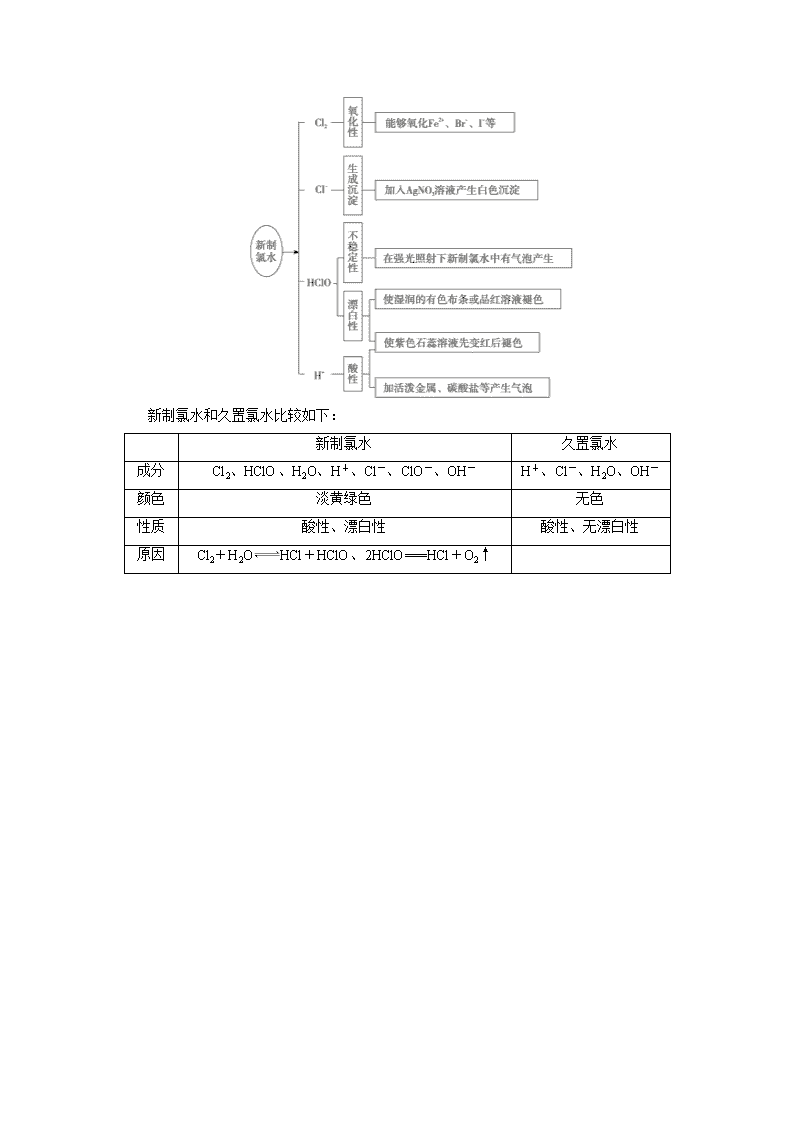
第3讲 元素化学 考点8 氯及其化合物 知识条目 必考要求 加试要求 1.氯气的工业制法 a b 2.实验室制取氯气的反应原理及其装置 a b 3.氯气的物理性质及用途 a a 4.氯气的净化、收集和检验,尾气的处理 b b 5.氯气的化学性质(跟某些金属、H2、H2O、碱的反应),HClO的漂白作用 c c 一、氯气的物理性质 氯气是一种黄绿色,有刺激性气味的气体,有毒,密度比空气大,能溶于水,常温下1体积水溶解约2体积Cl2。 二、从氯的原子结构认识氯气的化学性质——氧化性 1.与金属反应 常见的金属单质中不能被氯气氧化的是金(Au)和铂(Pt),与变价金属反应生成高价金属氯化物。 (1)与钠反应:Na+Cl22NaCl(白色的烟) (2)与铁反应:2Fe+3Cl22FeCl3(棕褐色烟,FeCl3水溶液呈黄色) (3)与铜反应:Cu+Cl2CuCl2(棕黄色烟,CuCl2水溶液呈蓝色) 2.与非金属反应 (1)与H2反应:H2+Cl22HCl 现象— (2)与Si反应:Si+2Cl2SiCl4 3.与水反应 氯气与水反应的化学方程式:Cl2+H2OHCl+HClO(Cl2的漂白原理) 次氯酸(HClO)的性质: (1)弱酸性:由反应Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,说明HClO的酸性比H2CO3弱。 (2)不稳定性:2HClO2HCl+O2↑。 (3)强氧化性:具有漂白性,能杀菌消毒。 4.与碱反应 (1)与烧碱反应:Cl2+2NaOH===NaCl+NaClO+H2O(Cl2的尾气处理原理) (2)制取漂白粉:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 漂白粉的主要成分是Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2。 漂白原理:Ca(ClO)2―→HClO,实际起漂白、杀菌作用的是HClO。 使用原理:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、Ca(ClO)2+2HCl===CaCl2+2HClO 漂白粉要密封包装,避光、隔潮存放,防止与空气中的CO2、H2O接触而变质。 注意:氯水能漂白某些有色物质是因为其中的HClO具有漂白性,而这种漂白性源于该物质具有强氧化性。同理,NaClO和Ca(ClO)2的漂白原理也是如此。 5.与还原性物质反应 (1)与卤化物反应:Cl2+2KI===2KCl+I2 Cl2+2Br-===2Cl-+Br2 (2)与SO2水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl (3)与亚铁离子反应:Cl2+2FeCl2===2FeCl3 三、氯水的多重性质 新制氯水中存在三个平衡关系: Cl2+H2OHCl+HClO HClOH++ClO- H2OH++OH- 根据可逆反应的特点,即可得出新制氯水中存在的各种微粒。 新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。 新制氯水和久置氯水比较如下: 新制氯水 久置氯水 成分 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、H2O、OH- 颜色 淡黄绿色 无色 性质 酸性、漂白性 酸性、无漂白性 原因 Cl2+H2OHCl+HClO、2HClO===HCl+O2↑ 四、氯气的制法 1.工业制取 (1)原料:饱和食盐水 以电解饱和食盐水为基础制取氯气(及烧碱、氢气)等产品的工业称为氯碱工业。 (2)反应原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑。 2.实验室制取 实验室通常用浓盐酸与二氧化锰共热制取Cl2。 用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸 ↓ MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 固体+液体气体 ↓ 用饱和食盐水除去HCl气体,再用浓H2SO4除去水蒸气 ↓ 用向上排空气法或排饱和食盐水法 ↓ 用强碱溶液(如NaOH溶液)吸收 ↓ 注意事项: ①必须用浓盐酸,稀盐酸不反应。 ②为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl挥发。 ③实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。 ④尾气吸收时,不能使用澄清的石灰水,因为石灰水浓度太小,吸收不完全。 【例1】 下列关于Cl2的说法中,不正确的是( ) A.Cl2是一种黄绿色、密度比空气大的有毒气体 B.红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾 C.工业上用Cl2和石灰乳为原料制造漂白粉 D.Cl2能与水反应生成盐酸和次氯酸 【解析】 Cl2是一种黄绿色、密度比空气大的有毒气体,故A正确;氯气与铁反应生成氯化铁,反应产生棕褐色的烟,故B错误;氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,工业上用Cl2和石灰乳为原料制造漂白粉,故C正确;Cl2能与水反应生成盐酸和次氯酸,Cl2+H2OHCl+HClO,故D正确。 【答案】 B 【提炼】 本题考查氯气的性质,熟悉氯气的物理性质和化学性质是解题关键。 【例2】 下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( ) A.将NaHCO3固体加入新制氯水,有无色气泡(H+) B.使红色布条褪色(HClO) C.滴加AgNO3溶液生成白色沉淀(Cl-) D.向FeCl2溶液中滴加氯水后,再滴加KSCN溶液,发现呈红色(HCl) 【解析】 氯水显酸性,能与碳酸氢钠反应生成CO2气体,与氢离子有关,故A正确;氯水中含HClO,具有漂白性,使红色布条褪色,故B正确;氯离子和硝酸银反应生成氯化银白色沉淀,与氯离子有关,故C正确;向FeCl2溶液中滴加氯水,再滴加KSCN溶液,溶液呈红色,是由于氯水中含有Cl2和HClO,都具有强氧化性,可将FeCl2氧化为FeCl3,与HCl无关,故选D。 【答案】 D 【提炼】 本题考查氯水的组成和性质。氯气与水反应:Cl2+H2OH++Cl-+HClO,氯水含多种微粒,有H2O、Cl2、HClO、Cl-、ClO-、H+、OH-(极少量,水微弱电离出来的),其中HClO、Cl2具有氧化性,HClO具有漂白性,H+具有酸性,以此解答。 【例3】 已知:将a mol Cl2通入含b mol NaOH的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、NaClO3。温度不同,三者的量也不同。下列说法不正确的是( ) A.改变温度,当产物中NaClO3的物质的量最大时,发生的离子反应为: 3Cl2+6OH-5Cl-+ClO+3H2O B.某温度下,反应后若溶液中c(ClO-)∶c(ClO)=1∶2,发生的离子反应为: 7Cl2+14OH-11Cl-+ClO-+2ClO+7H2O C.参加反应的Cl2与NaOH的物质的量关系一定是a=0.5b D.改变温度,反应中转移电子的物质的量可能为b mol 【解析】 当产物中NaClO3的物质的量最大时即只生成NaCl和NaClO3,所以根据转移电子守恒得n(Cl-)=5n(ClO),则发生的离子反应为:3Cl2+6OH-5Cl-+ClO+3H2 O,A选项正确;某温度下,若反应后溶液中c(ClO-)∶c(ClO)=1∶2,根据转移电子守恒得n(Cl-)=5n(ClO)+n(ClO-),所以n(Cl-)=11,所以发生的离子反应为7Cl2+14OH-11Cl-+ClO-+2ClO+7H2O,B选项正确;钠元素守恒:n(NaOH)=n(NaClO3)+n(NaCl)+n(NaClO),氯原子守恒:2n(Cl2)=n(NaClO3)+n(NaCl)+n(NaClO),故参加反应的Cl2与NaOH的物质的量的关系一定是a=0.5b,C选项正确;根据方程式Cl2+2OH-Cl-+ClO-+H2O、3Cl2+6OH-5Cl-+ClO+3H2O可知,氧化产物只有NaClO时,转移电子数最少,为0.5b mol,氧化产物只有NaClO3,转移电子数最多,为b mol,则反应中转移电子的物质的量不可能为b mol,D项错误。 【答案】 D 【提炼】 氯气与冷的氢氧化钠反应生成氯化钠、次氯酸钠和水:Cl2+2NaOH===NaCl+NaClO+H2O;与热的氢氧化钠反应生成氯化钠、氯酸钠和水:Cl2+6NaOH===5NaCl+NaClO3+3H2O。解题时运用电子守恒和原子守恒即可。 【例4】 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。 (1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子反应方程式为________________________________________________________________________; (2)装置B的作用是________________________________,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象________________________________________________________________________; (3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________(选“a”“b”或“c”); a b c Ⅰ 干燥的有色布条 湿润的有色布条 湿润的有色布条 Ⅱ 碱石灰 浓硫酸 无水氯化钙 Ⅲ 湿润的有色布条 干燥的有色布条 干燥的有色布条 (4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D 中的少量溶液加入E中,振荡E。观察到的现象是________________________________________________________________________; 该现象________(填“能”或“不能”)说明溴的非金属性强于碘,原因是________________________________________________________________________ ________________________________________________________________________。 【解析】 (1)高锰酸钾溶液与浓盐酸反应生成锰离子、氯气与水,反应的离子方程式为:2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O;(2)盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱;(3)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成的次氯酸具有漂白性,选项中的Ⅱ中都是干燥剂,根据图示装置可知,Ⅱ中应该为固体干燥剂,氯气干燥后再通入湿润的有色布条不能验证氯气的漂白性,所以装置C中Ⅰ、Ⅱ、Ⅲ处依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选c;(4)打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡;观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,所以该现象不能说明溴的非金属性强于碘。 【答案】 (1)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O (2)除杂和安全瓶 锥形瓶中液面下降,长颈漏斗中液面上升 (3)c (4)E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2 【提炼】 实验安全装置 (1)防倒吸装置 (2)防堵塞安全装置 (3)防污染安全装置 【例5】 二氧化氯(ClO2)是一种黄绿色、有刺激性气味的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水,是目前国际上公认的新一代高效、广谱、安全的杀菌保鲜剂,在水处理等方面有广泛应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 (1)在ClO2的制备方法中,比较实用的有数十种,下列是其中两种方法。 方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O 方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O 比较方法一和方法二,哪种方法更好?________,说明理由:________________________________________________________________________ ________________________________________________________________________。 实验室常用氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,其化学反应方程式为________________________________________________________________________ ________________________________________________________________________。 (2)工业上用稍潮湿的KClO3和草酸(H2C2O4)在60 ℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。 请问:A部分还应添加温度控制装置,请你说出一种温度控制方法________________________________________________________________________。 B部分还应补充什么装置____________,C中应装的试剂为____________。 我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示: 该反应的化学方程式为 ________________________________________________________________________。 (3)二氧化氯做消毒剂时,被还原成Cl-,它的消毒效率是同质量常用消毒剂NaClO(84消毒液的主要成分)的________倍。消毒水时,ClO2还可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,请写出二氧化氯与Mn2+反应的离子方程式________________________________________________________________________。 【解析】 (1)从环境、安全和产率角度考虑应选择方法二,原因是方法一的缺点主要是同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染;方法二的优点是安全性好,没有产生毒副产品。用氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水,化学反应方程式为2NaClO3+Na2SO3+H2SO4===2ClO2↑+2Na2SO4+H2O;(2)二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,C为尾气吸收装置,可选择NaOH溶液来吸收尾气;由微观过程可知,氯气与NaClO2反应,由原子及电子守恒可知,反应为2NaClO2+Cl2===2NaCl+2ClO2;(3)二氧化氯做消毒剂时,被还原成Cl-,质量是m的二氧化氯转移电子是5m/67.5 mol,次氯酸钠做消毒剂时,被还原成Cl-,质量是m的次氯酸钠转移电子是2m/74.5 mol,所以二者的消毒效率之比是5m/67.5∶2m/74.5≈2.76;ClO2氧化除去Mn2+的离子方程式为2ClO2+5Mn2++6H2O===5MnO2↓+2Cl-+12H+。 【答案】 (1)方法二 方法一的缺点主要是同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染;方法二的优点是安全性好,没有产生毒副产品 2NaClO3+Na2SO3+H2SO4===2ClO2↑+2Na2SO4+H2O (2)水浴加热 (冰水)冷凝 NaOH溶液 2NaClO2+Cl2===2NaCl+2ClO2 (3)2.76 2ClO2+5Mn2++6H2O===5MnO2↓+2Cl-+12H+ 【提炼】 制备物质方法选择时,不仅要考虑产率,还要结合环境友好、安全性等角度综合选定。查看更多