- 2021-08-24 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年高二化学新教材人教版必修第二册教师用书:8
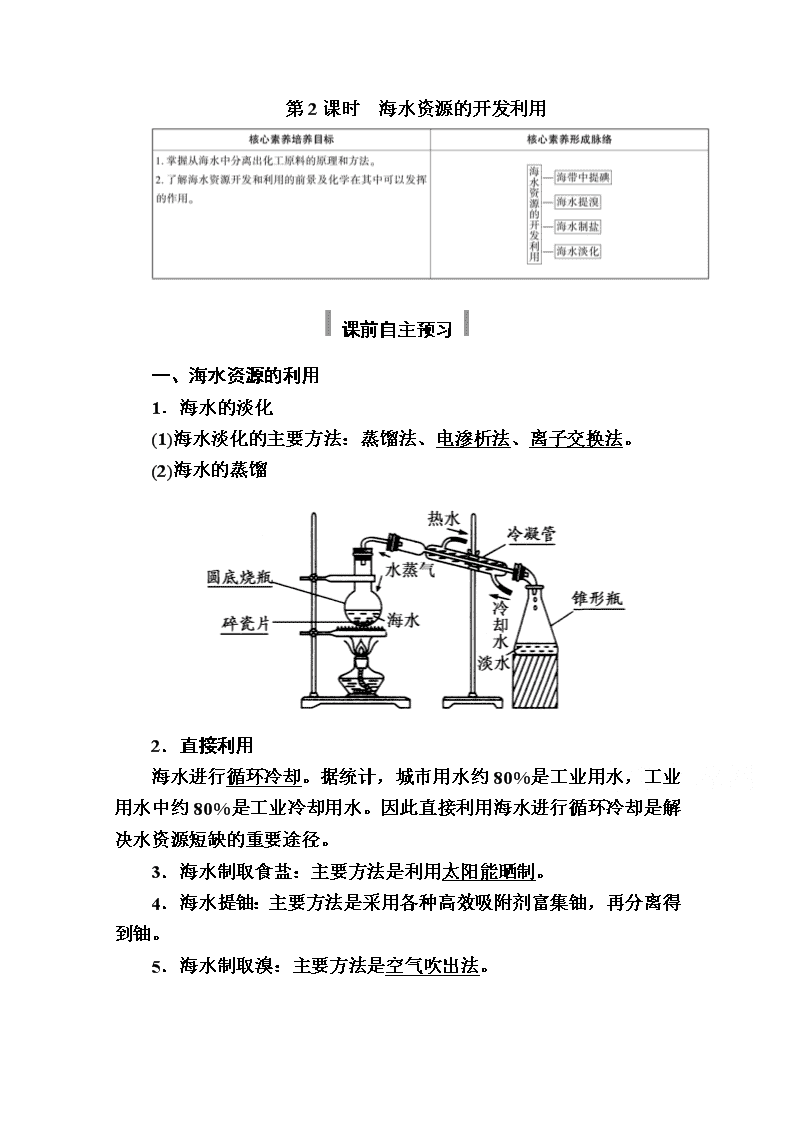
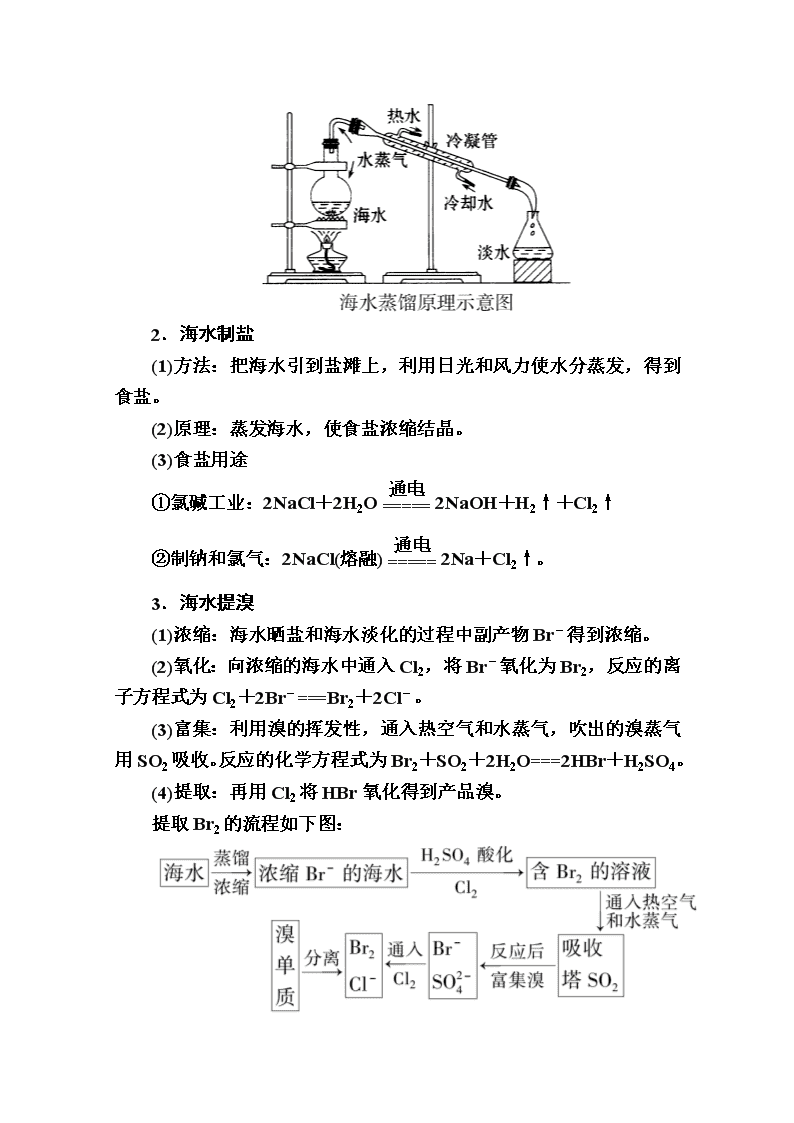
www.ks5u.com 第2课时 海水资源的开发利用 课前自主预习 一、海水资源的利用 1.海水的淡化 (1)海水淡化的主要方法:蒸馏法、电渗析法、离子交换法。 (2)海水的蒸馏 2.直接利用 海水进行循环冷却。据统计,城市用水约80%是工业用水,工业用水中约80%是工业冷却用水。因此直接利用海水进行循环冷却是解决水资源短缺的重要途径。 3.海水制取食盐:主要方法是利用太阳能晒制。 4.海水提铀:主要方法是采用各种高效吸附剂富集铀,再分离得到铀。 5.海水制取溴:主要方法是空气吹出法。 (1)主要流程: (2)主要反应:Cl2+2Br-===2Cl-+Br2、Br2+SO2+ 2H2O===2HBr+H2SO4、2HBr+Cl2===2HCl+Br2。 6.海带中含有的碘元素,以I-形式存在,因此可先用氧化剂将其氧化为I2,然后利用I2遇淀粉溶液变蓝这一特性检验。 二、海水中化学资源的开发利用 1.海水中的化学元素 大量元素:H、O等元素共13种。 微量元素:I、U等元素。 2.海水化学资源的开发利用 (1)从海水中制得NaCl。除食用外,还用作工业原料,如生产钠单质、烧碱、纯碱以及氯气、盐酸、漂白粉等含氯化工产品。 (2)从海水中制取钾、镁、溴及其化工产品,是在传统海水制盐工业上的发展。 课堂互动探究 海水资源的综合利用 1.海水淡化 (1)海水淡化途径:通过从海水中提取淡水或从海水中把盐分离出去。 (2)海水的蒸馏 2.海水制盐 (1)方法:把海水引到盐滩上,利用日光和风力使水分蒸发,得到食盐。 (2)原理:蒸发海水,使食盐浓缩结晶。 (3)食盐用途 ①氯碱工业:2NaCl+2H2O2NaOH+H2↑+Cl2↑ ②制钠和氯气:2NaCl(熔融)2Na+Cl2↑。 3.海水提溴 (1)浓缩:海水晒盐和海水淡化的过程中副产物Br-得到浓缩。 (2)氧化:向浓缩的海水中通入Cl2,将Br-氧化为Br2,反应的离子方程式为Cl2+2Br-===Br2+2Cl-。 (3)富集:利用溴的挥发性,通入热空气和水蒸气,吹出的溴蒸气用SO2吸收。反应的化学方程式为Br2+SO2+2H2O===2HBr+H2SO4。 (4)提取:再用Cl2将HBr氧化得到产品溴。 提取Br2的流程如下图: 4.海带中提碘 (1)海带中含有碘元素的检验 ①关键反应的反应原理: 2H++2I-+H2O2===I2+2H2O ②实验步骤及证明方法 (2)海带中提碘 ①流程 海带―→浸泡―→氧化―→过滤―→提纯―→碘单质 ②主要的化学原理:Cl2+2KI===2KCl+I2 5.海水提镁 (1)反应流程: (2)有关反应的化学方程式: ①MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2 ②Mg(OH)2+2HCl===MgCl2+2H2O ③MgCl2·6H2OMgCl2+6H2O ④MgCl2(熔融)Mg+Cl2↑ 典例题组训练 题组 海水水资源的综合利用 1.从海水中可以获得淡水、食盐,并可提取镁和液溴等物质。 (1)下列物质不需要通过化学变化就能够从海水中获得的是BC(填序号,下同)。 A.金属镁 B.粗盐 C.淡水 D.液溴 (2)食盐是日常生活的必需品,也是重要的化工原料,从海水中得到的粗盐中常含有可溶性杂质CaCl2、MgCl2、Na2SO4等,先将粗盐加水溶解,再通过以下几个步骤可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入适量的稀盐酸;⑤过滤;其正确的操作顺序是AB。 A.②③①⑤④ B.③①②⑤④ C.②③①④⑤ D.③⑤②①④ (3)从海水中提取溴和镁的流程如图所示: ①提取溴单质(Br2)时,通入Cl2是将海水中的溴离子(Br-)氧化成Br2,请写出该反应的离子方程式:Cl2+2Br-===Br2+2Cl-。工业上用空气吹出法将Br2吹入吸收塔与吸收剂SO2作用转化为氢溴酸(HBr)以达到富集溴的目的,步骤Ⅱ是SO2与Br2在水中反应生成两种酸的过程,请写出对应的化学方程式:SO2+Br2+2H2O===H2SO4+2HBr。第二次通入Cl2后得到高浓度的溴水,此时从高浓度的溴水中提取Br2 还要进行的操作为萃取、分液和蒸馏。 ②为实现对镁元素的富集,步骤Ⅰ中加入的足量试剂是NaOH(填化学式)。 解析:(1)通过电解熔融的氯化镁得到镁和氯气,是化学变化,故A项错误;用蒸馏海水的方法可以得到淡水,用太阳暴晒海水,蒸发水分后即得粗盐,不需要化学变化就能够从海水中获得,故B、C项正确;将溴离子氧化为溴单质是化学变化,故D项错误。(2)除去粗盐中的可溶性杂质Mg2+、Ca2+、SO时,正确的操作顺序可为②加入稍过量的NaOH溶液[除去镁离子:Mg2++2OH-===Mg(OH)2↓];③加入稍过量的BaCl2溶液(除去硫酸根离子:SO+Ba2+===BaSO4↓);①加入稍过量的Na2CO3溶液(除去钙离子及多余的钡离子:CO+Ca2+===CaCO3↓、CO+Ba2+===BaCO3↓),其中碳酸钠溶液必须加在氯化钡溶液之后,氢氧化钠溶液和氯化钡溶液的加入顺序可以颠倒;⑤过滤,将沉淀和不溶性的泥沙过滤出去;最后④滴入适量的稀盐酸以除去氢氧根离子和碳酸根离子,注意不能在过滤之前加盐酸,否则氢氧化镁、碳酸钙等会重新溶解,故A、B项正确。(3)向苦卤中加入试剂(步骤Ⅰ)得到Mg(OH)2,且不能引入新的杂质离子,则①应该是NaOH,Mg(OH)2溶于稀盐酸得到MgCl2溶液,将MgCl2·6H2O在HCl氛围中脱水得到MgCl2,电解熔融MgCl2得到Mg;向酸化的滤液中通入过量Cl2,发生反应2Br-+Cl2===2Cl-+Br2,得到低浓度的Br2,用热空气将Br2吹出,然后用二氧化硫还原溴得到溴离子,反应方程式为SO2+2H2O+Br2===H2SO4+2HBr,向氢溴酸中通入氯气,发生反应2Br-+Cl2===2Cl-+Br2,从而得到高浓度的Br2。①通过以上分析知,提取Br2时,第一次通入Cl2后发生反应的离子方程式是2Br-+Cl2===2Cl-+Br2;步骤Ⅱ所发生的反应为SO2+2H2O+Br2===H2SO4+2HBr;第二次通入Cl2后得到高浓度的溴水,此时从高浓度的溴水中提取Br2,还要进行的操作为萃取、分液、蒸馏。②通过以上分析知,为了实现对镁离子的富集,步骤Ⅰ中加入的足量试剂是NaOH。 2.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示: (1)指出制取碘的过程中有关的实验操作名称: ①过滤,②萃取和分液。 (2)操作②提取碘的过程中可供选择的有机试剂是B(填序号)。 A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油 (3)现需做使海藻灰中的碘离子转化为有机溶液中的碘的实验,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、药品,尚缺少的玻璃仪器是普通漏斗、分液漏斗。 (4)要从含碘的苯溶液中提取碘和回收苯,还需要经过蒸馏。进行蒸馏操作时,需使用水浴加热,目的是使蒸馏烧瓶均匀受热,便于控制温度,最后晶态碘在蒸馏烧瓶里聚集。 解析:(1)操作①是过滤,操作②是萃取和分液。(2)由于酒精、乙酸和甘油都易溶于水,不能用作提取碘的萃取剂。(3)为使海藻灰中的碘离子转化为有机溶液中的碘,需经过溶解、过滤、氧化、萃取和分液这几个步骤。在过滤时缺少普通漏斗,在进行萃取和分液时缺少分液漏斗。(4)苯的沸点为80.1 ℃。使用水浴加热的目的是使蒸馏烧瓶均匀受热、便于控制温度(水浴加热时的温度不会超过100 ℃)。最后晶态碘在蒸馏烧瓶里聚集。 海水淡化的方法及原理 淡化方法 原理 蒸馏法 将海水加热蒸发汽化,然后冷凝水蒸气得到蒸馏水 电渗析法 利用阴、阳离子交换膜对水中阴离子、阳离子的选择透过性,在外加直流电场作用下,使水中的一部分离子转移入另一部分水中而达到除盐的目的 离子交 换法 用阳离子交换树脂和阴离子交换树脂除去海水中的阳离子和阴离子,得到去离子水的方法 核心素养 1.氯的制法——氯碱工业 2.海水中提取溴 (1)流程 (2)主要过程及反应原理 3.海带中提取碘 (1)流程 (2)通入Cl2的反应原理 发生反应的离子方程式:Cl2+2I-===I2+2Cl-。 提醒:也可以用H2O2氧化I-,反应的离子方程式为H2O2+2I-+2H+===I2+2H2O。 【例1】 海水开发利用的部分过程如下图所示。下列说法错误的是( ) A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 【解析】 A项,苦卤中含有K+、Mg2+、Br-等,通入Cl2可将Br-氧化成Br2,便于从苦卤中提取Br2;B项,粗盐中含有不溶性杂质(泥沙)和可溶性杂质(Ca2+、Mg2+、SO等),将粗盐溶于水,并除去其中的杂质,再通过重结晶的方法得到纯净NaCl晶体;C项,工业上沉淀Mg2+常选用廉价的Ca(OH)2,而不选用NaOH;D项,Br2具有较强的挥发性,富集溴时,常先用空气和水蒸气吹出Br2,再用SO2 将其还原吸收(SO2+Br2+2H2O===H2SO4+2HBr),得到浓度较大的含Br-溶液。 【答案】 C 【例2】 (双选)从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法不正确的是( ) A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B.在含I-的滤液中加入稀硫酸和H2O2后,碘元素发生还原反应 C.在碘水中加入几滴淀粉溶液,溶液变蓝色 D.在碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取” 【解析】 灼烧干海带应在坩埚中进行,而不应在蒸发皿中灼烧;在含有I-的滤液中加入稀硫酸和H2O2后,碘元素发生氧化反应。 【答案】 AB查看更多