- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版4-专项突破(九)“铝三角”关系与Al(OH)3图像分析教案
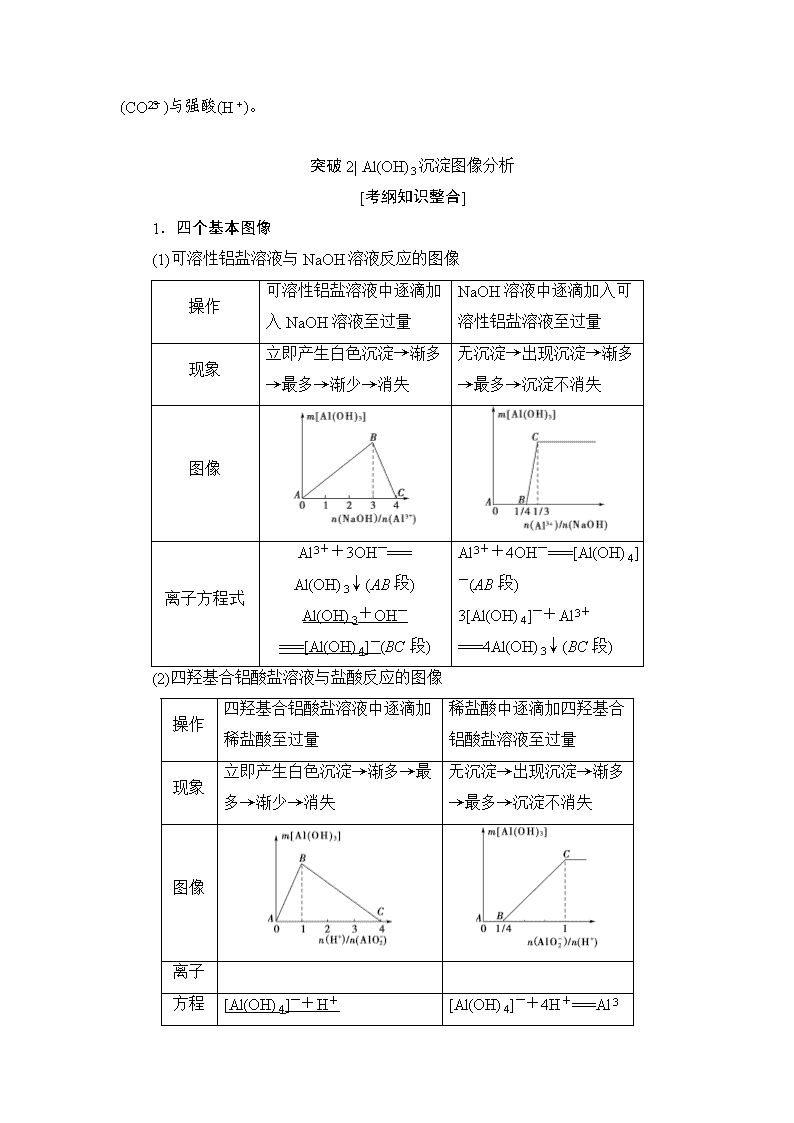
(九)“铝三角”关系与Al(OH)3图像分析 (对应学生用书第83页) 突破1| “铝三角”关系及应用 [考纲知识整合] 1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系 2.“铝三角”转化的应用 (1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。 (2)鉴别(利用滴加顺序不同,现象不同) ①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。 ②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。 3.判断铝元素的存在形式 (1)可溶性铝盐与强碱(如NaOH)溶液反应,铝元素的存在形式 (2)可溶性四羟基合铝酸盐与强酸(如HCl)溶液反应,铝元素的存在形式 [高考命题点突破] 命题点 “铝三角”关系及应用 1.(2018·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO、SO、HCO、OH-、NO十种离子中的若干种,下列推断正确的是( ) A.当溶液中有Al3+生成时,溶液中可能存在:SO、NO、H+、Mg2+ B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO;可能存在Mg2+ C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO、SO B [据题意,一定不含有Cu2+、HCO。当溶液中有Al3+生成时,原溶液中含有H+,不可能有NO(产生的气体为NO)、SO、OH-,据电中性原理知其中必定含有SO,于是不能存在Ba2+、Ag+,可能含有Mg2+,A项错误,B项正确;当溶液中有[Al(OH)4]-生成时,原溶液含有OH-,肯定没有H+、Ag+、Mg2+,据电中性原理知其中必定含有Ba2+,于是不可能含有SO、SO,可能含有NO,C、D项错误。] 2.现有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=2 mol·L-1,c(Cl-)=7 mol·L-1,要使Mg2+转化成Mg(OH)2并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液( ) 【导学号:95160078】 A.140 mL B.120 mL C.200 mL D.80 mL C [溶液中,n(Cl-)=0.1 L×7 mol·L-1=0.7 mol,n(Mg2+)=0.1 L×2 mol·L-1=0.2 mol,所以n(Al3+)=0.1 mol,将100 mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离出来,反应后为NaCl、Na[Al(OH)4]的混合液,由原子守恒可知,n(NaOH)=n(Na)=n(Cl)+n(Al)=0.7 mol+0.1 mol=0.8 mol,至少需要NaOH溶液的体积为0.8 mol÷4 mol·L-1=0.2 L=200 mL。] 3.下列各组物质,只用试管和胶头滴管就可鉴别的是________(填序号)。 ①Al2(SO4)3溶液与NaOH溶液 ②Na[Al(OH)4]溶液与稀盐酸 ③AlCl3溶液与氨水 ④NaHCO3溶液与稀H2SO4 ⑤Na2CO3溶液与稀盐酸 ⑥Ca(HCO3)2溶液与NaOH溶液 【答案】 ①②⑤ [题后归纳] 不用外加试剂,利用滴加法就能鉴别3组物质 (1)铝盐(Al3+)与强碱(OH-)。(2)四羟基合铝酸盐与强酸(H+)。,(3)碳酸正盐(CO)与强酸(H+)。 突破2| Al(OH)3沉淀图像分析 [考纲知识整合] 1.四个基本图像 (1)可溶性铝盐溶液与NaOH溶液反应的图像 操作 可溶性铝盐溶液中逐滴加入NaOH溶液至过量 NaOH溶液中逐滴加入可溶性铝盐溶液至过量 现象 立即产生白色沉淀→渐多→最多→渐少→消失 无沉淀→出现沉淀→渐多→最多→沉淀不消失 图像 离子方程式 Al3++3OH-=== Al(OH)3↓(AB段) Al(OH)3+OH-===[Al(OH)4]-(BC段) Al3++4OH-===[Al(OH)4]-(AB段) 3[Al(OH)4]-+Al3+===4Al(OH)3↓(BC段) (2)四羟基合铝酸盐溶液与盐酸反应的图像 操作 四羟基合铝酸盐溶液中逐滴加稀盐酸至过量 稀盐酸中逐滴加四羟基合铝酸盐溶液至过量 现象 立即产生白色沉淀→渐多→最多→渐少→消失 无沉淀→出现沉淀→渐多→最多→沉淀不消失 图像 离子 方程式 [Al(OH)4]-+H+===Al(OH)3↓+H2O(AB段) Al(OH)3+3H+===Al3++3H2O(BC段) [Al(OH)4]-+4H+===Al3++4H2O(AB段) Al3++3[Al(OH)4]-===4Al(OH)3↓(BC段) 提醒:分析图像时要特别关注各反应阶段的反应原理和比例关系。 2.四个拓展图像 (1)向AlCl3溶液中逐滴滴入氨水或Na[Al(OH)4]溶液至过量,图像如图1所示。 (2)向Na[Al(OH)4]溶液中逐滴滴入AlCl3溶液或通入CO2至过量,图像如图2所示。 图1 图2 (3)向MgCl2、AlCl3和盐酸的混合溶液(即将Mg、Al溶于过量盐酸所得的溶液)中逐滴滴入NaOH溶液至过量,图像如图3所示。 (4)向MgCl2、AlCl3混合溶液中先加入NaOH溶液,后加入盐酸(NaOH与盐酸的物质的量浓度相等),沉淀图像如图4所示。 图3 图4 [高考命题点突破] 命题点1 Al(OH)3沉淀图像判断 1.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的物质的量的关系曲线,下列判断错误的是( ) A.①线表示Al3+的物质的量的变化 B.x表示AlCl3的物质的量 C.③线表示Al(OH)3的物质的量的变化 D.④线表示[Al(OH)4]-的物质的量的变化 B [AlCl3溶液与NaOH溶液混合有两种方式:一种方式是向AlCl3溶液中缓慢滴加NaOH溶液,开始有沉淀生成,后沉淀溶解,且生成沉淀与沉淀溶解消耗的NaOH的物质的量之比为3∶1,则x表示NaOH的物质的量,B项符合题意;另一种方式是向NaOH溶液中缓慢滴加AlCl3溶液,开始没有沉淀,后有沉淀生成,与本题图示情况不符。] 2.下列实验操作对应的图像不正确的是( ) 选项 实验操作 图像 A 向MgCl2、AlCl3溶液中(各1 mol),逐滴加入NaOH溶液 B 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1 mol),逐滴加入NaOH溶液 C 向NaOH、Na[Al(OH)4]溶液中(各1 mol),逐滴加入HCl溶液 D 向NaOH、Na2CO3混合溶液中(各1 mol)滴加稀盐酸 D [A项,向MgCl2、AlCl3溶液中加入NaOH溶液,会产生Al(OH)3、Mg(OH)2沉淀,当NaOH溶液过量时,Al(OH)3沉淀又逐渐溶解,最后只剩余Mg(OH)2沉淀,图像与反应事实符合,正确;B项,向HCl、MgCl2、AlCl3、NH4 Cl溶液中加入NaOH溶液,首先与HCl反应,无沉淀产生,然后产生Al(OH)3、Mg(OH)2沉淀,再生成NH3·H2O,最后Al(OH)3沉淀溶解,只有Mg(OH)2沉淀,图像与反应事实符合,正确;C项,向NaOH、Na[Al(OH)4]溶液中加入HCl溶液,首先与NaOH反应,没有沉淀生成,然后与[Al(OH)4]-反应生成Al(OH)3沉淀,HCl溶液过量后,Al(OH)3沉淀完全溶解,图像与反应事实符合,正确;D项,向NaOH、Na2CO3混合溶液中滴加稀盐酸,首先与NaOH反应,没有气体生成,后与Na2CO3反应生成NaHCO3,没有气体生成,再与NaHCO3反应生成气体,图像与反应事实不符合,符合题意。] 命题点2 Al(OH)3图像中涉及的计算问题 3.将10 g Fe2O3、SiO2、Al2O3的混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液的体积关系如图所示。下列叙述错误的是( ) 【导学号:95160079】 A.滤出的物质为SiO2 B.可求出x的值 C.可求出Al2O3的质量分数 D.可求出Fe2O3的质量分数 D [A项,SiO2与稀硫酸不反应,则滤出的物质为SiO2,不符合题意;B项,当加入NaOH溶液的体积为100 mL时,沉淀为氢氧化铁和氢氧化铝,溶液中溶质为硫酸钠,根据H2SO4~Na2SO4~2NaOH可知n(Na)=2n(H2SO4),进而可求出x的值,不符合题意;C项,加入NaOH溶液的体积为110 mL时,氢氧化铝全部溶解,则根据Al(OH)3+NaOH===Na[Al(OH)4]可求出Al2O3的质量分数,不符合题意;D项,由于滤液中过量的酸的量和沉淀的总质量未知,则不能确定氧化铁的质量,符合题意。] 4.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO的物质的量之比为 ( ) A.1∶3 B.2∶3 C.6∶1 D.3∶1 C [OA上升的直线表示Al(OH)3和Mg(OH)2沉淀的生成,AB下降的直线表示Al(OH)3沉淀溶解,B点表示Al(OH)3完全溶解。AB段完全溶解Al(OH)3消耗NaOH 0.1 L,则Al3+生成Al(OH)3消耗NaOH 0.3 L,沉淀Mg2+消耗NaOH 0.1 L,因而n(AlCl3)∶n(MgSO4)=2∶1,所以,n(Cl-)∶n(SO)=6∶1。] [方法技巧] Al(OH)3图像中有关定量关系 (1)沉淀Al3+所需n(OH-)与Al(OH)3溶解所需n(OH-)的比为3∶1。 (2)Al(OH)3溶解所需n(OH-)=n[Al(OH)3]。 (3)沉淀[Al(OH)4]-所需n(H+)与Al(OH)3溶解所需n(H+)的比为1∶3。 (4)Al(OH)3溶解所需n(H+)=3n[Al(OH)3]。查看更多