2019届一轮复习全国通用版第5讲离子反应学案
第 5 讲 离子反应
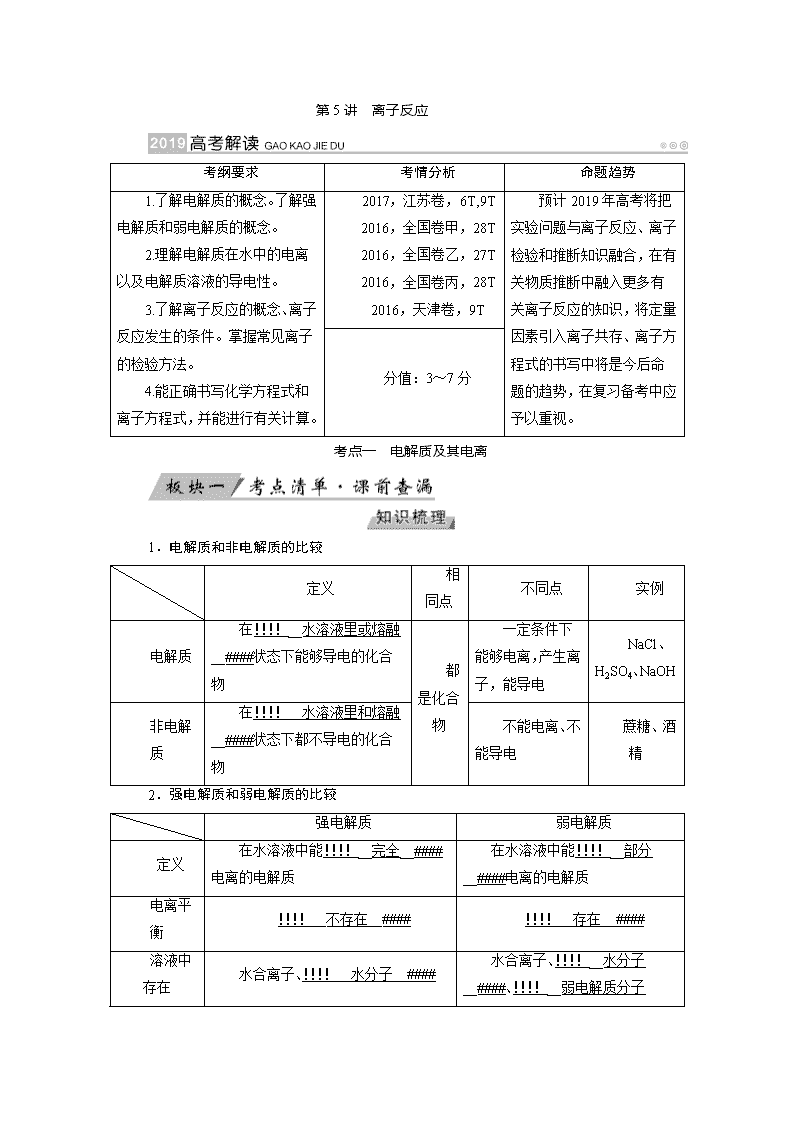
考纲要求 考情分析 命题趋势
1.了解电解质的概念。了解强
电解质和弱电解质的概念。
2.理解电解质在水中的电离
以及电解质溶液的导电性。
3.了解离子反应的概念、离子
反应发生的条件。掌握常见离子
的检验方法。
4.能正确书写化学方程式和
离子方程式,并能进行有关计算。
2017,江苏卷,6T,9T
2016,全国卷甲,28T
2016,全国卷乙,27T
2016,全国卷丙,28T
2016,天津卷,9T
预计 2019 年高考将把
实验问题与离子反应、离子
检验和推断知识融合,在有
关物质推断中融入更多有
关离子反应的知识,将定量
因素引入离子共存、离子方
程式的书写中将是今后命
题的趋势,在复习备考中应
予以重视。
分值:3~7 分
考点一 电解质及其电离
1.电解质和非电解质的比较
定义
相
同点
不同点 实例
电解质
在!!!!__水溶液里或熔融
__####状态下能够导电的化合
物
都
是化合
物
一定条件下
能够电离,产生离
子,能导电
NaCl、
H2SO4、NaOH
非电解
质
在!!!!__水溶液里和熔融
__####状态下都不导电的化合
物
不能电离、不
能导电
蔗糖、酒
精
2.强电解质和弱电解质的比较
强电解质 弱电解质
定义
在水溶液中能!!!!__完全__####
电离的电解质
在水溶液中能!!!!__部分
__####电离的电解质
电离平
衡
!!!!__不存在__#### !!!!__存在__####
溶液中
存在
水合离子、!!!!__水分子__####
水合离子、!!!!__水分子
__####、!!!!__弱电解质分子
微粒种
类
__####等
举例
强酸:HCl、H2SO4、HNO3、HClO4、
HBr、HI 等。
强碱:KOH、NaOH、Ba(OH)2 等。
绝大部分盐:BaSO4、BaCl2 等
弱酸: CH3COOH、HF、H2S、
H2CO3 等。
弱碱:NH3·H2O 及难溶于水的
碱等。
H2O
3.电离
(1)概念:电解质在水溶液中或熔融状态下离解成!!!!__自由移动的离子__####的过程。
(2)电离条件:酸的电离条件是!!!!__溶于水__####,盐和碱的电离条件是!!!!__溶
于水或熔融__####。
4.电离方程式的书写
(1)强电解质:完全电离,用“!!!!__===__####”表示。如 H2SO4、NaOH、(NH4)2SO4
的电离方程式分别为!!!!__H2SO4===2H + +SO2-
4 __####、!!!!__NaOH===Na + +OH -
__####、!!!!__(NH4)2SO4===2NH+
4 +SO2-
4 __####。
(2)弱电解质:部分电离,用“!!!!__??__####”表示。
①多元弱酸分步电离,且电离程度逐步减弱,以第一步电离为主。如 H2S 的电离方程
式为!!!!__H2S??H++HS-__####、!!!!__HS-??H++S2-__####。
②多元弱碱分步电离,但一步写出。如 Cu(OH)2 的电离方程式:Cu(OH)2??Cu2++2OH
-。
③两性氢氧化物酸式或碱式电离。如 Al(OH)3 的电离方程式:!!!!__H++AlO-
2 +
H2O??Al(OH)3??Al3++3OH-__####。
(3)酸式盐
①强酸酸式盐完全电离,一步写出。如 NaHSO4 在水溶液中的电离方程式为!!!!
__NaHSO4===Na++H++SO2-
4 __####,在熔融状态下的电离方程式为!!!!__NaHSO4===Na
++HSO-
4 __####。
②可溶性的多元弱酸酸式盐第一步完全电离,其余部分电离。
如 NaHCO3===Na++HCO-
3 、HCO-
3 ??H++CO2-
3 。
电解质与非电解质、强电解质与弱电解质的判断
(1)判断电解质需注意的点
①电解质和非电解质均是化合物,单质和混合物既不是电解质,也不是非电解质。
②电解质不一定导电,如固态 NaCl、液态 HCl 等;导电物质不一定是电解质,如铁、
铝等金属单质。
③电解质一定是指自身电离生成离子的化合物,有些化合物的水溶液能导电,但溶液中
的离子不是它自身电离产生的,不属于电解质,如 CO2、SO2、NH3、SO3 等非电解质。它
们与水反应生成的产物 H2CO3、H2SO3、NH3·H2O、H2SO4 自身能电离,是电解质。
(2)判断电解质强、弱需注意的点
①电解质的强弱与其溶解性无关。如 BaSO4 是强电解质,CH3COOH、NH3·H2O 均易溶
于水,但都是弱电解质。
②电解质的强弱与溶液的导电能力没有必然联系。
1.判断正误,正确的划“√”,错误的划“×”。
(1)银和食盐水都能导电,都属于电解质。( × )
(2)H2SO4 是强电解质,故浓硫酸具有强的导电性。( × )
(3)NaCl 溶液在电流的作用下电离成钠离子和氯离子。( × )
(4)强电解质都是离子化合物,弱电解质都是共价化合物。( × )
(5)CaO 是强电解质,是因为它的水溶液能导电。 ( × )
(6)强电解质溶液导电性比弱电解质溶液导电性强。( × )
(7)AgCl、BaSO4 等不溶于水,都属于弱电解质。( × )
2.下列物质中,属于电解质的是!!!!__①④⑦⑧__####,属于非电解质的是!!!!
__⑤⑨⑩⑪___####,属于强电解质的是!!!!__①④⑧__####,属于弱电解质的是!!!!
__⑦__####(填序号)。
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜 ⑦H2CO3 ⑧氯化氢 ⑨蔗糖
⑩氨气 ⑪CO2
3.写出下列物质的电离方程式
(1)H2CO3:!!!!__H2CO3??H++HCO-
3 、HCO-
3 ??H++CO2-
3 __####。
(2)HClO4:!!!!__HClO4===H++ClO-
4 __####。
(3)HClO:!!!!__HClO??H++ClO-__####。
(4)NH3·H2O:!!!!__NH3·H2O??NH+
4 +OH-__####。
(5)NH4HSO4(水溶液):!!!!__NH4HSO4===NH+
4 +H++SO2-
4 __####。
(6)KHSO4(熔融):!!!!__KHSO4=====
熔融
K++HSO-
4 __####。
(7)Al2O3(熔融):!!!!__Al2O3=====
熔融
2Al3++3O2-__####。
电离方程式书写的思维模型
电解质、非电解质、强电解质、弱电解质的关系
依据元素周期表,突破强、弱电解质的记忆
ⅠA:碱金属的氢氧化物都是强碱。
ⅡA:除 Mg(OH)2、Be(OH)2 外其余都是强碱。
ⅢA:Al(OH)3 是两性氢氧化物。
ⅣA:H2CO3、H2SiO3 均为弱酸。
ⅤA:强酸:HNO3;中强(或弱)酸:HNO2、H3PO4。
ⅥA:强酸:H2SO4;弱酸:H2SO3、H2S。
ⅦA:强酸:HCl、HBr、HI、HClO4 等;弱酸:HF、HClO 等。
过渡元素中常见的弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2 等。
[例 1]下列说法正确的是( B )
A.室温下,稀释 0.1 mol·L-1 CH3COOH 溶液,溶液的导电能力增强
B.25 ℃时,0.1 mol·L-1 的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.Na 在 Cl2 中燃烧的生成物含离子键,所以 NaCl 固体能导电
D.氯化铵、次氯酸都属于强电解质
解析 稀释 0.1 mol·L-1 CH3COOH 溶液后,溶液中的 c(H+)、c(CH3COO-)均减小,溶液
的导电能力减弱,A 项错误;NaCl 固体不能导电,C 项错误;HClO 为弱电解质,D 项错误。
[例 1] (2018·湖北宜昌质检)下列说法中不正确的是( )
①将 BaSO4 放入水中不能导电,所以 BaSO4 是非电解质
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④ B.①④⑤
C.①②③④ D.①②③④⑤
[答题送检]来自阅卷名师报告
错
误
致错原因
扣
分
C
忽视了电解质溶液的浓度、电解质的溶解性等对离子浓度的影响。一
般的规律是:在相同条件下,强电解质溶液的导电能力比弱电解质溶液的
导电能力强
-
3
[解析] 由于 BaSO4 难溶,导致溶液中离子浓度很低,所以其水溶液不能导电,但 BaSO4
是强电解质,①错误;氨水是混合物,既不是电解质也不是非电解质,②错误;熔融态的共
价化合物不能电离,没有自由移动的阴阳离子,不能导电,③错误;熔融态的离子化合物中
有自由移动的阴阳离子,可以导电,④错误;电解质溶液的导电能力主要取决于溶液中的离
子浓度的大小,而与电解质本身的强弱没有直接关系,⑤错误。
[答案] D
1.今有下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后面括号中。
① ② ③ ④
(1)向 H2SO4 溶液中加入等体积、等物质的量浓度的 Ba(OH)2 溶液 ( ④ )
(2)向 H2SO4 溶液中通入 Cl2 直至过量 ( ② )
(3)向 AgNO3 溶液通入少量 HCl( ③ )
(4)向氨水中通入 HCl 直至过量( ② )
(5)向 NaOH 溶液中通入少量 Cl2( ③ )
(6)向饱和石灰水中不断通入 CO2( ① )
1.判断正误,正确的划“√”,错误的划“×”。
(1)25 ℃时,0.1 mol·L - 1 的 Na2SO4 溶液比等浓度的 Na2CO3 溶液的导电能力弱。
( √ )
(2)0.1 mol·L-1 NaHCO3 溶液中,溶质的电离方程式为 NaHCO3===Na++H++CO2-
3 。
( × )
(3)烧碱、冰醋酸、四氯化碳均为电解质。( × )
2.H3PO2 是一元中强酸,写出其电离方程式:!!!!__H3PO2??H++H2PO-
2 __####。
考点二 离子反应和离子方程式
1.离子反应
(1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应发生的条件
①复分解反应类型:生成!!!!__难溶性__####的物质,如 Al(OH)3、BaSO4 等;生成!!!!
__难电离__####的物质,如弱酸、弱碱、水等;生成!!!!__易挥发__####的物质,如 CO2、
SO2、NH3 等。
②氧化还原反应类型:强氧化性物质+强还原性物质―→弱氧化性物质+弱还原性物
质。如 FeCl3 溶液与 Cu 反应的离子方程式为!!!!__2Fe3++Cu===2Fe2++Cu2+__####。
③配合反应类型:生成稳定的配合物或配离子。如向 FeCl3 溶液中滴入 KSCN 溶液时反
应的离子方程式为!!!!__Fe3++3SCN-??Fe(SCN)3__####。
2.离子方程式
(1)概念:用实际参加反应的离子符号来表示离子反应的式子。
(2)意义:离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离
子反应,如 H++OH-===H2O 可以表示可溶于水的!!!!__强酸__####与可溶于水的!!!!__
强碱__####反应生成!!!!__可溶性的盐__####和水的反应。
(3)书写步骤(以 CaCO3 与盐酸反应为例)
—写出正确的化学方程式:!!!!__CaCO3+2HCl===CaCl2+H2O+CO2↑__####。
—把易溶解且全部电离的物质写成离子形式:!!!!__CaCO3+2H++2Cl-===Ca2++
2Cl-+H2O+CO2↑__####。
—删去方程式两边不参加反应的离子:!!!!__CaCO3 +2H + ===Ca2 + +H2O+
CO2↑__####。
—检查方程式两边是否符合!!!!__原子__####守恒和!!!!__电荷__####守恒。
书写离子方程式应注意的问题
(1)易溶、全部电离的物质(可溶性强电解质包括强酸、强碱、可溶性盐)以实际参加反应
的离子符号表示;非电解质、弱电解质、难溶物、气体、单质、氧化物均用化学式表示。
(2)书写离子方程式时,浓硫酸不能拆写成离子形式,而浓硝酸、浓盐酸要拆写成离子
形式。
(3)多元弱酸的酸式酸根不能拆写成离子形式,如 NaHCO3 不能拆写成“Na++H++
CO2-
3 ”。
(4)氨水作为反应物写为 NH3·H2O;作为生成物,若有加热条件或浓度很大时,写为
“NH3↑+H2O”。
(5)拆写时,微溶的强电解质的澄清溶液要写成离子形式;呈浑浊状态或沉淀时要写成
化学式,如澄清石灰水表示为“Ca2++2OH-”,而石灰乳表示为“Ca(OH)2”。
(6)盐类水解的离子方程式不要忘记“??”。
1.书写下列反应的离子方程式。
(1)Na 与 H2O 反应:!!!!__2Na+2H2O===2Na++2OH-+H2↑__####。
(2)将氯化亚铁溶液和稀硝酸混合:!!!!__3Fe2 + +4H + +NO -
3 ===3Fe3 + +2H2O+
NO↑__####。
(3)Na2S 水溶液在空气中被氧化变质:!!!!__2S2-+O2+2H2O===2S↓+4OH-__####。
(4)实验室用 NaOH 溶液吸收 SO2 尾气:!!!!__2OH-+SO2===SO2-
3 +H2O__####。
(5)明矾溶于水产生 Al(OH)3 胶体:!!!!__Al3++3H2O??Al(OH)3(胶体)+3H+__####。
(6)Na2O2 溶于水:!!!!__2Na2O2+2H2O===4Na++4OH-+O2↑__####。
(7)Ca(HCO3)2 溶液与少量 NaOH 溶液反应:!!!!__Ca2++HCO-
3 +OH-===CaCO3↓+
H2O__####。
(8)浓盐酸与铁屑反应:!!!!__Fe+2H+===Fe2++H2↑__####。
(9)足量氨水与 AlCl3 溶液反应:!!!!__Al3++3NH3·H2O===Al(OH)3↓+3NH+
4 __####。
(10)醋酸与大理石反应:!!!!__2CH3COOH+CaCO3===Ca2 + +2CH3COO - +H2O+
CO2↑__####。
(11)Ba(OH)2 溶液与(NH4)2SO4 溶液混合:!!!!__Ba2++2OH-+2NH+
4 +SO2-
4 ===BaSO4↓
+2NH3·H2O__####。
(12)CuSO4 溶液与 Ba(OH)2 溶液混合:!!!!__Cu2++SO2-
4 +Ba2++2OH-===Cu(OH)2↓
+BaSO4↓__####。
(13)NH4HCO3 与过量 NaOH 溶液混合:!!!!__NH+
4 +HCO-
3 +2OH-===CO2-
3 +NH3·H2O
+H2O__####。
(14)Fe(OH)3 溶于 HI 溶液中:!!!!__2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O__####。
用分类思想突破与量有关的离子方程式的书写
与量有关的离子反应按其成因大体上可分为三种类型,即连续反应型,先后反应型及离
子配比型。
1.连续反应型
指反应生成物因又能与剩余(过量)的反应物继续反应而与用量有关。常见的连续反应型
主要有以下六种。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应
如 CO2 通入 NaOH 溶液中:
①碱过量:CO2+2OH-===CO2-
3 +H2O。
②碱不足:CO2+OH-===HCO-
3 。
(2)多元弱酸(或其酸酐)与更弱的酸的盐溶液反应
如 CO2 通入 NaAlO2 溶液中:
①NaAlO2 过量:CO2+2AlO-
2 +3H2O===2Al(OH)3↓+CO2-
3 。
②NaAlO2 不足:CO2+AlO-
2 +2H2O===Al(OH)3↓+HCO-
3 。
(3)多元弱酸盐与强酸反应
如 Na2CO3 溶液与稀盐酸反应:
①盐酸不足:H++CO2-
3 ===HCO-
3 。
②盐酸过量:2H++CO2-
3 ===CO2↑+H2O。
(4)铝盐溶液与强碱溶液反应
①铝盐过量:Al3++3OH-===Al(OH)3↓。
②强碱过量:Al3++4OH-===AlO-
2 +2H2O。
(5)NaAlO2 溶液与强酸溶液反应
①NaAlO2 过量:AlO-
2 +H++H2O===Al(OH)3↓。
②强酸过量:AlO-
2 +4H+===Al3++2H2O。
(6)Fe 与稀 HNO3 溶液反应
①Fe 过量:3Fe+8H++2NO-
3 ===3Fe2++2NO↑+4H2O。
②HNO3 过量:Fe+4H++NO-
3 ===Fe3++NO↑+2H2O。
2.先后反应型
一种反应物的两种或两种以上的组成离子,都能与另一种反应物的组成离子反应,但因
反应次序不同而与用量有关,又可称为竞争型。常见的先后反应型主要有以下五种。
(1)FeBr2 溶液与 Cl2 反应
①Cl2 少量:2Fe2++Cl2===2Fe3++2Cl-。
②Cl2 过量:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
类似该反应的还有 FeI2 溶液与 Cl2 反应(还原性:I->Fe2+)。
(2)NH4HCO3 溶液与 NaOH 溶液反应
①NaOH 溶液少量:HCO-
3 +OH-===CO2-
3 +H2O。
②NaOH 溶液足量:NH+
4 +HCO-
3 +2OH-===NH3·H2O+CO2-
3 +H2O。
类似该反应的还有 NH4Al(SO4)2 溶液或 NH4HSO4 溶液与 NaOH 溶液反应。
(3)将 Fe(NO3)3 溶液与 HI 混合
①HI 不足:8H++2NO-
3 +6I-===4H2O+3I2+2NO↑。
②HI 过量:Fe3++12H++3NO-
3 +10I-===Fe2++5I2+6H2O+3NO↑。
(4)向含有 OH-、CO2-
3 、AlO -
2 的溶液中,逐滴加入稀盐酸至过量,反应的离子方程式依
次为:
①OH-+H+===H2O
②AlO-
2 +H++H2O===Al(OH)3↓
③CO2-
3 +H+===HCO-
3
④HCO-
3 +H+===H2O+CO2↑
⑤Al(OH)3+3H+===Al3++3H2O。
(5)向含有 H+、Al3+、NH +
4 的溶液中,逐滴加入 NaOH 溶液至过量,反应的离子方程式
依次为:
①H++OH-===H2O
②Al3++3OH-===Al(OH)3↓
③NH+
4 +OH-===NH3·H2O
④Al(OH)3+OH-===AlO-
2 +2H2O。
3.离子配比型
当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为
复盐或酸式盐);当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩
余或不足)而与用量有关。主要有以下三种情况。
(1)Ca(OH)2 溶液与 NaHCO3 溶液反应
①NaHCO3 溶液少量:HCO-
3 +OH-+Ca2+===CaCO3↓+H2O。
②NaHCO3 溶液足量:2HCO-
3 +2OH-+Ca2+===CaCO3↓+CO2-
3 +2H2O。
类似该反应的还有 Ca(HCO3)2 溶液与 NaOH 溶液反应。
(2)NaHSO4 溶液与 Ba(OH)2 溶液反应
①加 Ba(OH)2 溶液至 SO 2-
4 恰好沉淀:H++OH-+SO2-
4 +Ba2+===BaSO4↓+H2O。
②加 Ba(OH)2 溶液至溶液呈中性:2H++2OH-+SO2-
4 +Ba2+===BaSO4↓+2H2O。
(3)NH4Al(SO4)2 与 Ba(OH)2 溶液反应
①n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1,3Ba2++3SO2-
4 +2Al3++6OH-===3BaSO4↓
+2Al(OH)3↓。
②n[NH4Al(SO4)2]∶n[Ba(OH)2] = 1∶2 , NH +
4 + Al3 + + 2SO 2-
4 + 2Ba2 + + 4OH -
===NH3·H2O+Al(OH)3↓+2BaSO4↓。
③n[NH4Al(SO4)2]∶n[Ba(OH)2] = 1 ∶ 3 , NH +
4 + Al3 + + 2SO 2-
4 + 2Ba2 + + 5OH -
===NH3·H2O+AlO-
2 +2BaSO4↓+2H2O。
[例 1] 下列表示对应化学反应的离子方程式正确的是( D )
A.向稀 HNO3 中滴加 Na2SO3 溶液:
SO2-
3 +2H+===SO2↑+H2O
B.向 Na2SiO3 溶液中通入过量 SO2:
SiO2-
3 +SO2+H2O===H2SiO3↓+SO2-
3
C.向 Al2(SO4)3 溶液中加入过量 NH3·H2O:
Al3++4NH3·H2O===[Al(OH)4]-+4NH+
4
D.向 CuSO4 溶液中加入 Na2O2:
2Na2O2+2Cu2++2H2O===4Na++2Cu(OH)2↓+O2↑
解析 HNO3 具有强氧化性,能将 Na2SO3 氧化成 Na2SO4,A 项错误;B 项忽视了 SO2
过量,应生成 HSO-
3 ,错误;Al(OH)3 不能溶于过量 NH3·H2O,C 项错误;向 CuSO4 溶液中
加入 Na2O2,首先发生反应:2Na2O2+2H2O===4Na++4OH-+O2↑,生成的 OH-再与 CuSO4
发生反应:Cu2++2OH-===Cu(OH)2↓,将两个离子反应合并即可得总反应:2Na2O2+2Cu2
++2H2O===4Na++2Cu(OH)2↓+O2↑,D 项正确。
[例 2] (1)(2016·全国卷甲)FeCl2 溶液与氯水反应的离子方程式为!!!!__2Fe2 + +
Cl2===2Fe3++2Cl-__####。
(2)(2016·全国卷乙)CrO 2-
4 和 Cr2O 2-
7 在溶液中可相互转化,在酸性条件下,CrO 2-
4 可转
化成 Cr2O2-
7 ,用离子方程式表示 Na2CrO4 溶液中的转化反应:!!!!__2CrO2-
4 +2H+??Cr2O2-
7
+H2O__####。
(3)(2016·全国卷丙)用硫酸“酸浸”时,V2O5 转化为 VO+
2 ,反应的离子方程式为!!!!
__V2O5+2H+===2VO+
2 +H2O__####。
(4)(2016·浙江卷)化合物 Mg5Al3(OH)19(H2O)4 可作环保型阻燃材料,受热时按如下化学
方程式分解:
2Mg5Al3(OH)19(H2O)4=====
△
27H2O↑+10MgO+3Al2O3
用离子方程式表示除去固体产物中 Al2O3 的原理:!!!!__Al2O3+2OH-===2AlO-
2 +
H2O__####。
[例 1] 随着原子序数递增,八种短周期元素(用字母 x 等表示)原子半径的相对大小、最
高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
上述元素可组成盐 R:zx4f(gd4)2。向盛有 10 mL 1 mol·L-1 R 溶液的烧杯中滴加 1 mol·L
-1 NaOH 溶液,沉淀物质的量随 NaOH 溶液体积的变化示意图如下图:
(1)R 溶液中,离子浓度由大到小的顺序是!!!!______####。
(2)写出 m 点反应的离子方程式:!!!!______####。
(3)若在 R 溶液中改加 20 mL 1.2 mol·L-1 Ba(OH)2 溶液,充分反应后,溶液中产生沉淀
的物质的量为!!!!______####mol。
[答题送检]来自阅卷名师报告
错
误
致错原因
扣
分
(1) 不清楚 NH+
4 、Al3+的水解程度
-
3
(2)
NH+
4 、Al3+能与 OH-反应,不能确定反应顺
序
-
3
[解析] (1)NH4Al(SO4)2===NH+
4 +Al3++2SO2-
4 ,NH3·H2O 的碱性强于氢氧化铝,所以在
溶液中 Al3+的水解程度大于 NH+
4 ,则 c(Al3+)
c(OH-)。(2)分
析图像可知 m 点时是 NH +
4 与 OH-反应。(3)R 溶液中 n(NH+
4 )=0.01 mol,n(Al3+)=0.01 mol,
n(SO2-
4 )=0.02 mol,加入的氢氧化钡 n(Ba2+)=0.024 mol,n(OH-)=0.048 mol,反应 Ba2++
SO2-
4 ===BaSO4↓生成沉淀 0.02 mol,另外两个反应的顺序为 Al3++3OH-===Al(OH)3↓,消
耗 n(OH-)=0.03 mol,生成 n[Al(OH)3]=0.01 mol,NH+
4 +OH-===NH3·H2O,消耗 n(OH-)
=0.01 mol,剩余 n(OH-)=0.008 mol,再发生反应 Al(OH)3+OH-===AlO-
2 +2H2O,溶解 0.008
mol Al(OH)3 沉淀,最后剩余 Al(OH)3 沉淀 0.002 mol,反应中共生成沉淀 0.022 mol。
[答案] (1)c(SO2-
4 )>c(NH+
4 )>c(Al3+)>c(H+)>c(OH-)
(2)NH+
4 +OH-===NH3·H2O (3)0.022
1.(双选)离子方程式 2Ca2++3HCO-
3 +3OH-===2CaCO3↓+CO2-
3 +3H2O 可以表示
( AB )
A.Ca(HCO3)2 与 NaOH 溶液反应
B.NaHCO3 与澄清石灰水反应
C.Ca(HCO3)2 与澄清石灰水反应
D.NH4HCO3 与澄清石灰水反应
解析 A项,Ca(HCO3)2与NaOH溶液反应,当NaOH与Ca(HCO3)2的物质的量之比为3∶2
时,反应的离子方程式为 2Ca2++3HCO-
3 +3OH-===2CaCO3↓+CO2-
3 +3H2O,正确;B 项,
NaHCO3 与澄清石灰水反应,当两溶液中所含 NaHCO3 与 Ca(OH)2 的物质的量之比为 3∶2
时,反应的离子方程式为 2Ca2++3HCO-
3 +3OH-===2CaCO3↓+CO2-
3 +3H2O,正确;C 项,
Ca(HCO3)2 溶液与澄清石灰水反应,不论两溶液中所含溶质的比例如何,产物中都不会存在
CO2-
3 ,错误;D 项,漏掉了 NH +
4 与 OH-的反应,错误。
2.CO2 将 NaAlO2 转化为 Al(OH)3 的离子方程式:!!!!__2AlO -
2 +3H2O+CO2(适
量 )===2Al(OH)3↓ + CO 2-
3 __#### 或 !!!! __AlO -
2 + 2H2O + CO2( 过 量 )===Al(OH)3↓ +
HCO-
3 __####。
1.(1)(2016·全国卷乙)+6 价铬的化合物毒性较大,常用 NaHSO3 将废液中的 Cr2O 2-
7 还
原成 Cr3 + ,该反应的离子方程式为!!!!__Cr2O2-
7 +3HSO -
3 +5H + ===2Cr3 + +3SO 2-
4 +
4H2O__####。
(2)已知在酸性条件下 NaClO2 可发生反应生成 NaCl 并释放出 ClO2,该反应的离子方程
式为!!!!__4H++5ClO-
2 ===Cl-+4ClO2↑+2H2O__####。
(3)H2SO4 与 Fe2O3 反应的离子方程式为!!!!__Fe2O3+6H+===2Fe3++3H2O__####。
(4)用 NaOH 溶液可除去废 Al 片表面的氧化膜,反应的离子方程式为 !!!!__Al2O3+
2OH-===2AlO-
2 +H2O__####。
2.向等物质的量浓度的 NaOH 和 Na2CO3 的混合溶液中加入稀盐酸。下列离子方程式
与事实不相符的是( C )
A.OH-+CO2-
3 +2H+===HCO-
3 +H2O
B.2OH-+CO2-
3 +3H+===HCO-
3 +2H2O
C.2OH-+CO2-
3 +4H+===CO2↑+3H2O
D.OH-+CO2-
3 +3H+===CO2↑+2H2O
解析 向等物质的量浓度的 NaOH 和 Na2CO3 的混合溶液中加入盐酸,依次发生的离子
反应为 OH-+H+===H2O、CO2-
3 +H+===HCO-
3 、HCO-
3 +H+===CO2↑+H2O。再结合溶液
中 NaOH 与 Na2CO3 的物质的量相等可知:A 项,当滴入 H+的物质的量为 OH-的物质的量
2 倍时,H+完全中和 OH-后,恰好与 CO 2-
3 完全反应生成 HCO-
3 ,正确;B 项,当滴入 H+
的物质的量为 OH-的物质的量 1.5 倍时,H+完全中和 OH-后,剩余 H+可与一半的 CO 2-
3 反
应生成 HCO-
3 ,正确;C 项,结合 A 项分析,可知与事实不符,错误;D 项,当滴入 H+的
物质的量为 OH-的物质的量 3 倍时,OH-完全反应,CO 2-
3 恰好转化为 CO2 和 H2O,正确。
考点三 离子方程式的正误判断
1.看离子反应是否符合客观事实
如铁与稀硫酸反应生成!!!!__Fe2+__####而不生成 Fe3+。再如将少量 SO2 通入漂白粉
溶液中:H2O+SO2+Ca2++2ClO-===CaSO3↓+2HClO,错在忽略了 HClO 可以将+4 价的
硫氧化,应为!!!!__Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO__####。
2.看“===”“??”“↓”“↑”及必要条件是否正确、齐全
如盐类的水解离子方程式一般用“??”,电解反应的离子方程式用“=====
电解 ”。
3.看电解质拆分是否正确
(1)强酸、强碱和可溶性盐写成离子。
(2)对于微溶性的强电解质:在反应物中视情况而定,如澄清石灰水中 Ca(OH)2 以 Ca2+、
OH-存在,可拆成离子形式;在生成物中,一般不能拆,以化学式形式表示。
(3)可溶性多元弱酸酸式盐的酸式根一律保留酸式根形式,如在水溶液中 HCO -
3 写成 H+
+CO 2-
3 是不对的。
4.看电荷是否守恒
如 FeCl3 溶液与 Cu 反应,不能写成 Fe3++Cu===Fe2++Cu2+,而应写成!!!!__2Fe3++
Cu===2Fe2++Cu2+__####。
5.看是否漏掉离子反应
如 Ba(OH)2 溶液与 CuSO4 溶液反应,既要写 Ba2+与 SO 2-
4 生成 BaSO4 沉淀,又不能漏掉
Cu2+与 OH-生成 Cu(OH)2 沉淀。
6.看反应物或产物的配比是否正确
如稀硫酸与 Ba(OH)2 溶液反应不能写成 H++OH-+SO2-
4 +Ba2+===BaSO4↓+H2O,应
写成!!!!__2H++2OH-+SO2-
4 +Ba2+===BaSO4↓+2H2O__#### 。
7.是否符合题设条件及要求
如“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序等对反应的影
响。如向 FeBr2 溶液中通入少量 Cl2 的离子方程式为 2Fe2++Cl2===2Fe3++2Cl-;向 FeI2 溶
液中通入少量 Cl2 的离子方程式为!!!!__2I-+Cl2===I2+2Cl-__#### 。
1.下列离子方程式正确的是 ( C )
A.向盐酸中滴加氨水:H++OH-===H2O
B.将铜投入硫酸铁溶液中:Cu+Fe3+===Fe2++Cu2+
C.铜溶于稀硝酸:3Cu+8H++2NO-
3 ===3Cu2++2NO↑+4H2O
D.向澄清石灰水中加入少量的 NaHCO3 溶液:Ca2++2OH-+2HCO-
3 ===CaCO3↓+
CO2-
3 +2H2O
2.下列解释事实的方程式不正确的是 ( C )
A.测 0.1 mol·L-1 氨水的 pH 为 11:NH3·H2O??NH+
4 +OH-
B.将 Na 块放入水中,放出气体:2Na+2H2O===2NaOH+H2↑
C.用 CuCl2 溶液做导电实验,灯泡发光:CuCl2=====
通电
Cu2++2Cl-
D.Al 片溶于 NaOH 溶液中,产生气体:2Al+2OH-+2H2O===2AlO-
2 +3H2↑
解析 本题考查方程式的书写与正误判断,意在考查考生的理解能力与应用能力。氨水
呈弱碱性的原因是 NH3·H2O 为弱电解质,部分发生电离,正确;金属钠与水发生氧化还原
反应,生成氢氧化钠与氢气,B 项正确;氯化铜溶液能导电,是因为氯化铜为强电解质,在
溶液中完全电离,与电解无关,即 CuCl2===Cu2++2Cl-,C 项错误;金属铝与氢氧化钠溶
液发生反应,生成偏铝酸钠和氢气,D 项正确。
离子方程式正误判断的一般解题方法
突破离子方程式正误判断的“四大陷阱”
命题陷阱 1——“拆分”陷阱
离子方程式的正误判断中,常常设置物质是否能“拆分”陷阱,除强酸、强碱、可溶性
盐之外,其余物质在离子方程式中均不能拆分。在复习时,应熟记常见的弱电解质、溶解度
表及常见的多元弱酸的酸式酸根。
1.判断正误,正确的划“√”,错误的划“×”。
(1)(2016·天津卷)用 KMnO4 标准溶液滴定草酸:2MnO-
4 +16H++5C2O2-
4 ===2Mn2++
10CO2↑+8H2O。( × )
(2)氯气溶于水:Cl2+H2O??2H++Cl-+ClO-。( × )
(3)向 CuSO4 溶液中通入 H2S 气体:Cu2++S2-===CuS↓。( × )
(4)NaHCO3 溶液中加入稀盐酸:CO2-
3 +2H+===CO2↑+H2O。( × )
命题陷阱 2——“守恒”陷阱
离子方程式除符合质量守恒定律外,还应符合电荷守恒规律,即离子方程式两边离子所
带电荷总数相等。不能只注意质量守恒,而忽略电荷守恒,这也是命题者经常设置的“陷
阱”。
2.判断正误,正确的划“√”,错误的划“×”。
(1)(2016·四川卷)Fe2+与 H2O2 在酸性溶液中的反应:2Fe2+ +H2O2+2H + ===2Fe3 ++
2H2O。( √ )
(2)酸性溶液中 KIO3 与 KI 反应生成 I2:IO-
3 +I-+6H+===I2+3H2O。( × )
(3)某消毒液(NaClO)可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH-===Cl-+ClO-+H2O。
( √ )
(4)Na2S2O3 溶液中加入稀硫酸:2S2O2-
3 +4H+===SO2-
3 +3S↓+2H2O。( × )
命题陷阱 3——“原理”陷阱
离子反应应符合客观事实,而命题者往往设置不符合“反应原理”的陷阱,如 Fe 和非
氧化性酸反应生成 Fe2+,金属和氧化性酸反应不产生 H2,忽略隐含反应,不符合配比关系,
“===”“―→”使用是否正确以及反应条件等。
3.判断正误,正确的划“√”,错误的划“×”。
(1)(2016·天津卷)室温下,测得氯化铵溶液的 pH<7,证明一水合氨是弱碱:NH+
4 +
2H2O??NH3·H2O+H3O+。( √ )
(2)向 NaClO 和 NaCl 的混合溶液中滴入少量 FeSO4 溶液:2Fe2++ClO-+2H+===Cl-+
2Fe3++H2O。( × )
(3)Na2CO3 溶液中 CO 2-
3 的水解:CO2-
3 +H2O===HCO-
3 +OH-。( × )
(4)向稀 HNO3 中滴加 Na2SO3 溶液:SO2-
3 +2H+===SO2↑+H2O。( × )
命题陷阱 4——“量比”陷阱
在离子方程式正误判断中,不能忽略相对量的多少,命题者往往设置“离子方程式正确,
但不符合相对量”的陷阱。突破“陷阱”的方法一是审准“相对量”的多少,二是看离子反
应是否符合该量。
4.判断正误,正确的划“√”,错误的划“×”。
(1)(2016·四川卷)稀硫酸和 Ba(OH)2 溶液反应:H++SO2-
4 +Ba2++OH-===BaSO4↓+
H2O。( × )
(2)向 Na2SiO3 溶液中通入过量 SO2:SiO2-
3 +SO2+H2O===H2SiO3↓+SO2-
3 。( × )
(3)向 NaHCO3 溶液中加入足量 Ba(OH)2 溶液:HCO-
3 +Ba2++OH-===BaCO3↓+H2O。
( √ )
(4)Fe2(SO4)3 溶液与 Ba(OH)2 溶液反应:Fe3 + +SO 2-
4 +Ba2 + +3OH - ===Fe(OH)3↓+
BaSO4↓。( × )
[例 1] (2016·江苏卷)下列指定反应的离子方程式正确的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2NO-
3 === Cu2++2NO2↑+2H2O
B.向 Fe2(SO4)3 溶液中加入过量铁粉:Fe3++Fe===2Fe2+
C.向 Al2(SO4)3 溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+
4
D.向 Na2SiO3 溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
[答题送检]来自阅卷名师报告
错
误
致错原因
扣
分
A 不清楚稀 HNO3 被还原为 NO 还是 NO2
-
2
B 没认真检查质量、电荷是否守恒
-
2
D 不清楚 Na2SiO3 是否拆分
-
2
[解析] A 项,Cu 与稀 HNO3 反应生成 NO,错误;B 项,电荷不守恒,错误;C 项,
Al(OH)3 不溶于氨水,正确;D 项,Na2SiO3 为可溶性盐,应写成离子形式,错误。
[答案] C
1.下列离子方程式错误的是( C )
A.向 Mg(HCO3)2 溶液中加入过量的 NaOH 溶液:Mg2++2HCO-
3 +4OH-===Mg(OH)2↓
+2CO2-
3 +2H2O
B.向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO-
3 ===3BaSO4↓+2NO↑+H2O
C.在银氨溶液中滴加过量稀硝酸:[Ag(NH3)2]OH+3H+ === Ag++2NH+
4 +H2O
D.向 NH4HSO4 稀溶液中逐滴加入 Ba(OH)2 稀溶液至 SO2-
4 刚好沉淀完全: Ba2++
2OH-+NH+
4 +H++SO2-
4 ===BaSO4↓+NH3·H2O+H2O
解析 Mg(OH)2 的溶解度小于 MgCO3,故 A 项中应该生成 Mg(OH)2 沉淀,正确;亚硫
酸钡可被硝酸氧化为硫酸钡,B 项正确;在银氨溶液中滴加过量稀硝酸,发生反应的离子方
程式为[Ag(NH3)2]++2H+===Ag++2NH+
4 ,C 项错误;沉淀 1 mol SO 2-
4 需要 1 mol Ba(OH)2,2
mol OH-恰好与 1 mol NH+
4 、1 mol H+反应,D 项正确。
1.(2017·江苏卷)下列指定反应的离子方程式正确的是( B )
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O=====
通电
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO2-
4 ===BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO-
3 +OH-===CaCO3↓+H2O
解析 A 项,电荷不守恒,错误;B 项,电解饱和食盐水时,阳极生成 Cl2,阴极生成
H2 和 NaOH,正确;C 项,不符合物质的组成比,正确的离子方程式为 Ba2++2OH-+2H+
+SO2-
4 ===BaSO4↓+2H2O;D 项,NH +
4 也参与反应,正确的离子方程式为 NH+
4 +HCO-
3 +
Ca2++2OH-===CaCO3↓+NH3·H2O+H2O。
2.某消毒液的主要成分为 NaClO,还含有一定量的 NaOH,下列用来解释事实的方程
式中,不合理的是(已知:饱和 NaClO 溶液的 pH 约为 11)( B )
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的 pH 约为 12:ClO-+ H2O??HClO+ OH-
C.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++ Cl-+ ClO-=== Cl2 ↑
+ H2O
D.该消毒液加白醋生成 HClO,可增强漂白作用:CH3COOH+ClO-=== HClO+CH3COO
-
解析 已知饱和 NaClO 溶液的 pH 约为 11,这是由于 ClO-的水解,而该消毒液的 pH 约
为 12,主要是因为其中含有一定量的 NaOH,B 项错误。
考点四 离子共存
1.离子共存的条件
所谓几种离子在同一溶液中能大量共存,就是指离子之间!!!!__不发生任何反应
__####;若离子之间能!!!!__发生反应__####,则不能大量共存。
2.熟记常考离子的性质
颜色 MnO-
4 (紫)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(黄)
氧化性 ClO-、MnO-
4 、NO-
3 (H+)、Fe3+、Cr2O2-
7
还原性 S2-(HS-)、SO2-
3 (HSO-
3 )、I-、Br-、Cl-、Fe2+
水解显酸性 NH+
4 、Mg2+、Al3+、Cu2+、Fe2+、Fe3+
水解显碱性 AlO-
2 、S2-、SO2-
3 、CO2-
3 、SiO2-
3 、ClO-、CH3COO-
与 H+和 OH-均
不能大量共存
HCO-
3 、HS-、HSO-
3 、HPO2-
4 、H2PO-
4
1.水溶液中能大量共存的离子或分子组是!!!!__⑦⑩__####(填序号)。
①Al3+、Cl-、AlO-
2 、SiO2-
3 ②K+、NO-
3 、I-、H2SO3
③Na+、Fe3+、NO-
3 、CO2-
3 ④Al3+、NO-
3 、SO2-
4 、OH-
⑤H+、Na+、S2-、ClO- ⑥Fe3+、Ca2+、SCN-、NO-
3
⑦Na+、Mg2+、Cl-、SO2-
4 ⑧K+、S2O2-
3 、NO-
3 、H+
⑨Na+、Ba2+、HCO-
3 、OH- ⑩Al3+、NH+
4 、SO2-
4 、Br-
⑪Na+、Ca2+、Cl-、SO2-
4 ⑫Fe2+、H+、SO2-
3 、ClO-
2.常温下,下列各组离子在指定溶液中一定能大量共存的是!!!!__②⑤⑪__####(填
序号)。
①无色溶液中:K+、H+、MnO-
4 、HSO-
3
②澄清透明的溶液中:Cu2+、Fe3+、NO-
3 、Cl-
③石蕊呈红色的溶液中:Fe2+、NO-
3 、SO2-
4 、Na+
④pH=-lgKw 的溶液中:Na+、Al3+、NO-
3 、I-
⑤ cH+
cOH-
=1012 的溶液中:NH+
4 、Al3+、NO-
3 、Cl-
⑥水电离产生的 c(OH-)=10-13 mol·L-1 的溶液:Na+、Fe2+、NO-
3 、Cl-
⑦加入 Al 粉能放出 H2 的溶液中:Cl-、HCO-
3 、SO2-
4 、NH+
4
⑧各离子物质的量浓度相等的溶液中:K+、Na+、SO2-
4 、NO-
3
⑨能使淀粉-KI 试纸变蓝色的溶液:K+、SO2-
4 、S2-、SO2-
3
⑩c(ClO-)=1.0 mol·L-1 的溶液:Na+、I-、SO2-
4 、Cl-
⑪c(CO2-
3 )=0.1 mol·L-1 的溶液:Na+、NH+
4 、Br-、SO2-
4
⑫1.0 mol·L-1NaAlO2 溶液:H+、Al3+、Cl-、SO2-
4
⑬含有 Fe3+的溶液中:Na+、H+、SCN-、Cl-
有限制条件的离子共存的判断
(1)常见溶液酸、碱性的判断
①酸性溶液:pH<7(常温);能使 pH 试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶
液;能使石蕊试液呈红色的溶液。
②碱性溶液:pH>7(常温);能使 pH 试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;
能使酚酞试液呈红色的溶液。
③呈酸性或碱性的溶液:和 Al 反应放出 H2 的溶液(HNO3 除外);能使甲基橙呈黄色的
溶液;c 水(H+)或 c 水(OH-)等于 10-a mol·L-1(a>7)的溶液。
(2)离子共存题干中常见的限制条件
题干 分析
溶液无色
有色离子不能大量存在,如 Cu2+、Fe2+、Fe3+、MnO -
4
等
溶液 pH=1 或 pH=13
①在强酸性溶液中,OH-、弱酸根离子(CO2-
3 、SO2-
3 、
S2-等)不能大量存在;
②在强碱性溶液中,H+、NH+
4 、Fe2+、Cu2+、Mg2+等
均不能大量存在;
③酸式弱酸根离子(HCO-
3 、HSO-
3 、HS-等)在强酸性或
强碱性溶液中均不能大量存在;
④溶液 pH=1,说明溶液中含大量的 H+,当 NO -
3 存在
时会氧化 I-、Fe2+及 HS-等
溶液透明 “透明”并不代表溶液无色
与 Al 反应放出 H2 溶液可能显酸性也可能显碱性
由水电离出的
c(H+)=1×10-12 mol·L-1
溶液可能显酸性也可能显碱性
判断离子共存的“三特性”“四反应”
1.“三特性”——三种特殊情况
(1)AlO -
2 与 HCO -
3 不能大量共存:AlO-
2 +HCO-
3 +H2O===Al(OH)3↓+CO2-
3 (相当于弱酸
制更弱的酸,不是双水解)。
(2)“NO-
3 +H+”、ClO-和 MnO -
4 都有强氧化性,能氧化 Fe2+、I-、S2-、HS-、SO2-
3 、
HSO -
3 等,不能大量共存。
(3)NH +
4 与 CH3COO-(CO2-
3 )、Mg2+与 HCO -
3 等组合中,虽然存在双水解,但因水解程
度很小,它们仍可大量共存。
2.“四反应”——离子间通常进行的四种反应类型
(1)复分解反应,如反应生成沉淀、气体、弱电解质等。
(2)氧化还原反应,如 Fe3+能氧化 S2-、I-等;ClO-、MnO -
4 在酸性、中性、碱性条件下
都有强氧化性,能将 S2-、HS-、I-、SO 2-
3 等氧化。
(3)盐的双水解,以下双水解能进行到底,不能大量共存:
NH +
4 与 AlO-
2 、SiO2-
3 (2 个);
Al3+与 HCO-
3 、CO2-
3 、AlO-
2 、ClO-、S2-、HS-(6 个);
Fe3+与 HCO-
3 、CO2-
3 、AlO-
2 、ClO-(4 个)。
(4)配合反应,如 Fe3+与 SCN-等形成配合物。
[例 1] (2017·江苏卷)常温下,下列各组离子在指定溶液中能大量共存的是( B )
A.无色透明的溶液中:Fe3+、Mg2+、Cl-、SCN-
B. cH+
cOH-
=1×10-12 的溶液中:K+、Na+、CO2-
3 、NO-
3
C.c(Fe2+)=1 mol·L-1 的溶液中:K+、NH+
4 、MnO-
4 、SO2-
4
D.能使甲基橙变红的溶液中:Na+、NH+
4 、SO2-
4 、HCO-
3
解析 Fe3++3SCN-??Fe(SCN)3 使溶液呈血红色,A 项错误;Fe2+水解使溶液呈酸性,酸
性条件下 MnO -
4 与 Fe2+不能大量共存,C 项错误;使甲基橙变红的溶液呈酸性,H+与 HCO-
3
不能大量共存,D 项错误。
[例 1] 常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO2-
4 、Cl-
B. Kw
cH+
=1×10-13 mol·L-1 的溶液中:NH+
4 、Ca2+、Cl-、NO-
3
C.与 Al 反应能放出 H2 的溶液中:Fe2+、K+、NO-
3 、SO2-
4
D.水电离的 c(H+)=1×10-13 mol·L-1 的溶液中:K+、Na+、AlO-
2 、CO2-
3
[答题送检]来自阅卷名师报告
错
误
致错原因
扣
分
A 不能有效挖掘隐含信息
-
2
C
与 Al 反应放出 H2 的溶液含有大量的 H+或 OH-,若含 H+,忽略了 NO-
3
的氧化性
-
2
D
由 c(H+)水=1.0×10-13mol·L-1 推断出溶液是碱溶液,忽略了酸溶液的
可能
-
2
[解析] 本题考查离子共存,意在考查考生对化学反应规律的理解能力。使酚酞变红色
的溶液显碱性,Al3+不能大量存在,A 项错误;c(OH-)=1×10-13 mol·L-1,即溶液的 pH=1,
显酸性,题中给出的四种离子可以大量共存,B 项正确;与 Al 反应放出 H2 的溶液可能显酸
性,也可能显碱性,若显酸性,NO -
3 会氧化 Fe2+,若显碱性,OH-与 Fe2+会生成 Fe(OH)2
沉淀,C 项错误;水电离的 c(H+)=1×10-13 mol·L-1,则水的电离受到抑制,可能是酸溶液
或碱溶液,若为酸溶液,则 AlO-
2 、CO 2-
3 均与 H+反应,不能大量共存,D 项错误。
[答案] B
1.下列分子或离子在指定的分散系中能大量共存的一组是( A )
A.银氨溶液:Na+、K+、NO-
3 、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、SO2-
4 、葡萄糖分子
解析 B 项,NO 在空气中会与 O2 反应生成 NO2;C 项,S2-和 H+不能大量共存,且当
H+与 Fe(OH)3 胶体混合后,H+会与 Fe(OH)3 胶体反应生成 Fe3+,同时 Fe3+与 S2-也会反应;
D 项,在 KMnO4(含 H+)溶液中,葡萄糖分子易被氧化。
1.(2016·江苏卷)制备(NH4)2Fe(SO4)2·6H2O 的实验中,需对过滤出产品的母液(pH<1)进
行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子
正确的是( D )
A.通入过量 Cl2:Fe2+、H+、NH+
4 、Cl-、SO2-
4
B.加入少量 NaClO 溶液:NH+
4 、Fe2+、H+、SO2-
4 、ClO-
C.加入过量 NaOH 溶液:Na+、Fe2+、NH+
4 、SO2-
4 、OH-
D.加入过量 NaClO 和 NaOH 的混合溶液:Na+、SO2-
4 、Cl-、ClO-、OH-
2.某无色溶液含有下列离子中的若干种:H+、NH+
4 、Fe3+、Ba2+、Al3+、CO2-
3 、Cl-、
OH-、NO-
3 。向该溶液中加入铝粉,只放出 H2,则溶液中能大量存在的离子最多有( C )
A.3 种 B.4 种
C.5 种 D.6 种
解析 由溶液无色可知一定不含 Fe3+。加入 Al 放出氢气则说明该溶液中含有大量 H+或
OH-,若存在大量 H+,则溶液中可能大量存在 NH+
4 、Ba2+、Al3+、Cl-,共 5 种;若存在大
量 OH-,根据溶液为电中性,则溶液中可能大量存在 Ba2+、Cl-、NO-
3 ,共 4 种。
考点五 离子的检验和推断
1.常见离子的三种检验方法
根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种
类型:①生成沉淀;②生成气体;③显现特殊颜色。
离子 试剂 现象
沉淀 Cl-、Br-、 AgNO3 溶液和稀 HNO3 AgCl(白色)、AgBr(淡黄
法 I- 色)、AgI(黄色)
SO2-
4 稀盐酸和 BaCl2 溶液 白色沉淀
Fe2+ NaOH 溶液
白色沉淀→灰绿色沉淀
→红褐色沉淀
Fe3+ NaOH 溶液 红褐色沉淀
气体
法
NH+
4
浓 NaOH 溶液和湿润的
红色石蕊试纸
产生有刺激性气味的气
体,且气体能使湿润的红色石
蕊试纸变蓝(要加热)
CO2-
3 、
HCO-
3
稀盐酸和澄清石灰水
无色无味的气体通入澄
清石灰水变浑浊
SO2-
3 、
HSO-
3
稀 H2SO4 和品红溶液
产生有刺激性气味的气
体,且气体能使品红溶液褪色
显色
法
I- 氯水(少量),CCl4 下层为紫色
Fe2+
①KSCN 溶液和氯水
②铁氰化钾溶液
K3[Fe(CN)6]
①先是无变化,滴加氯水
后变血红色
②生成蓝色沉淀
Fe3[Fe(CN)6]2
Fe3+ KSCN 溶液 血红色
苯酚溶液 紫色
Na+、K+ Pt(Fe)丝和稀盐酸
火焰分别呈黄色、紫色(K
+要透过蓝色钴玻璃观察焰
色)
1.判断正误,正确的划“√”,错误的划“×”。
(1)向某溶液中滴入 BaCl2 溶液,产生白色沉淀,再加入稀 HNO3,白色沉淀不溶解,溶
液中一定存在 SO2-
4 。( × )
(2)向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,溶液中一定存在 CO2-
3 。
( × )
(3)做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素。
( × )
(4)向某溶液中滴加氯水,再加入 KSCN 溶液,溶液变血红色,则溶液中一定存在 Fe2+。
( × )
2.(2018·吉林四平模拟)某溶液中可能存在 Br-、CO2-
3 、SO2-
3 、Al3+、I-、Mg2+、Na+
等 7 种离子中的某几种。现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,
溶液变橙黄色,且有无色气泡冒出;②向所得橙色溶液中加入足量 BaCl2 溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的
离子组是( A )
A.Al3+、Mg2+、I-、SO2-
3 B.Mg2+、Na+、CO2-
3 、I-
C.Al3+、Na+、SO2-
3 、I- D.Na+、CO2-
3 、Br-、I-
解析 ①向溶液中滴加足量氯水后,溶液变橙黄色,且有无色气泡冒出,则溶液中含有
Br-、CO2-
3 ,由于 CO 2-
3 与 Al3+、Mg2+会发生反应而不能大量共存,所以溶液中一定不存在
Al3+、Mg2+;②若原溶液中含有 SO2-
3 ,加入氯水时会被氧化为 SO2-
4 ,再加入足量 BaCl2 溶
液,就会有沉淀生成,因此不存在 SO2-
3 ;③由于氯水会把 I-氧化为 I2,继续滴加淀粉溶液,
溶液就会变蓝色,因此该实验证明不存在 I-。由于溶液呈电中性,所以还有阳离子 Na+。故
通过上述实验证明在溶液中一定存在 Br-、CO2-
3 、Na+,一定不存在 Al3+、Mg2+、I-、SO2-
3 。
故选 A 项。
一 离子推断的四项基本原则
[例 1] (2018·宜昌调研)某溶液中可能含有 H+、NH+
4 、Mg2+、Al3+、Fe3+、CO2-
3 、SO2-
4 、
NO -
3 中的几种。
①若加入锌粒,产生无色无味的气体;②若加入 NaOH 溶液,产生白色沉淀,且产生
的沉淀量与加入 NaOH 的物质的量之间的关系如图所示。则下列说法正确的是( D )
A.溶液中的阳离子只有 H+、Mg2+、Al3+
B.n(H+):n(Al3+):n(Mg2+)=1:1:1
C. 溶液中一定不含 CO2-
3 ,可能含有 SO 2-
4 和 NO-
3
D.溶液中,n(NH+
4 )=0.2 mol
解析 ①加入锌粒,产生无色无味气体,该溶液应为酸性,气体是氢气,排除 CO 2-
3 和
NO-
3 ,根据电荷守恒,溶液中有 SO2-
4 ;②加入 NaOH 溶液,产生白色沉淀,排除 Fe3+;根
据图像知,n(H+)=0.1 mol,n(Al3+)=0.1 mol,n(NH+
4 )=0.2 mol,n(Mg2+)=0.05 mol,故 D
项正确。
二 离子检验实验操作应注意的事项
1.反应要在适宜的条件下进行,如溶液的酸碱性、浓度、温度的选择。
2.离子检验时常需排除干扰,离子检验中的干扰离子以及排干扰措施。
待检离子 干扰离子 排干扰措施
Cl- SO2-
4 加过量 Ba(NO3)2 溶液
CO2-
3 、OH- 加稀硝酸酸化
SO2-
4 CO2-
3 、SO2-
3 、Ag+ 加盐酸酸化
CO2-
3 SO2-
3
加盐酸后将产生的气体先通入酸性高锰
酸钾溶液,再通入澄清石灰水
SO2-
3 CO2-
3 加盐酸后将产生的气体通入品红溶液
3.检验反应要求具有一定的选择性和特效性,如用品红溶液检验 SO2,用 KSCN 溶液
检验 Fe3+,用湿润的红色石蕊试纸检验 NH3。
[例 2] 已知:5SO2-
3 +2IO-
3 +2H+===I2+5SO2-
4 +H2O。某含碘废水(pH 约为 8)中一定存
在 I2,可能存在 I-、IO -
3 中的一种或两种。请补充完整检验含碘废水中是否含有 I-、IO -
3 的
实验方案:取适量含碘废水用 CCl4 多次萃取、分液,直到水层用淀粉溶液检验不出有碘单
质存在;!!!!__从水层取少量溶液,加入 1~2_mL 淀粉溶液,加盐酸酸化,滴加 FeCl3 溶
液,若溶液变蓝,说明废水中含有 I-,若溶液不变蓝,说明废水中不含 I-;另从水层取少
量溶液,加入 1~2_mL 淀粉溶液,加盐酸酸化,滴加 Na2SO3 溶液,若溶液变蓝,说明废水
中含有 IO-
3 ,若溶液不变蓝,说明废水中不含 IO-
3 __####(实验中可供选择的试剂:稀盐酸、
淀粉溶液、FeCl3 溶液、Na2SO3 溶液)。
解析 检验 I-的原理是用 FeCl3 溶液氧化 I-生成 I2,用淀粉检验 I2;检验 IO -
3 的原理是
用 Na2SO3 溶液还原 IO -
3 生成 I2,再用淀粉检验 I2。因溶液呈碱性,I2+2OH-===I-+IO-+
H2O,所以在检验之前应先用盐酸酸化。
[例 1] 雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离
子:Na+、NH+
4 、Mg2+、Al3+、SO2-
4 、NO-
3 、Cl- 。某同学收集了该地区的雾霾,经必要的
预处理后得试样溶液,设计并完成了如下的实验:
已知:3NO-
3 +8Al+5OH-+2H2O=====
△
3NH3+8AlO-
2 。
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在 NH+
4 、Mg2+、SO 2-
4 和 NO-
3
B.试样中一定不含 Al3+
C.试样中可能存在 Na+、Cl-
D.该雾霾中可能存在 NaNO3 、NH4Cl 和 MgSO4
[答题送检]来自阅卷名师报告
错
误
致错原因
扣
分
A 没找到证明有无 Mg2+的依据
-
6
C
不知 Na+、Cl-的存在对溶液中的其他离子有无影
响
-
6
[解析] 加入过量 Ba(OH)2 溶液、加热,放出遇湿润红色石蕊试纸变蓝色的气体 1 为 NH3,
说明试样中含有 NH+
4 ;沉淀 1 部分溶解于酸中,可知试样中一定含有 SO2-
4 、Mg2+(Al3+与过
量氢氧化钡溶液不能得到氢氧化铝沉淀);滤液 1 通入 CO2 得到沉淀说明滤液 1 中可能含有
AlO-
2 ,则试样中可能含有 Al3+;再利用溶液 2 加入 Al/OH-可放出 NH3,结合题干可知,原
试样中含有 NO-
3 ,Cl-、Na+的存在对实验无影响,因此试样中也可能含有 Cl-、Na+。综上
所述,结合选项可知 B 项判断错误。
[答案] B
1.在 Na+浓度为 0.5 mol·L-1 的某澄清溶液中,还可能含有下表中的若干种离子。
阳
离子
K+、Ag+、Mg2+、Ba2+
阴
离子
NO-
3 、CO2-
3 、SiO2-
3 、SO2-
4
取该溶液 100 mL 进行如下实验(气体体积均在标准状况下测定):
序
号
实验内容 实验结果
Ⅰ 向该溶液中加入足量稀盐酸
产生白色沉淀并放出 0.56 L 气
体
Ⅱ
将 Ⅰ 的反应混合液过滤,对沉淀
洗涤、灼烧至恒重,称量所得固体质量
固体质量为 2.4 g
Ⅲ 在Ⅱ的滤液中滴加 BaCl2 溶液 无明显现象
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的阳离子是!!!!__Ag+、Mg2+、Ba2+__####。
(2)实验Ⅰ中生成沉淀的离子方程式为!!!!__SiO2-
3 +2H+===H2SiO3↓__####。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算
结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
阴离子 N
O-
3
CO
2-
3
SiO
2-
3
SO
2-
4
c/(mol·L-
1)
如表
阴离子 N
O-
3
CO
2-
3
SiO
2-
3
SO
2-
4
c/(mol·L-1) ? 0.2
5
0.4 0
(4)判断 K+是否存在,若存在求出其最小浓度,若不存在说明理由:!!!!__存在,最小
浓度为 0.8_mol·L-1__####。
电荷守恒在离子反应定量推断试题中的应用
解与离子反应有关的定量推断类试题,需要掌握定量推断最后一种离子存在的方法:如
果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是
否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
1.下列关于物质或离子检验的叙述正确的是( B )
A.在溶液中加 KSCN,溶液显红色,证明原溶液中有 Fe3+,无 Fe2+
B.气体通过无水 CuSO4 粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有 Na+,无 K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是 CO2
2.某溶液可能含有 Cl-、SO2-
4 、CO2-
3 、NH+
4 、Fe3+、Al3+ 和 K+ 。取该溶液 100 mL,
加入过量 NaOH 溶液,加热,得到 0.02 mol 气体,同时产生红褐色沉淀,过滤,洗涤,灼
烧,得到 1.6 g 固体;向上述滤液中加入足量 BaCl2 溶液,得到 4.66 g 不溶于盐酸的沉淀。
由此可知原溶液中( B )
A.至少存在 5 种离子
B.Cl- 一定存在,且 c(Cl-)≥0.4 mol/L
C.SO2-
4 、NH +
4 一定存在,Cl- 可能不存在
D.CO2-
3 、Al3+ 一定不存在,K+可能存在
解析 根据加入过量 NaOH 溶液,得到 0.02 mol 气体,说明溶液中含有 0.02 mol NH+
4 ;
同时产生红褐色沉淀,说明溶液中含有 Fe3+,且为 0.02 mol,则不含 CO2-
3 ;根据“得到 4.66
g 不溶于盐酸的沉淀”,说明溶液中含有 SO2-
4 ,其物质的量为 0.02 mol,则根据电荷守恒可
知溶液中一定有 Cl-,至少有 0.04 mol,B 项正确。
课时达标 第 5 讲
1.下列离子方程式书写正确的是( B )
A.Cl2 通入水中:Cl2+H2O===2H++Cl-+ClO-
B.双氧水加入稀硫酸和 KI 溶液:H2O2+2H++2I-===I2+2H2O
C.用铜作电极电解 CuSO4 溶液:2Cu2++2H2O=====
电解
2Cu+O2↑+4H+
D.Na2S2O3 溶液中加入稀硫酸:2S2O2-
3 +4H+===SO2-
4 +3S↓+2H2O
2.下列解释事实的方程式不正确的是( C )
A.用浓盐酸检验氨:NH3+HCl===NH4Cl
B.碳酸钠溶液显碱性:CO2-
3 +H2O??HCO-
3 +OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2===CaCO3↓+H2O
解析 A 项,盐酸具有挥发性,挥发出的 HCl 与氨气反应生成氯化铵,冒白烟,正确;
B 项,碳酸钠是强碱弱酸盐,溶液中存在 CO 2-
3 的水解平衡:CO2-
3 +H2O??HCO-
3 +OH-,使
溶液呈碱性,正确;C 项,钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为 Fe-2e-===Fe2
+,错误;D 项,石灰水与空气中的二氧化碳反应生成碳酸钙,正确。
3.下列各组离子或分子能大量共存,当加入相应试剂后,发生反应的离子方程式书写
正确的是( B )
选项 离子或分子 加入试剂
加入试剂后发生反应的
离子方程式
A NH+
4 、Fe2+、SO2-
4 少量 Ba(OH)2 溶液
2NH+
4 +SO2-
4 +Ba2++
2OH-===BaSO4↓+
2NH3·H2O
B Na+、OH-、Cl- 少量 Mg(HCO3)2 溶 Mg2++2HCO-
3 +4OH-
液 ===2H2O+Mg(OH)2↓+
2CO2-
3
C
K+、NH3·H2O、
CO2-
3
通入少量 CO2
2OH-+CO2===CO2-
3 +
H2O
D
Fe2+、NO-
3 、
HSO-
3
NaHSO4 溶液 HSO-
3 +H+===SO2↑+
H2O
解析 A 项中的各离子能大量共存,但加入少量 Ba(OH)2 溶液时,OH-先与 Fe2+反应,
故反应的离子方程式为 Fe2++SO2-
4 +Ba2++2OH-===BaSO4↓+Fe(OH)2↓,A 项不正确;B
项中的各离子能大量共存,加入少量 Mg(HCO3)2 溶液后,OH-与 Mg2+及 HCO -
3 都发生了反
应,B 项正确;C 项中的离子和分子也能大量共存,通入少量 CO2 时,CO2 与 NH3·H2O 反
应,正确的离子方程式为 2NH3·H2O+CO2===2NH+
4 +CO2-
3 +H2O,C 项不正确;D 项中的
离子不能大量共存,因为 HSO -
3 使溶液呈酸性,酸性条件下,NO -
3 可将 Fe2+氧化,D 项不
正确。
4.下列对应化学反应的离子方程式书写正确的是( C )
A.用 KIO3 氧化酸性溶液中的 KI:5I-+IO-
3 +3H2O===3I2+6OH-
B.向 NH4HCO3 溶液中加入过量 NaOH 溶液并加热:NH+
4 +OH-=====
△
NH3↑+H2O
C.将过量 SO2 通入冷氨水中:SO2+NH3·H2O===HSO-
3 +NH+
4
D.Ba(OH)2 溶液中逐滴加入一定物质的量浓度的 NaHSO4 溶液,当溶液中的 OH-恰好
反应一半时:Ba2++2OH-+2H++SO2-
4 ===BaSO4↓+2H2O
5.下列离子方程式书写正确的是( C )
A.等物质的量的 Ba(OH)2 与明矾溶液混合:3Ba2++6OH-+2Al3++3SO2-
4 ===3BaSO4↓
+2Al(OH)3↓
B.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
C.H182 O 中投入 Na2O2 固体:2H182 O+2O2-
2 ===4OH-+18O2↑
D.CuCl2 溶液中加入 NaHS 溶液:Cu2++2HS-+2H2O===Cu(OH)2↓+2H2S↑
解析 A 项,因 Ba2++SO2-
4 ===BaSO4↓,3OH-+Al3+===Al(OH)3↓,所以等物质的量
的 Ba(OH)2 与 明 矾 [KAl(SO4)2·12H2O] 溶 液 混 合 : 3Ba2 + + 6OH - + 2Al3 + +
3SO2-
4 ===3BaSO4↓+2Al(OH)3↓,正确;B 项,因生成的 Fe3+能与 I-发生氧化还原反应:
2Fe3++2I-===2Fe2++I2,错误;C 项,因氧化物在离子方程式中不能拆开,Na2O2 应写化学
式,且应生成 O2,错误;D 项,因 Cu2+与 HS-不会发生双水解,而发生反应:Cu2++HS-
===CuS↓+H+,错误。
6.下列有关离子检验的叙述正确的是( C )
选 操作及现象 结论
项
A
取少量溶液于试管中,滴加 BaCl2 溶液,有白色沉
淀生成,加稀硝酸沉淀不溶解
溶液中含有 Ag+或
SO2-
4
B
取少量溶液于试管中,滴加新制氯水,溶液由无
色变为黄色
溶液中含有 Br-
C
取少量溶液于试管中,滴加浓氢氧化钠溶液,微
热,试管口湿润的红色石蕊试纸变蓝
溶液中含有 NH+
4
D
取少量溶液于试管中,滴加新制氯水后再滴加
KSCN 溶液,溶液变红色
原溶液中含有 Fe2+
7.水溶液 X 中只可能溶有 K+、Mg2+、Al3+、AlO-
2 、SiO2-
3 、SO2-
3 、CO2-
3 、SO 2-
4 中的
若干种离子(水电离出的 H+、OH-忽略不计)。某同学对该溶液进行了如下实验:
下列判断正确的是( B )
A.沉淀甲是硅酸和硅酸镁的混合物
B.K+、AlO -
2 和 SiO 2-
3 一定存在于溶液 X 中
C.气体甲一定是纯净物
D.CO 2-
3 和 SO 2-
4 一定不存在于溶液 X 中
解析 加盐酸有气体产生说明溶液中一定含有 CO2-
3 、SO 2-
3 中的至少一种离子,生成的
气体可以是 CO2 或是 SO2 或是二者的混合物,一定不存在和 CO 2-
3 或 SO 2-
3 不能大量共存的
离子,所以不存在 Mg2+、Al3+,加盐酸有沉淀,说明一定有 SiO2-
3 ,硅酸是沉淀,加入过量
氨水(提供 OH-)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在 Al3+,但是原来溶
液中的 Al3+一定不能存在,所以该 Al3+是 AlO -
2 和盐酸反应生成的,所以一定存在 AlO-
2 ,
要保证溶液电中性,只有 K+这一种阳离子,所以一定存在 K+。根据上述推断,溶液中一定
含有 K+、AlO -
2 和 SiO2-
3 ,B 项正确。
8.(2018·黄冈高三第一次模拟)A、B、C、D 四种物质,分别含有下列阴、阳离子:Na
+、Ba2+、Al3+、NH+
4 、SO2-
4 、HCO-
3 、NO-
3 、OH-中的各一种。为了判断其各自的组成,进
行了如下实验,部分现象如下:
①常温下用 pH 计测量发现 A、C 溶液显碱性,且 0.1 mol·L-1 C 溶液的 pH>13;
②A 与 B、C 混合均有白色沉淀产生,且 A 与 B 混合还有气体生成;
③过量的 C 滴入 B、D 中,前者产生沉淀,后者产生刺激性气味的气体。
请回答下列问题:
(1)A 为!!!!__NaHCO3__####,检验 A 中阳离子的实验名称是!!!!__焰色反应__####。
(2)A 与 B 反应的离子方程式为!!!!__Al3++3HCO-
3 ===Al(OH)3↓+3CO2↑__####。
(3)B 与过量的 C 反应生成的沉淀为!!!!__BaSO4__####。
(4)经判断 NO -
3 存在于物质!!!!__D__####(填“A”“B”“C”或“D”)中,为了测定该溶液中
NO -
3 的浓度,进行了以下实验:
取 20.00 mL 该溶液于锥形瓶中,加入过量的 25.00 mL 0.900 0 mol·L-1 的 FeSO4 溶液和
适量的稀 H2SO4 溶液,并加入 3 g NaHCO3 固体,除去空气,反应完全后再加入几滴二苯胺
磺酸钠指示剂,用浓度为 0.120 0 mol·L-1 的 K2Cr2O7 溶液滴定至终点,重复三次平均消耗体
积为 21.25 mL(发生的反应依次为 NO-
3 +Fe2++H+―→NO↑+Fe3++H2O,Fe2++Cr2O2-
7 +H
+―→Cr3++Fe3++H2O,未配平)。计算该溶液中 NO -
3 的浓度为!!!!__0.120_0_mol·L-
1__####(计算结果保留四位有效数字),如果没有加入 NaHCO3 固体,会使测定结果!!!!__
偏高__####(填“偏高”“偏低”或“无影响”)。
解析 (4)与 NO -
3 反应消耗的 n(Fe2+)=(0.9×25×10-3-6×0.12×21.25×10-3) mol=
7.2×10-3 mol,由关系式 NO-
3 ~3Fe2+知,n(NO-
3 )=1
3n(Fe2+)=2.4×10-3 mol,c(NO-
3 )=
2.4×10-3 mol
20×10-3 L
=0.120 0 mol·L-1。
9.有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的 H+、
OH-):H+、NH+
4 、K+、Mg2+、Cu2+、Al3+、NO-
3 、CO2-
3 、SO2-
4 ,现取三份 100 mL 溶液进
行如下实验:
①第一份加足量 AgNO3 溶液后,有白色沉淀产生。
②第二份加足量 BaCl2 溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为 6.99 g。
③第三份逐滴滴加 NaOH 溶液,测得沉淀与 NaOH 溶液的体积关系如图。
根据上述实验,回答以下问题。
(1)原溶液确定含有 Mg2+、Al3+、NH+
4 ,其物质的量之比 n(Mg2+)∶n(Al3+)∶n(NH+
4 )=!!!!
__1∶1∶2__####。
(2)实验过程中所加的 NaOH 物质的量浓度 c(NaOH)=!!!!__2__####mol·L-1。
(3) 原 溶 液 中 NO -
3 的 物 质 的 量 为 n(NO -
3 ) , 则 n(NO -
3 ) 的 取 值 范 围 为 !!!!
__n(NO-
3 )≥0.01_mol__####。
解析 本溶液是无色透明的,故 Cu2+一定不存在;①第一份加足量 AgNO3 溶液后,有
白色沉淀产生,推断溶液中一定有 CO2-
3 、SO 2-
4 两种中的一种。通过图像知含有 Al3+,铝离
子和碳酸根离子发生双水解,不能共存,所以推断溶液中一定不含 CO2-
3 ,一定含有 SO2-
4 ;
②第二份加足量 BaCl2 溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为 6.99 g,推
断生成 3×10-2 mol BaSO4,所以 n(SO2-
4 )=3×10-2 mol;③第三份逐滴滴加 NaOH 溶液,
测得沉淀与 NaOH 溶液的体积关系,通过图像知,在加入过量的氢氧化钠的过程中,一开
始就有沉淀生成,说明不含 H+,沉淀部分溶解,推断一定含有 Al3+;图像中有一段平台,
加入 OH-时无沉淀生成,说明有 NH+
4 :NH+
4 +OH-===NH3·H2O;最后溶液中仍有沉淀,说
明溶液中含 Mg2+,通过此实验无法判断是否含有 K+。(1)原溶液确定含有 Mg2+、Al3+、NH+
4 ,
由图像可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且 n[Mg(OH)2]+n[Al(OH)3]=0.02
mol,沉淀最小时,为氢氧化镁,故 n[Mg(OH)2]=0.01 mol,故 n[Al(OH)3]=0.02 mol-
0.01 mol=0.01 mol,根据铝原子守恒可知 n(Al3+)=n[Al(OH)3]=0.01 mol,根据 Al3++3OH
-===Al(OH)3↓,需 0.03 mol OH-;根据镁原子守恒可知原溶液中 n(Mg2+)=n[Mg(OH)2]
=0.01 mol,根据 Mg2++2OH-===Mg(OH)2↓,需 0.02 mol OH-;生成沉淀最大量时需 0.05
mol OH-,由图像可知消耗 25 mL NaOH,所以 c(NaOH)=n/V=0.05 mol
0.025 L
=2 mol·L-1;根据
NH+
4 +OH-===NH3·H2O,可得到 NH +
4 的物质的量为 0.01 L×2 mol·L-1=0.02 mol,所以可
得到 n(Mg2+)∶n(Al3+)∶n(NH+
4 )=0.01 mol∶0.01 mol∶0.02 mol=1∶1∶2。(2)根据(1)的分
析知:c(NaOH)=n/V=0.05 mol/0.025 L=2 mol/L。(3)根据电荷守恒,阳离子的电荷总数
为 n(Mg2+)×2+n(Al3+)×3+n(NH+
4 )×1+n(K+)×1=0.07 mol+n(K+),阴离子的电荷总数
为 n(SO2-
4 )×2+n(NO-
3 )×1=3×10-2 mol×2+n(NO-
3 ),阳离子的电荷总数等于阴离子所带
的电荷总数,0.07 mol+n(K+)=3×10-2 mol×2+n(NO-
3 ),因 K+不能和中学常见物质反应
产生特殊现象,只能用焰色反应进行判断,故该实验无法判断 K + 是否存在,所以
n(NO-
3 )≥0.01 mol。
10.溶液 A 中存在 Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO-
3 、CO2-
3 、Cl-、NO-
3 、SO 2-
4
中的五种离子,浓度均为 0.1 mol·L-1,溶液体积为 1 L。对溶液 A 进行以下实验,整个过程
如图所示(部分产物省略),溶液 B 与溶液 A 中所含阴离子种类相同。
请回答下列问题。
(1)溶液 A 中含有的阴离子是!!!!__Cl-、NO-
3 、SO2-
4 __####。
(2)反应①的离子方程式是!!!!__3Fe2++4H++NO-
3 ===3Fe3++NO↑+2H2O__####。
(3)固体 C 可能是!!!!__ABC__####(填字母)。
A.MgO B.Mg(OH)Cl
C.MgCO3 D.MgCl2
理由是!!!!__Fe3++3H2O??Fe(OH)3+3H+,消耗 H+,平衡正移__####(用必要的化学
用语及文字表示)。
(4)气体甲、气体乙造成的环境问题有!!!!__酸雨或光化学烟雾(合理即可)__####(写出
其中一个即可)。
(5)若向原溶液中加入足量的 NaOH 溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧
至恒重,得到固体的质量为!!!!__12__####g。
解析 结合框图分析,HCO -
3 和 CO 2-
3 能与盐酸反应,生成 CO2 气体,但是 CO2 在空气
中不能转化为其他气体;Fe2+、NO -
3 和 H+反应生成 NO 气体,NO 在常温下与空气中的 O2
反应生成 NO2 气体,符合题目要求,据此判断溶液 A 中含有 Fe2+、NO-
3 ,因为 HCO-
3 、CO2-
3
均不能与 Fe2+大量共存,所以溶液 A 中不存在 HCO -
3 和 CO2-
3 。因为溶液 A 和溶液 B 中所
含阴离子种类相同,所以溶液 A 中必定含有 Cl-。又因为溶液 A 中含有五种离子,且浓度
均为 0.1 mol·L-1,所以溶液 A 中含有 SO2-
4 ,则一定不含 Ba2+。根据电荷守恒知,溶液 A
中含有的另一种阳离子 Mg2+。(5)若向原溶液中加入足量的 NaOH 溶液,将沉淀过滤、洗涤、
干燥并灼烧至恒重,得到的固体为 MgO 和 Fe2O3,根据 Mg 元素和 Fe 元素守恒得固体质量
为 0.1 mol·L-1×1 L×40 g·mol-1+0.1 mol·L-1×1 L×1
2
×160 g·mol-1=12 g。