2018届一轮复习人教版原子结构与性质学案(3)
第41讲 原子结构与性质
考纲要求
1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解电子在原子轨道之间的跃迁及其简单应用。
4.了解电负性的概念并能用以说明元素的某些性质。
考点一 原子核外电子排布
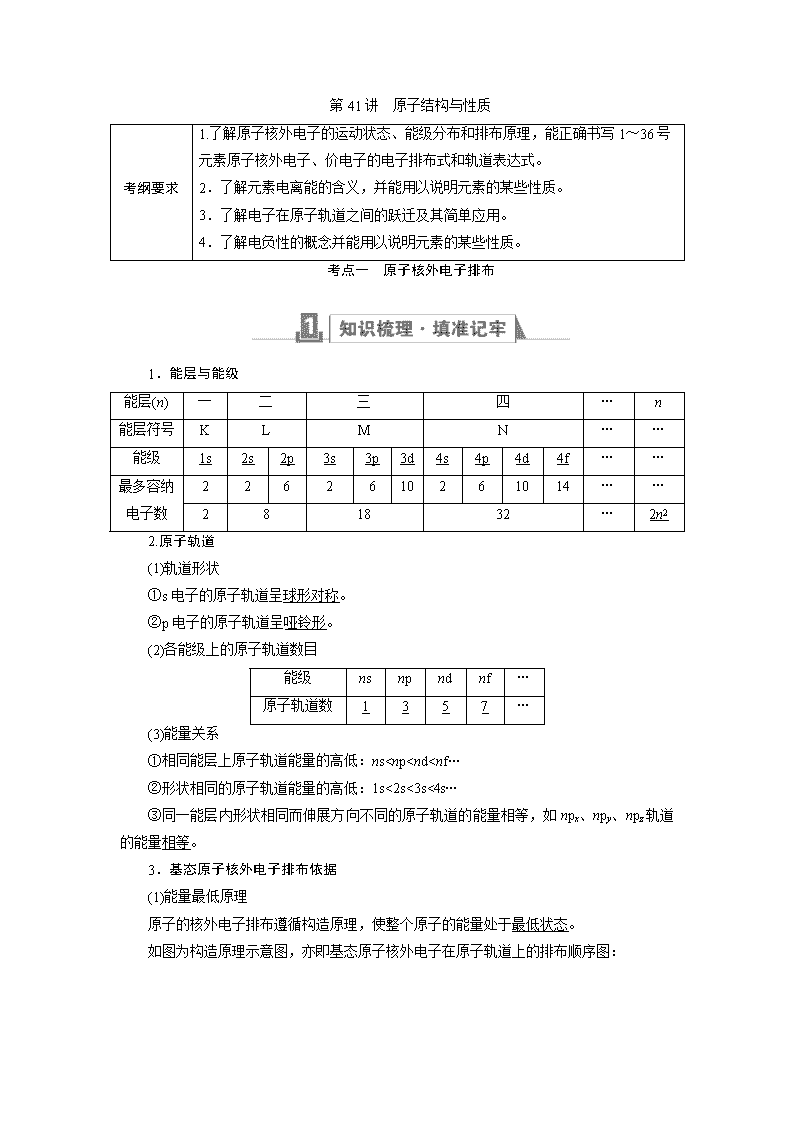
1.能层与能级
能层(n)
一
二
三
四
…
n
能层符号
K
L
M
N
…
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
…
最多容纳电子数
2
2
6
2
6
10
2
6
10
14
…
…
2
8
18
32
…
2n2
2.原子轨道
(1)轨道形状
①s电子的原子轨道呈球形对称。
②p电子的原子轨道呈哑铃形。
(2)各能级上的原子轨道数目
能级
ns
np
nd
nf
…
原子轨道数
1
3
5
7
…
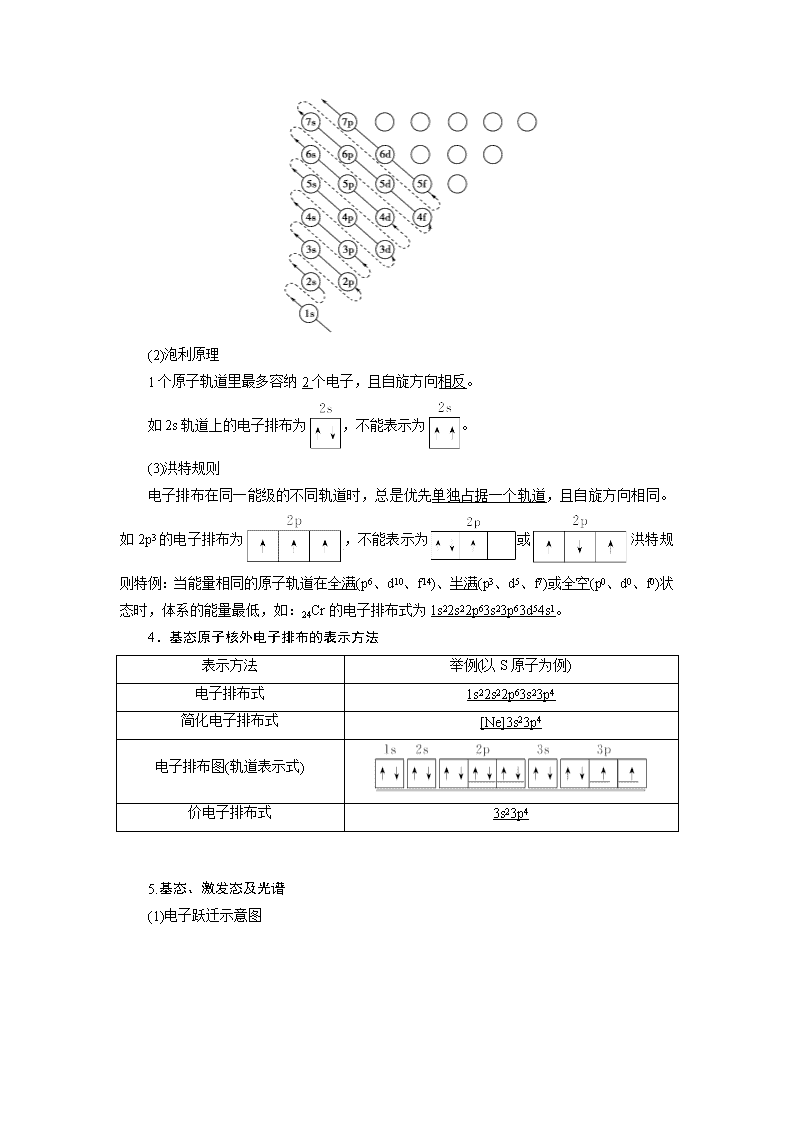
(3)能量关系
①相同能层上原子轨道能量的高低:ns
Mg>Ca,最小范围应为0.9~1.5。
③根据已知条件及表中数值:Li3N的电负性差值为2.0,大于1.7形成离子键,为离子化合物;BeCl2、AlCl3、SiC的电负性差值分别为1.5、1.5、0.7,均小于1.7,形成共价键,为共价化合物。共价化合物和离子化合物最大的区别在于熔融状态下能否导电。离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物却不能。
答案: (1)①Na Mg ②五 ⅠA
(2)①随着原子序数的递增,元素的电负性与原子半径一样呈周期性变化 ②0.9~1.5
③Ⅰ.A Ⅱ.B、C、D 测定各物质在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物
课时训练 原子结构与性质
1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
解析: A项只能表示最外层电子数,B项只表示核外的电子分层排布情况,C项具体到能级上的电子数,而D项包含了能层、能级、轨道以及轨道内电子的自旋方向,故该项正确。
答案: D
2.在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道的电子能量一定高于s轨道的电子能量
D.在离核最近区域内运动的电子能量最低
答案: C
3.下列关于价电子构型为4s24p4的原子的描述正确的是( )
A.其电子排布式为1s22s22p63s23p64s23d104p4
B.其价电子排布图为
C.其4p轨道电子排布图为
D.其电子排布式可以简化为[Ar]3d104s24p4
解析: A项,其基态原子电子排布式为
1s22s22p63s23p63d104s24p4,错误;B项,违反了洪特规则,错误;C项,违反了泡利原理,错误;D正确。
答案: D
4.(2016·河北衡水质检)下列有关电子排布图的表述正确的是( )
A. 可表示单核10电子粒子基态时电子排布
B. 此图错误,违背了泡利原理
C. 表示基态N原子的价电子排布
D. 表示处于激发态的B的电子排布图
解析: A.单核10电子粒子基态时电子排布式为1s22s22p6,每个轨道内排布2个电子,自旋方向相反,正确;B.此图违背了洪特规则,错误;C.正确的价电子排布图为,错误;D.该电子排布图中的电子没有激发跃迁到能量更高的轨道上,错误。
答案: A
5.(2016·辽宁沈阳质检)下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D.最外层都只有一个电子的X、Y原子
解析: 原子核外电子排布式为1s2的X原子是He,原子核外电子排布式为1s22s2的Y原子是Be,二者的性质不同,A错误;原子核外M层上仅有两个电子的X原子是Mg,原子核外N层上仅有两个电子的Y原子不一定是Ca,还可以为副族元素,二者的性质不一定相似,B错误;2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子分别是第ⅣA族的C和Si,性质相似,C正确;最外层都只有一个电子的X、Y原子可以是H和Na等,性质不同,D错误。
答案: C
6.某元素+3价离子的电子排布式为1s22s22p63s23p63d5,则该元素在周期表中的位置为( )
A.ⅤB族 B.ⅢB族
C.Ⅷ族 D.ⅤA族
解析: 由离子的电子排布式可推出原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布为3d64s2,因为共有8个价电子,所以为Ⅷ族。
答案: C
7.(2016·华中师大附中模拟)长式周期表共有18个纵行,从左到右排为1~18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是 ( )
A.第9列中元素中没有非金属元素
B.只有第二列的元素原子最外层电子排布为ns2
C.第四周期第9列元素是铁元素
D.第10、11列为ds区
解析: A.第9列中元素是第Ⅷ族元素,都是金属元素,没有非金属元素,正确;B.第2列的元素原子最外层电子排布为ns2,此外He核外电子排布是1s2,也符合该最外层电子排布,错误;C.第四周期第9列元素是Co元素,错误;D.第11、12列元素为ds区,错误。
答案: A
8.下列说法中正确的是( )
A.第三周期所包含的元素中钠的原子半径最小
B.钠的第一电离能比镁的第一电离能大
C.在所有元素中,氟的电负性最大
D.电子云示意图中的每个小黑点都表示一个电子
解析: 同一周期,从左到右,原子半径逐渐减小,第三周期所包含的元素中钠的原子半径最大,A错误;同一周期,从左到右,虽然有个别特殊性,但总体上元素第一电离能是逐渐增大的,钠的第一电离能比镁的第一电离能小,B错误;电负性就是以氟作为标准的,氟的电负性最大,C正确;电子云示意图中的小黑点的疏密代表电子在这一区域出现机会的大小,D错误。
答案: C
9.
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是 ( )
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是形成基态离子转移的电子数
解析: 对于第三周期11~17号元素,随着原子序数的增大,第一电离能呈现增大的趋势,但Mg、P特殊,A项错误;原子半径逐渐减小,C项错误;形成基态离子转移的电子数依次为:Na为1,Mg为2,Al为3,Si不易形成离子,P为3,S为2,Cl为1,D项错误。
答案: B
10.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成的化合物中,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X的弱于Y的
D.气态氢化物的稳定性:HmY小于HnX
解析: 由题意,非金属性X>Y,所以最高价含氧酸的酸性:X的强于Y的。
答案: C
11.现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3
④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
解析: ①~④四种元素分别为S、P、N、F,第一电离能F>N、P>S,又由于第一电离能N>P,所以A项正确;原子半径N>F,故B项错误;电负性应S>P,即①>②,故C项错误;F无正化合价,N、S、P最高正化合价分别为+5、+6、+5价,故应为①>③=②,D项错误。
答案: A
12.(2016·山西临汾质检)X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
解析: 根据题意,Z为Mg元素,Y原子最外层电子排布为ns2np2,是C或Si元素,X为N或O元素,W为Al或Cl元素,N的氢化物的水溶液显碱性,但O的氢化物的水溶液显中性或弱酸性,A错误;Al3+的半径比Mg2+小,Cl-半径比Mg2+大,B错误;氮气、氧气均能与镁反应,C正确;CO2形成的晶体熔沸点低,D错误。
答案: C
13.已知X、Y、Z、W、Q、R、E七种元素中,原子序数X
查看更多