广东省2021版高考化学一轮复习单元质检卷十化学实验基础含解析 人教版
单元质检卷十 化学实验基础
(时间:45分钟 满分:100分)
一、选择题(本题共5小题,每小题8分,共40分。每小题只有一个选项符合题目要求)
1.(2019浙江4月选考,11)针对下列实验现象表述不正确的是( )
A.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B.在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D.将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
2.(2020北京通州质检)学习和研究化学,经常要进行实验。安全是顺利进行实验及避免伤害和事故的保障。下列说法不正确的是( )
A.将剩余的钠块直接投进垃圾箱
B.电石(主要成分为CaC2)在干燥环境中密封存放
C.用CCl4萃取碘,振荡分液漏斗后要打开活塞放气
D.电器失火要先切断电源
3.(2020湖南株洲调研)下列根据实验操作和现象所得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
向某溶液中加入盐酸酸化的BaCl2溶液
生成白色沉淀
该溶液中不一定含有SO42-
B
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液,再向上层溶液中滴加溴水
实验现象1:上层溶液不变红,下层溶液紫红色
实验现象2:上层溶液变红
还原性:
I->Fe2+>Br-
C
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
D
同温下,将纯净的乙烯、乙炔气体分别通入同浓度、同体积的酸性KMnO4溶液中
褪色所需时间:t(乙烯)
CC键
9
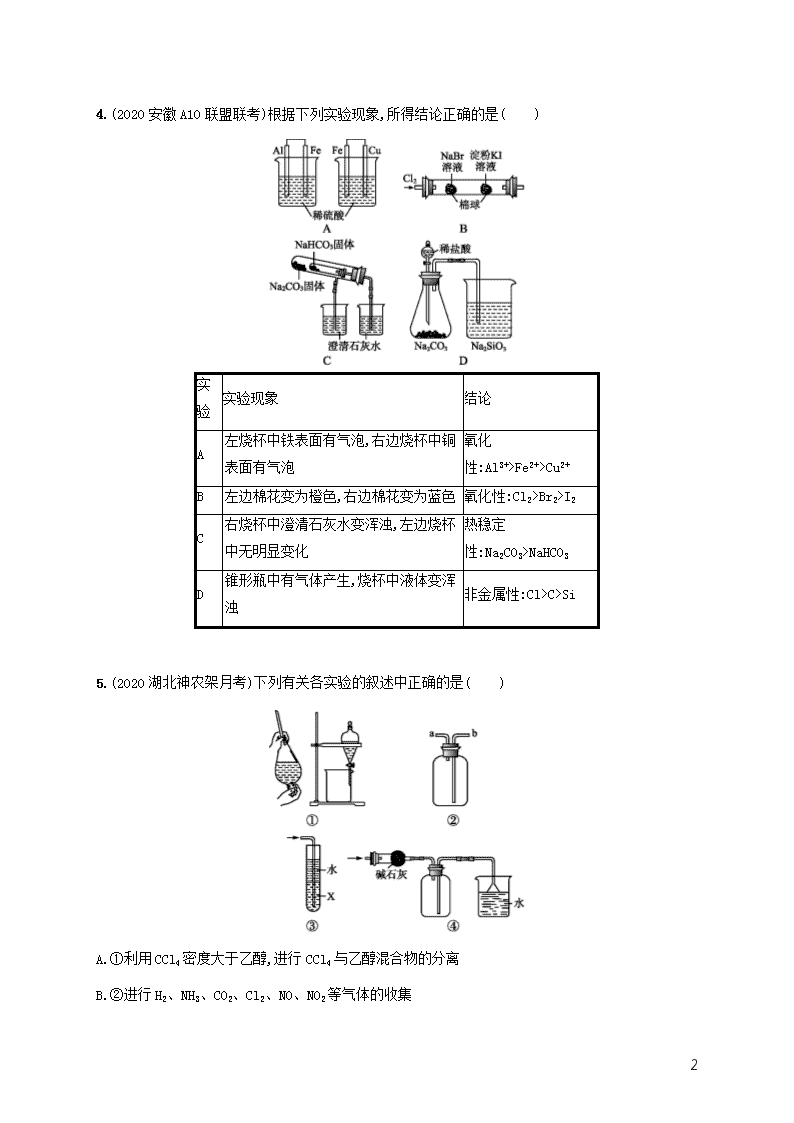
4.(2020安徽A10联盟联考)根据下列实验现象,所得结论正确的是( )
实验
实验现象
结论
A
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
氧化性:Al3+>Fe2+>Cu2+
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化
热稳定性:Na2CO3>NaHCO3
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
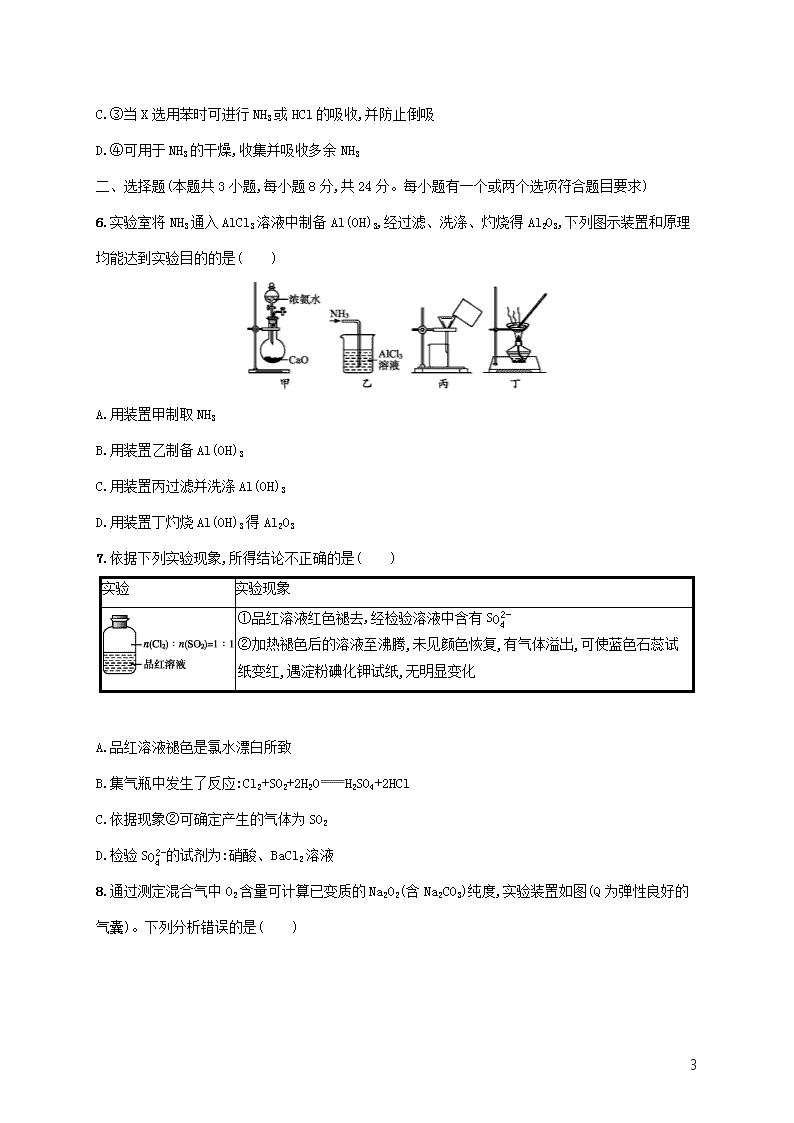
5.(2020湖北神农架月考)下列有关各实验的叙述中正确的是( )
A.①利用CCl4密度大于乙醇,进行CCl4与乙醇混合物的分离
B.②进行H2、NH3、CO2、Cl2、NO、NO2等气体的收集
9
C.③当X选用苯时可进行NH3或HCl的吸收,并防止倒吸
D.④可用于NH3的干燥,收集并吸收多余NH3
二、选择题(本题共3小题,每小题8分,共24分。每小题有一个或两个选项符合题目要求)
6.实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的的是( )
A.用装置甲制取NH3
B.用装置乙制备Al(OH)3
C.用装置丙过滤并洗涤Al(OH)3
D.用装置丁灼烧Al(OH)3得Al2O3
7.依据下列实验现象,所得结论不正确的是( )
实验
实验现象
①品红溶液红色褪去,经检验溶液中含有SO42-
②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化
A.品红溶液褪色是氯水漂白所致
B.集气瓶中发生了反应:Cl2+SO2+2H2OH2SO4+2HCl
C.依据现象②可确定产生的气体为SO2
D.检验SO42-的试剂为:硝酸、BaCl2溶液
8.通过测定混合气中O2含量可计算已变质的Na2O2(含Na2CO3)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )
9
A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成分是O2、CO2
C.测定气体总体积必须关闭K1、K2,打开K3
D.读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
三、非选择题(本题共2小题,共36分)
9.(2020湖北荆门调研)(16分)某学习小组探究稀硝酸、浓硝酸与铜的反应。
装置(尾气处理装置略)
现象
Ⅰ中开始无明显现象,逐渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色
(1)试管Ⅰ中Cu与稀硝酸反应的化学方程式是 。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是 。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中, (填“操作”和“现象”),证实Ⅱ中溶解了NO2。
9
②向另一份溶液加入 (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀硝酸与铜反应生成NO、浓硝酸与铜反应生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会 (填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O2HNO3+NO
①B中盛放的试剂是 。
②C中盛放Cu(NO3)2和 。
③该小组证实推测的合理性所依据的实验现象是 。
10.(2020安徽合肥重点中学联考)(20分)某实验小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,他们进行了如下实验:
①氨的测定:精确称取w g X,加适量水溶解,注入下图所示的蒸馏烧瓶中(夹持和加热仪器略去),然后逐滴加入足量10% NaOH溶液,加热烧瓶将氨蒸出,用V1 mL c1 mol·L-1的盐酸吸收蒸出的氨,然后取下锥形瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl。终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X配成溶液,用K2CrO4溶液为指示剂,用AgNO3标准溶液滴定,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
9
(1)X的制备过程中,温度不能过高,其原因是 。
(2)仪器a的名称是 ;测定氨前应该对装置进行气密性检验,若气密性不好则测定结果将 (填“偏高”或“偏低”)。该滴定过程中选择 做指示剂。
(3)样品中氨的质量分数表达式为 。
(4)测定氯的过程中,AgNO3标准溶液置于 (填“无色”或“棕色”)滴定管中;滴定终点时,溶液中已检测不到Cl-[c(Cl-)≤1.0×10-5 mol·L-1],则出现砖红色沉淀时,溶液中c(CrO42-)的最小值为 mol·L-1。[已知:Ksp(AgCl)=1.0×10-10,Ksp(Ag2CrO4)=1.12×10-12]
(5)经测定分析,样品X中钴、氨和氯的物质的量之比为1∶6∶3,则制备X的化学方程式为 。
(6)某同学向CoCl2溶液中加入足量(NH4)2C2O4得到CoC2O4沉淀,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为1.344 L(标准状况),则所得钴氧化物的化学式为 。
单元质检卷十 化学实验基础
1.A A项,常温下,1体积水最多可溶解2体积的氯气,因此20mL不可能将80mL氯气完全溶解,且氯气溶于水,溶液变为浅黄绿色,所以错误,符合题意;B项,浓硫酸可以使胆矾失去结晶水而变为无水硫酸铜,因此固体由蓝色变为白色,所以正确,不符合题意;C项,二氧化硫能被双氧水氧化生成硫酸根离子,硫酸根离子与Ba2+结合生成硫酸钡沉淀,所以正确,不符合题意;D项,镁与二氧化碳可以反应生成氧化镁和单质碳,因此有白色和黑色固体生成,所以正确,不符合题意。
2.A Na与水反应产生氢氧化钠和氢气,反应放出热量,当达到一定温度时会着火燃烧,所以一定要将剩余的钠块再放回试剂瓶中,A错误;CaC2与水反应产生可燃性气体乙炔,所以电石一定要在干燥环境中密封存放,B正确;用CCl4萃取碘水中的碘单质,在振荡分液漏斗时,分液漏斗内的物质由于部分物质汽化会导致气体压强增大,所以要不时打开活塞放气,C正确;电器失火时为了防止火灾加剧,带来更大隐患,首先要先切断电源,D正确。
9
3.C 白色沉淀可能为AgCl或BaSO4,则该溶液中不一定含有SO42-,A项不符合题意;由现象可知,溴先氧化I-,后氧化Fe2+,可知还原性是I->Fe2+>Br-,B项不符合题意;过氧化钠与水反应生成氧气,若过氧化钠变质,则粉末的成分中有Na2CO3,Na2CO3与盐酸反应生成二氧化碳,O2、CO2均为无色气体,则根据加盐酸生成气体不能判断Na2O2未变质,C项符合题意;乙烯比乙炔先褪色说明碳碳双键的稳定性小于碳碳叁键的,D项不符合题意。
4.C 根据烧杯中的实验现象判断金属性为Al>Fe>Cu,则氧化性为Al3+Br2>I2结论,B错误;碳酸钠在外部,所受温度高,碳酸氢钠在里面的小试管内,受热温度低,当右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化时,说明碳酸氢钠分解产生二氧化碳气体,所以碳酸钠的热稳定性强于碳酸氢钠,C正确;盐酸易挥发,烧杯内的溶液变浑浊,不能证明是二氧化碳与硅酸钠溶液发生了反应,有可能是挥发的HCl与硅酸钠溶液发生了反应,所以不能判断C与Si的非金属性的强弱,盐酸不是最高价含氧酸,因此也不能说明Cl与C的非金属性强弱,D错误。
5.D 四氯化碳与乙醇互溶,不能用分液法分离,应该用分馏法进行分离,A项错误;②能进行向下排空气法和向上排空气法收集气体,因为NO能与空气中的氧气反应,所以不能用排空气法收集NO,B项错误;苯的密度小于水,苯应在上层,C项错误;NH3为碱性气体,不能与碱石灰发生反应,因此能用于干燥NH3,NH3易溶于水,可以用水吸收多余的NH3,但要防倒吸,D项正确。
6.A 氧化钙与氨水反应且放热,有利于氨气的产生,A正确;因氨气极易溶于水,直接将氨气通入氯化铝溶液中易发生倒吸而不安全,故B错误;过滤时应用玻璃棒引流,故C错误;加热灼烧固体应在坩埚中进行而不是在蒸发皿中进行,故D错误。
7.CD 氯水中的次氯酸能使品红溶液褪色,选项A正确;集气瓶中氯气与二氧化硫发生氧化还原反应生成硫酸和盐酸,反应方程式为Cl2+SO2+2H2OH2SO4+2HCl,选项B正确;依据现象②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,说明不含有二氧化硫,产生的气体可能为次氯酸分解产生的O2,选项C不正确;检验SO42-的试剂为盐酸、BaCl2溶液,往溶液中先加入过量的盐酸酸化,再滴加BaCl2溶液,若产生白色沉淀则溶液中含有SO42-,选项D不正确。
8.D 加入硫酸与样品反应在Q气球中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ
9
中排水测氧气的量,进而计算过氧化钠的量,选项A、选项B都正确;测定气体的总体积是利用Q气球的膨胀将瓶中的空气挤入右边进行排水量气,所以必须关闭K1、K2,打开K3。选项C正确;读完气体总体积后,关闭K3,缓缓打开K1,还要再打开K2,才可观察到Q气球慢慢缩小,原因是不打开K2体系是密闭的,气球体积无法减小,选项D错误。
9.答案:(1)3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
(2)硝酸浓度大
(3)向上拉动活塞a,试管内液面上方出现红棕色气体,溶液变为蓝色 Cu(OH)2(或CuO等)
(4)增多 水 浓硝酸 C中溶液变绿
解析:(1)试管Ⅰ中Cu与稀硝酸反应产生硝酸铜、一氧化氮和水,反应的化学方程式为3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O。
(2)Ⅱ中是铜与浓硝酸反应,产生硝酸铜、二氧化氮和水,Ⅱ中物质浓度大,反应速率快。
(3)①若溶液颜色差异是NO2溶解所致,则可以通过向上拉动活塞a,减小装置中NO2在溶液中的溶解度,就会看到试管内液面上方出现红棕色气体,同时可观察到溶液的颜色变为蓝色;
②若向另一份溶液中加入含有Cu元素的物质,如CuO、Cu(OH)2等,物质溶解,使溶液中Cu2+浓度增大,若溶液变为蓝色。证实假设1不成立,假设2成立。
(4)解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会增多,被还原为较低的价态;
解释2.①Cu与浓硝酸反应产生NO2气体,NO2气体与B中水发生反应:3NO2+H2O2HNO3+NO,将产生的NO气体通入到C溶液中。②C中含有较多的NO3-,盛放Cu(NO3)2和浓硝酸,若C中溶液变为绿色,就证明解释1正确,否则2正确。
10.答案:(1)温度过高过氧化氢分解,氨气逸出
(2)直形冷凝管 偏低 甲基橙
(3)(c1V1-c2V2)×10-3×17w×100%
(4)棕色 0.011 2
(5)2CoCl2+2NH4Cl+6NH3+H2O22[Co(NH3)4]Cl3+2H2O
(6)Co3O4
9
解析:(1)根据题中所给信息,制备X所需的原料有过氧化氢和液氨,温度过高时过氧化氢分解,同时液氨转化成氨气逸出。
(2)仪器a为直形冷凝管;若气密性不好,氨气会泄漏,吸收氨气的量减少,测定结果偏低;根据题中信息,蒸出的氨气被盐酸吸收生成NH4Cl,溶液显酸性,因此用NaOH滴定过剩的HCl,使用的指示剂为甲基橙。
(3)①中与氨气反应的n(HCl)=(V1×10-3L×c1mol·L-1-V2×10-3L×c2mol·L-1)=(V1c1-V2c2)mol,根据氨气与HCl反应NH3+HClNH4Cl可知,n(NH3)=(V1c1-V2c2)mol,则氨的质量分数为(c1V1-c2V2)×10-3×17w×100%。
(4)AgNO3见光分解,为防止硝酸银分解,应用棕色滴定管盛放硝酸银溶液;滴定终点时,溶液检测不到Cl-,c(Cl-)≤1.0×10-5mol·L-1,根据氯化银的溶度积常数可以计算出溶液中c(Ag+)≥1.0×10-5mol·L-1,溶液中c(CrO42-)最小值为c(CrO42-)=Ksp(Ag2CrO4)c2(Ag+)=1.12×10-12(1.0×10-5)2mol·L-1=0.0112mol·L-1。
(5)X中钴、氨、氯的物质的量之比为1∶6∶3,则X的化学式为[Co(NH3)6]Cl3,制备X的反应中,Co的化合价升高,H2O2作氧化剂,因此反应的化学方程式为2CoCl2+2NH4Cl+6NH3+H2O22[Co(NH3)4]Cl3+2H2O。
(6)n(CO2)=1.344L22.4L·mol-1=0.06mol,根据化学式CoC2O4以及原子守恒,可推出n(Co)=0.06mol2=0.03mol,则氧化物中n(O)=2.41g-0.03mol×59g·mol-116g·mol-1=0.04mol,n(Co)∶n(O)=0.03∶0.04=3∶4,因此钴氧化物的化学式为Co3O4。
9