- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氯气的生产原理教案(1)
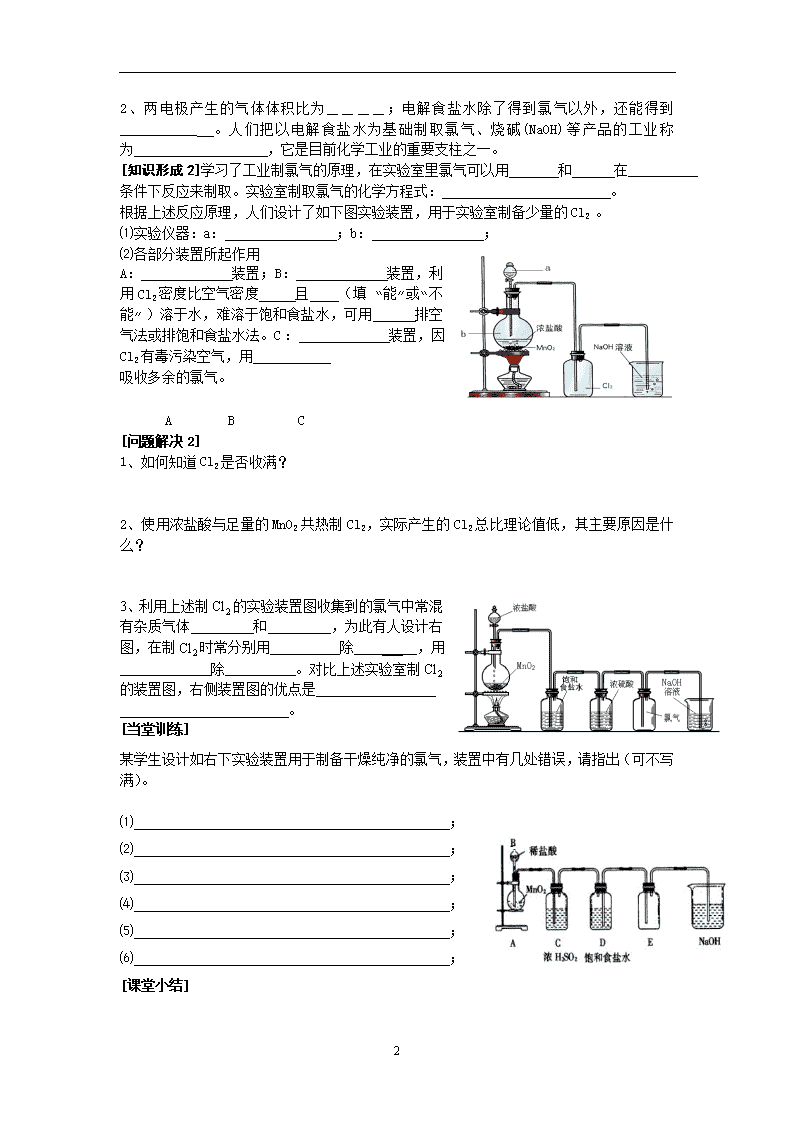
2.1.1 氯气的生产原理 评价 签字 班级_______姓名_________学号_______ [学习目标] 1、了解从海水中获得Cl2的基本原理和方法; 2、了解氯气的实验室制法; [调查研究]浩瀚的大海,巨大的宝藏。在众多的自然资源中,海水是十分重要的资源之一,能利用的海水中富含的化学物质如:NaCl、MgCl2、NaBr、NaI等。椐估计:每立方千米的海水中含NaCl 4×107t,查阅有关资料,了解人们是如何从海水中获得氯化钠和使用氯化钠的。并将有关情况与同学们交流讨论。 [新课导入]从海水晒盐得到的食盐,除去杂质后,不仅可以作调料,还可以作为工业原料。19世纪,科学家发明了电解饱和食盐水制取氯气的方法,为工业制氯气奠定了基础。 [知识形成1] ⑴接通电源,观察两极现象; ⑵通电一段时间后,用小试管收集U形管左端产生的气体,2min后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,检验收集到的气体; ⑶取一只小试管,用向上排空法收集从U形管右端导出的气体,观察收集到气体的颜色; ⑷关闭电源,打开U形管两端的橡皮塞,分别向溶液中滴加1~2滴酚酞溶液,观察现象; 将上述实验中观察到的现象和所得结论填入下表。 实验现象 结论 ⑴ ⑵ ⑶ ⑷ 根据实验现象推断,电解饱和食盐水: ①化学方程式:__________________________ ②与电源正极相连的电极(阳极)上产生__气;与电源负极相连的电极(阴极)上产生__气。 [问题解决1] 1、b端为何要通入氢氧化钠溶液? 4 2、两电极产生的气体体积比为____;电解食盐水除了得到氯气以外,还能得到___________ 。人们把以电解食盐水为基础制取氯气、烧碱(NaOH)等产品的工业称为 ,它是目前化学工业的重要支柱之一。 [知识形成2]学习了工业制氯气的原理,在实验室里氯气可以用 和 在__________条件下反应来制取。实验室制取氯气的化学方程式: 。 根据上述反应原理,人们设计了如下图实验装置,用于实验室制备少量的Cl2 。 ⑴实验仪器:a: ;b: ; ⑵各部分装置所起作用 A: 装置;B: 装置,利用Cl2密度比空气密度 且 (填 “能”或“不能”)溶于水,难溶于饱和食盐水,可用 排空气法或排饱和食盐水法。C: 装置,因Cl2有毒污染空气,用 吸收多余的氯气。 A B C [问题解决2] 1、如何知道Cl2是否收满? 2、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么? 3、利用上述制Cl2的实验装置图收集到的氯气中常混有杂质气体 和 ,为此有人设计右图,在制Cl2时常分别用 除 ___ ,用 除 。对比上述实验室制Cl2的装置图,右侧装置图的优点是 。 [当堂训练] 某学生设计如右下实验装置用于制备干燥纯净的氯气,装置中有几处错误,请指出(可不写满)。 ⑴ ; ⑵ ; ⑶ ; ⑷ ; ⑸ ; ⑹ ; [课堂小结] 4 [课外练习](选择题每题有1-2个答案) 1.海水中含量最多的离子是 ( ) A.钠离子 B.氯离子 C.钙离子 D.镁离子 2.在电解饱和食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,不正确的操作顺序是 ( ) ①过滤 ②加稍过量的NaOH溶液 ③加适量的盐酸 ④加稍过量的碳酸钠溶液 ⑤加稍过量的氯化钡溶液 A.⑤④②①③ B.④⑤②①③ C.②⑤④①③ D.⑤②④①③ 3.如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解片刻,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是 ( ) A. Cl2 B.O2 C.H2 D.HCl 4.若电解的是未精制的饱和食盐水(即是粗盐溶于水),结果很快在某一电极附近出现浑浊现象,造成浑浊的难溶物主要是 ( ) A.碳酸镁 B.硫酸钡 C.氢氧化镁 D.碳酸钡 5.下列物质中,可以用来除去Cl2中的水蒸气的是 ( ) ①碱石灰 ②浓硫酸 ③无水CaCl2 ④固体烧碱 A. ①② B. ①③④ C. ②③ D. ①②③④ 6.实验室制取氧气的试管壁上粘附有MnO2,除去粘附的MnO2可用的试剂是 ( ) A. 蒸馏水 B. KOH溶液 C. 稀盐酸 D. 热的浓盐酸 7.用下列两种方法制取氯气:①用含氯化氢146克的浓盐酸与足量的二氧化锰反应②用87克二氧化锰与足量的浓盐酸反应,则所得氯气 ( ) A.②比①多 B.①比②多 C.一样多 D.无法比较 8.将两个石墨电极插入500ml食盐水中进行电解,通电到一定时间后,某一电极收集到标准状况下224ml气体(设电解时溶液体积无变化)。此时溶液中氢氧化钠的物质的量浓度约为 ( ) A.0.2mol/L B. 0.1mol/L C. 0.04mol/L D. 0.02mol/L 9.在U型管里装入饱和食盐水,滴入几滴酚酞试液,用一根碳棒作阳极,一根铁棒作阴极,把湿润的碘化钾淀粉试纸放在阳极附近。接通直流电后,可以观察到U型管的两个电极上都有 ,阳极放出的气体有 气味,并且能使湿润的碘化钾淀粉试纸 ,说明放出的是 ;阴极放出的气体是 ,同时发现阴极附近溶液 ,这说明溶液里有 性物质生成。电解饱和食盐水的化学方程式为 。 10.实验室制氯气有如下操作,正确的操作顺序是_________ ① 缓缓加热 ;②加入MnO2粉末;③连好装置,检查气密性;④ 4 从装有浓盐酸的分液漏斗中加浓盐酸;⑤将多余氯气用NaOH溶液吸收;⑥向上排气收集氯气; 11.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: ⑴在电解过程中,与电源正极相连的电极上的产物是________;与电源负极相连的电极附近溶液中c(OH-) ________(选填:“不变”、“增大”或“减小”); ⑵工业食盐中含Ca2+、Mg2+等杂质,精制过程分别除去Ca2+、Mg2+应选用的试剂是:________,________; ⑶如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_______(填a,b,c); a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 ⑷为有效除去Ca2+、Mg2+ 、SO42-,加入试剂的合理顺序为________(选填a,b,c。); a.先加NaOH,再加Na2CO3,再加钡试剂 b.先加NaOH,后加钡试剂,再加Na2CO3 c.先加钡试剂,后加NaOH,再加Na2CO3 ⑸脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________,冷却,________,________,(填写操作名称)除去NaCl。 ⑹电解饱和食盐水时,总的反应方程式为: ; 12.右图表示在没有通风橱的条件下制备氯气时设计的装置, 图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。) ⑴仪器C的名称是 ;水槽中应盛放的是 ;烧杯中盛放的是 ;圆底烧瓶中发生反应的化学方程式为: ; ⑵在收集氯气时,应打开 ,关闭___。当氯气收集完毕时打开 ,关闭___。(填A或B或C) ⑶ 若要制得标准状况下的Cl2 0.672L,理论上需要MnO2的物质的量是多少? 4查看更多