- 2021-08-24 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省宜宾市第四中学2020届高三下学期高考适应性考试理综-化学试题
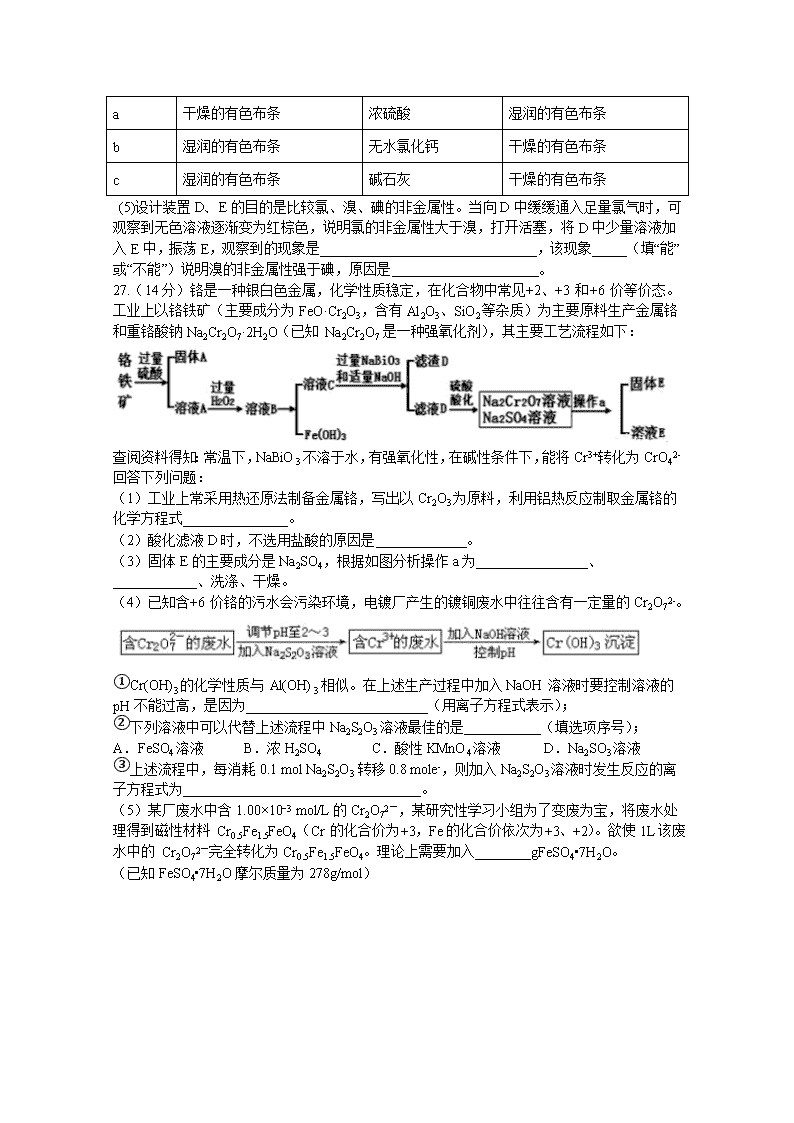
7.科学防护对预防病毒感染非常重要,下列说法错误的是 A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间 B.制作防护服和口罩的无纺布是有机高分子材料 C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性 D.二氧化氯泡腾片可用于水处理 8.化合物c的制备原理如下: 下列说法正确的是 A.该反应为加成反应 B.化合物a中所有原子一定共平面 C.化合物C的一氯代物种类为5种 D.化合物b、c均能与NaOH溶液反应 9.下列实验及现象不能得出相应结论的是 选项 实验 现象 结论 A 某溶液中滴加K3[(Fe(CN)6]溶液 产生蓝色沉淀 原溶液中有 Fe2+ B 将CO2依次通过 NaHSO3溶液、品红溶液 品红溶液不褪色 H2SO3的酸性强于比H2CO3 C 向 l mL 新制氢氧化铜悬浊液中滴加适量 10 %葡萄糖溶液,加热煮沸 产生砖红色沉淀 葡萄糖具有还原性 D 向 lmL0. l mol/L AgNO3溶液中滴加4~5 滴 0.l mol/L KI 溶液,再滴加几滴 0. 1mo l/L Na2S 溶液 先有黄色沉淀生成;后又有黑色沉淀 Ksp (AgI )> Ksp (Ag2S) A.A B.B C.C D.D 10.W、X、Y、Z 均为短周期主族元素,X与Z同族,X核外电子总数等于Y最外层电子数,Y是短周期中非金属性最强的元素,W与Z的最高化合价之和为8, 且W原子半径小于Z。下列叙述正确的是 A.气态简单氢化物的稳定性:Z>X>W B.W和Y可形成共价化合物WY3,且WY3中W、Y均满足最外层 8 电子稳定结构 C.常温下,0.l mol•L-1Z的最高价氧化物对应水合物水溶液的 pH >l D.常温下,与W同族且相邻元素的单质能溶于X的最高价氧化物对应水化物的浓溶液。 11.下列指定反应的离子方程式正确的是 A. 钠与水反应: Na +2H2O=Na++2OH– + H2↑ B. 电解饱和食盐水获取烧碱和氯气: 2Cl–+2H2OH2↑+ Cl2↑+2OH– C. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH– + H+ + SO42-=BaSO4↓+H2O D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++ HCO3-+OH–=CaCO3↓+H2O 12.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是 A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g C. 石墨烯的作用主要是提高电极a的导电性 D. 电池充电时间越长,电池中Li2S2的量越多 13.我国科学家开发设计一种天然气脱硫装置,利用如右图装置可实现:H2S+O2→H2O2 +S。已知甲池中有如下的转化: 下列说法错误的是: A. 该装置可将光能转化为电能和化学能 B. 该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池 C. 甲池碳棒上发生电极反应:AQ+2H+ +2e- =H2AQ D. 乙池①处发生反应:H2S+I3- =3I-+S↓+2H+ 26.(14分)化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题: (1)仪器a的名称是______________。 (2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。 (3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。 (4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。 选项 Ⅰ Ⅱ Ⅲ a 干燥的有色布条 浓硫酸 湿润的有色布条 b 湿润的有色布条 无水氯化钙 干燥的有色布条 c 湿润的有色布条 碱石灰 干燥的有色布条 (5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。 27.(14分)铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3 和+6 价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知 Na2Cr2O7 是一种强氧化剂),其主要工艺流程如下: 查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42- 回答下列问题: (1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。 (2)酸化滤液D时,不选用盐酸的原因是_____________。 (3)固体E的主要成分是Na2SO4,根据如图分析操作a为________________、____________、洗涤、干燥。 (4)已知含+6 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。 ①Cr(OH)3的化学性质与 Al(OH)3相似。在上述生产过程中加入NaOH 溶液时要控制溶液的pH不能过高,是因为__________________________(用离子方程式表示); ②下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是___________(填选项序号); A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液 ③上述流程中,每消耗0.1 mol Na2S2O3 转移0.8 mole-,则加入Na2S2O3溶液时发生反应的离子方程式为__________________________________。 (5)某厂废水中含1.00×10−3 mol/L的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Cr 的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的 Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________gFeSO4•7H2O。 (已知FeSO4•7H2O摩尔质量为278g/mol) 28.(15分).(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。 已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol 试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_______________。 (2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有: 甲:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1 乙:CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2 ①CO(g)+2H2(g) CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。 ②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。 ③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。 温度(K) 催化剂 CO2转化率(%) 甲醇选择性(%) 综合选项 543 Cu/ZnO纳米棒材料 12.3 42.3 A 543 Cu/ZnO纳米片材料 11.9 72.7 B 553 Cu/ZnO纳米棒材料 15.3 39.1 C 553 Cu/ZnO纳米片材料 12.0 70.6 D 由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。 (3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。 ①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。 ②三个容器中一定达到平衡状态的是容器________(填写容器代号)。 35.(15分)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。 (1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。 (2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。 (3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。 (4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。 (5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。 36.(15分)氨甲环酸(G)别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略): 回答下列问题: (1)A的结构简式是____。C的化学名称是_______。 (2)G在NaOH催化下发生双分子脱水形成仅含两个环的有机物,写出该反应的化学反应方程式____。 (3)①~⑥中属于取代反应的是_________。 (4)E中不含N原子的官能团名称为___________。 (5)氨甲环酸(G)的分子式为__________。 (6)满足以下条件的所有E的同分异构体有_____种。 a.含苯环 b.含硝基 c.苯环上只有两个取代基 (7)写出以和CH2=CHCOOCH2CH3为原料,制备的合成路线:_______(无机试剂任性) 化学答案 6-13:A D D C B D B 26.长颈漏斗 Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O 0.5 液体进入长颈漏斗中,锥形瓶内液面下降,长颈漏斗内液面上升,形成一段液柱 b 溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2 27.Cr2O3+2AlAl2O3+2Cr Cr2O72-会氧化Cl-生成氯气,造成污染 蒸发结晶 趁热过滤 Cr(OH)3 +OH-=CrO2-+2H2O D 3S2O32- +4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 2.78 28.8CO2(g)+25H2(g)=C8H18(1)+16H2O(1) ΔH=—(25a-b)KJ/mol K= 小于 降低温度、减小产物浓度 B 0.0875mol/(L·min) Ⅲ 35.晶体 1 1s22s22p63s23p63d9 Cu(NH3)4SO4•H2O 离子键、极性共价键和配位键 sp3杂化、sp3杂化 5NA 异硫氰酸分子间可形成氢键,而硫氰酸不能 4 36.CH2=CHCH=CH2 2-氯-1,3-丁二烯 ④⑤ 酯基、碳碳双键 C8H15O2N 15 查看更多