- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省临沂市2019-2020学年高二下学期期末考试化学试题 Word版含答案
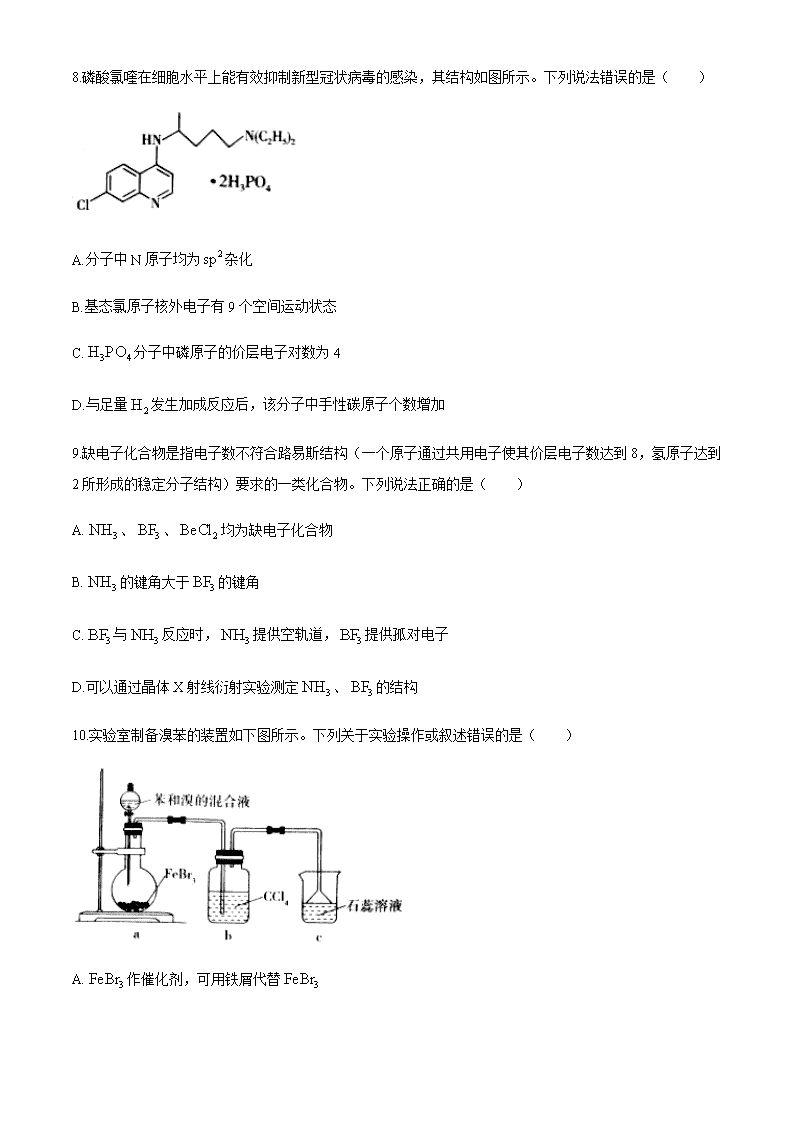
临沂市2019-2020学年高一下学期期末考试 化学试题 2020.7 1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。 2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。 3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 C1 35.5 Fe 56 Cu 64 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.化学与生活密切相关。下列说法错误的是( ) 4.医疗上常用体积分数为75%的乙醇溶液作消毒剂 B.疫苗一般应冷藏存放,以避免蛋白质变性 C.古代的蜡是高级脂肪酸酯,属于高分子聚合物 D.淀粉和纤维素水解的最终产物均为葡萄糖 2.某元素基态原子M层上有一个未成对的单电子,则该基态原子价电子排布不可能是( ) A. B. C. D. 3.下列有关化学用语的表述正确的是( ) A.中子数为10的氧原子: B.氯离子的结构示意图: C.为碳原子的一种激发态 D.聚丙烯的结构简式: 4“辛烷值”用来表示汽油的质量,汽油中异辛烷()的爆震程度最小。下列烃与氢气加成能得到异辛烷的是( ) A.2,3,4-三甲基-1-戊烯 B.2,4,4-三甲基-2-戊烯 C.3,4,4-三甲基-2-戊烯 D.3,4,4-三甲基-1-戊炔 5.下列反应Ⅰ和反应Ⅱ属于同一种反应类型的是( ) 选项 反应Ⅰ 反应Ⅱ A 苯与浓硫酸、浓硝酸反应制备硝基苯 油脂与浓反应制备高级脂肪酸钠 B 溴乙烷与的乙醇溶液混合加热制备乙烯 乙烯与溴的四氯化碳溶液反应 C 苯酚与甲醛反应制备酚醛树脂 乙烯制备聚乙烯 D 丙烯与水反应制备丙醇 溴丙烷水解制备丙醇 6.实验室提供的玻璃仪器有试管、导管、烧杯、酒精灯、圆底烧瓶、玻璃棒(非玻璃仪器任选),选用上述仪器能完成的实验是( ) A.用乙醇制取乙烯 B.制备乙酸乙酯 C.用四氯化碳萃取碘水中的碘 D.苯甲酸的重结晶 7.设为阿伏加德罗常数的值,下列说法正确的是( ) A.中含有的数目为 B.苯中含键的数目为 C.石墨烯(单层石墨)中含有六元环的数目为 D.由乙烯和环丙烷组成的混合气体中含有的氢原子数目为 8.磷酸氯喹在细胞水平上能有效抑制新型冠状病毒的感染,其结构如图所示。下列说法错误的是( ) A.分子中N原子均为杂化 B.基态氯原子核外电子有9个空间运动状态 C.分子中磷原子的价层电子对数为4 D.与足量发生加成反应后,该分子中手性碳原子个数增加 9.缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法正确的是( ) A.、、均为缺电子化合物 B.的键角大于的键角 C.与反应时,提供空轨道,提供孤对电子 D.可以通过晶体X射线衍射实验测定、的结构 10.实验室制备溴苯的装置如下图所示。下列关于实验操作或叙述错误的是( ) A.作催化剂,可用铁屑代替 B.装置b的作用是吸收挥发的苯和溴蒸气 C.装置c中石蕊溶液变为红色,可证明苯与溴发生取代反应 D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。 11.化合物N具有抗菌、消炎作用,可由M制得。 下列有关化合物M、N的说法正确的是( ) A.M、N分子中的两个苯环一定处于同一平面 B.最多能与反应 C.N与乙醇发生酯化反应可得到M D.M、N均能与溴水和酸性溶液反应 12.下列由实验操作和现象得出的结论正确的是( ) 选项 实验操作和现象 结论 A 分别将少量钠投入到盛有水和乙醇的的烧杯中,均有气体产生 乙醇分子中的氢与水分子中的氢具有相同的活性 B 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性 C 室温下,向苯酚钠溶液中通入,溶液变浑浊 碳酸的酸性比苯酚的强 D 向20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液,加热;未出现银镜 蔗糖未水解 13.是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。 下列说法错误的是( ) A.原子的第一电离能为 B.键的键能为 C.的晶格能为 D.转变成需要吸收的能量为 14.W、X、Y、Z均为短周期元素,原子序数依次增加,Z是地壳中含量最高的元素,M、N是由这些元素组成的二元化合物,M和N转化为R的反应历程如下图所示。 下列叙述错误的是( ) A.第一电离能: B.生成R总反应的原子利用率为100% C.①→②放出能量并有非极性键生成 D.上述四种元素既可形成离子化合物,又可形成共价化合物 15.铁有、、三种同素异形体,其晶胞结构如下图所示,设为阿伏加德罗常数的值。 下列说法正确的是( ) A.晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有8个 B.晶体的空间利用率: C.晶胞中的原子堆积方式为六方最密堆积 D.铁原子的半径为,则晶胞的密度为 三、非选择题:本题共5小题,共60分。 16.(11分)一定条件下,有机化合物Y可发生重排反应: 回答下列问题: (1)X中含氧官能团的名称是_______________;鉴别Y、Z可选用的试剂是___________。 (2)实验测得Z的沸点比X的高,其原因是_________________________。 (3)Y与足量溶液反应的化学方程式是___________________________。 (4)与Y具有相同官能团且属于芳香化合物的同分异构体还有_______种(不考虑立体异构),其中核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1的结构简式是___________(任写一种)。 17.(12分)2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。 回答下列问题: (1)、常用作锂离子电池的正极材料。基态钻原子的价电子排布式为_____________;基态磷原子中,电子占据的最高能层符号为_________________。 (2)锂离子电池的电解液有等,碳酸亚乙酯()用作该电解液的添加剂。中阴离子的空间构型为_________________;碳酸亚乙酯分子中碳原子的杂化方式为___________。 (3)已知的半径为,的半径为,由此推断在隔绝空气条件下分别加热、,其中_____________的分解温度低,原因是_____________。 (4)是目前研发的锂离子电池的新型固体电解质,为立方晶系晶体,晶胞参数为,晶胞截面图如下图所示。 每个晶胞中含有的数目为________;填充在构成的空隙中,每一个空隙由_______个构成,空隙的空间形状为________________。 18.(12分)丙酸异戊酯是一种有水果香味的无色液体,常用作溶剂、萃取剂和调和香料等。实验室制备丙酸异戊酯的反应、装置示意图和有关数据如下。 相对分子质量 密度/() 沸点/℃ 水中溶解性 异戊醇 88 0.81 131 微溶 丙酸 74 0.99 141 易溶 丙酸异戊酯 144 0.87 156 微溶 【实验步骤】 在烧瓶中加入异戊醇、丙酸、数滴浓硫酸和2~3片碎瓷片;分水器中加入一定体积水;加热至70℃保持恒温半小时,然后提高温度使反应处于回流状态。分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。 回答下列问题: (1)仪器甲的名称是_____________。在70℃反应时温度计水银球置于_____________(填“x”或“y”)处。 (2)使用分水器能提高酯的产率,原因是____________(用平衡移动原理解释)。 (3)升温回流过程中观察到____________(填标号)现象时,说明酯化反应已基本完成。 a.分水器中出现分层 b.分水器中有液体回流至烧瓶 c.分水器中水层高度不再变化 d.仪器甲中有液体滴落 【产品提纯】 (4)操作Ⅰ中,第二次水洗的主要目的是_______________;操作Ⅱ中加入少量无水硫酸镁的目的是________________;操作Ⅲ的名称是_____________。 (5)丙酸异戊酯的产率是_________%;若反应前分水器中加水不足,会导致产率________(填“偏高”、“偏低”或“无影响”)。 19.(12分)X、Y、Z、W为原子序数依次增大的前四周期元素,X的最外层电子数是其内层电子数的3倍,Y与X同族;Z的负一价离子的最外层电子数与次外层的相同;基态最外层有18个电子。 回答下列问题: (1)上述元素中,电负性最大的是_______________(填元素名称);高温下容易转化为的原因是________________。 (2)气态单分子是_______________(填“极性”或“非极性”)分子;固体的三聚体环状结构如右图所示。该结构中键有两类,其中键长较长的是_____________(填字母)。 (3)化合物难溶于水但易溶于氨水,其原因是__________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________,该阳离子含有________键。 (4)的晶胞结构如图所示。 ①原子坐标参数A为(0,0,0);B为。 则C原子的坐标参数为_____________。 ②已知的晶胞参数为,晶体密度为,为阿伏加德罗常数的值,则的摩尔质量为__________(用代数式表示)。 20.(13分)有机物H是一种药物的中间体,其合成路线如下。 已知: ① ②(、可以是或) 回答下列问题: (1)A的化学名称为__________________;的反应类型为____________;的反应类型为___________。 (2)的化学反应方程式为_____________。 (3)B的结构简式为_____________;G的结构简式为____________。 (4)用“*”标出F中的手性碳原子。 (5)设计由两种链状不饱和酯,通过两步反应制备的合成路线(其他试剂任选)。 2018级普通高中学科素养水平监测试卷 化学试题参考答案及评分标准 2020.7 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.C 2.D 3.C 4.B 5.A 6.B 7.C 8.A 9.D 10.D 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。 11.BD 12.C 13.AB 14.A 15.AD 三、非选择题:本题共5小题,共60分 16.(11分) (1)(酚)羟基、羰基(或酮基)(2分) 浓溴水或溶液(1分) (2)Z形成分子间氢键,X形成分子内氢键,故Z的沸点比X的高(2分) (3) (2分) (4)5(2分) 或(2分) 17.(12分) (1)(1分) M(1分) (2)正四面体(1分) 、(2分) (3)(1分) 小于,结合的能力强,容易分解或小于,的晶格能大于的晶格能,分解温度低(2分) (4)4(2分) 4(1分) 正四面体(1分) 18.(12分) (1)球形冷凝管(1分) y(1分) (2)分水器分离出产物中的水,未反应的有机物回流到烧瓶,使平衡向生成酯的方向移动,提高酯的产率(2分) (3)c(2分) (4)洗去碳酸氢钠、碳酸钠(1分) 干燥除水(1分) 蒸馏(1分) (5)75(2分) 偏低(1分) 19.(12分) (1)氧(分) 的价电子排布式为,处于全充满稳定状态(1分) (2)非极性(1分) b(1分) (3)可与氨形成易溶于水的配位化合物(或配离子)(2分) (1分) 16(1分) (4)①(2分) ②(2分) 20.(13分) (1)3-甲基-1,3-戊二烯(2分)加成反应(1分)氧化反应(1分) (2)(2分) (3)(1分) (1分) (4)(2分) (5)(3分)查看更多